乙酸对脂肪代谢的影响及其作用机制
2021-06-05秦昆鹏王志云赵玉蓉
秦昆鹏 王志云 高 骞 赵玉蓉
(湖南农业大学动物科学技术学院,湖南畜禽安全生产协同创新中心,长沙 410128)
乙酸是动物体内主要的短链脂肪酸,在动物的血液、组织内和排泄物中以游离酸的形式存在。研究发现其不仅可以维持机体能量平衡及代谢稳态、影响机体免疫等[1],还对动物脂肪代谢有重要调节作用[2]。乙酸不仅可以调节脂肪细胞分化,还可以抑制机体脂肪沉积,改善和预防肥胖及肥胖相关疾病。深入研究乙酸对脂肪代谢的影响和调控机制,对于减少畜禽体内过多的脂肪沉积、提高畜禽生产的效益、减少畜禽生产过程中的饲料损失、治疗肥胖及胰岛素抵抗等肥胖相关疾病具有重要意义。本文综述了乙酸对脂肪代谢的影响及其机制。
1 乙酸的来源
在机体内,乙酸主要来源于结肠内的细菌发酵。其主要发酵底物为未消化的碳水化合物,包括抗性淀粉和膳食纤维及未吸收的糖、改性纤维素等[3]。由于近端结肠发酵底物浓度最高,所以结肠发酵主要发生在近端结肠。抗性淀粉和膳食纤维等发酵底物在糖分解菌作用下经由糖酵解途径形成丙酮酸,自丙酮酸后,在不同细菌发酵作用下可形成不同产物[4]。能够通过发酵作用产生乙酸的细菌有多种,如瘤胃球菌属、嗜黏蛋白阿克曼氏菌、雷普沃氏菌属以及拟杆菌属、双歧杆菌属和大部分肠杆菌。丙酮酸在上述微生物的作用下通过乙酰辅酶A途径可以被转化为乙酸[5]。另外,还有研究报道“Wood-Ljungdahl通路”也是微生物作用下产生乙酸的重要途径,链球菌属和羧酸菌属可以通过该通路产生乙酸[6]。除了未消化的碳水化合物,残留的蛋白质也可以作为发酵底物。随着发酵底物向结肠后端迁移,碳水化合物发酵开始终结,pH上升,蛋白质发酵逐渐活跃,肠道细菌可以分泌蛋白酶和肽酶将蛋白质降解为寡肽和氨基酸[7]。在微生物作用下谷氨酸、丝氨酸、组氨酸、半胱氨酸、蛋氨酸、脯氨酸、甘氨酸和赖氨酸都可以经氨基酸脱氨基作用生成乙酸[5]。结肠内发酵产生的乙酸主要通过“在转运体介导下的阴离子交换”和“质子化扩散”这2种方式被结肠上皮细胞顶端膜吸收,随后经门静脉快速被肝脏吸收[8]。乙酸在肝脏中的代谢较少,大部分进入外周循环,随血液运输到各个组织,并对机体代谢产生重要调控作用[9]。
2 乙酸作用的短链脂肪酸受体
G蛋白偶联受体(G protein-coupled receptor,GPR)41和43(也称为FFA3和FFA2)是目前研究确认的2种短链脂肪酸受体,均属于视紫红质样(A类)GPR,属于GPR40家族,基因位于GPR40-43基因簇上。GPR可以与不同类型的G蛋白偶联,GPR41仅与Gα(i/o)G蛋白偶联,而GPR43可以与Gαq和Gα(i/o)G蛋白偶联,并在体内发挥不同的调控作用[10]。GPR41和GPR43广泛表达于各个组织中,在脂肪细胞、免疫细胞、肠内分泌L细胞、胰岛细胞等细胞中均有表达[11]。
血液中乙酸盐的浓度为100~150 μmol/L,远高于丙酸(4~5 μmol/L)和丁酸(1~3 μmol/L)[12],处于激活短链脂肪酸受体(GPR41和GPR43)的范围内。乙酸经血液循环到达特定组织后,作为配体与GPR结合。该受体可充当鸟嘌呤核苷酸交换因子(GEF),诱导Gα亚基中的二磷酸鸟苷(GDP)转化成三磷酸鸟苷(GTP),并且和Gβγ异二聚体解离[13]。Gα亚基和Gβγ异二聚体解离之后均可触发下游效应,调节相关蛋白和基因的表达。
3 乙酸对脂肪细胞分化的影响及其作用机制
3.1 乙酸对脂肪细胞分化的影响
脂肪组织是体内高度可塑的器官,在能量平衡中起关键作用。在营养过剩的条件下,脂肪组织通过增大脂肪细胞体积或增加脂肪细胞数量来储存能量。但是,脂肪细胞的肥大会引起纤维化和炎症,促进代谢性疾病的发生。相反的是,由祖细胞分化成脂肪细胞引起的增生性生长,对于维持脂肪组织功能和预防代谢疾病有至关重要的作用[14]。大量研究表明,乙酸对于脂肪细胞的分化有促进作用。孙超等[15]报道,用乙酸分别处理小鼠前体脂肪细胞24和48 h,发现在小鼠前体脂肪细胞内脂肪分化标志物过氧化物酶体增殖物激活受体γ(PPARγ)和CCAAT/增强子结合蛋白α(C/EBPα)的mRNA表达量均显著增加,并且显著促进了前脂肪细胞的分化。在体外试验中,Hong等[16]报道,乙酸盐可以通过激活GPR43使脂肪细胞分化标志物PPARγ2的mRNA表达量显著提高,从而促进3T3-L1细胞的分化。Hu等[17]报道,用乙酸盐处理小鼠永生棕色脂肪细胞系IM-BAT细胞,发现乙酸盐可以促进IM-BAT细胞的成脂分化,其不仅使IM-BAT细胞中PPARγmRNA的表达量显著增加,同时还使在棕色脂肪细胞中特异性表达的线粒体内膜解偶联蛋白1(uncoupling protein 1,UCP1)mRNA的表达量显著增加,并且这种促进作用依赖于乙酸对GPR43的激活。
3.2 乙酸影响脂肪细胞分化的作用机制
乙酸促进脂肪细胞的分化涉及多个通路和机制,并且各个通路和机制之间互相联系和影响(图1)。乙酸可以作为配体激活前脂肪细胞上的短链脂肪酸受体GPR43,通过激活GPR43来介导脂肪细胞分化的相关通路。GPR43激活后其Gα(i/o)亚基与Gβγ亚基分离;Gα(i/o)亚基可以介导细胞外信号调节激酶1/2(ERK1/2)通路引起环磷腺苷效应元件结合蛋白(CREB)的活化;Gβγ亚基则通过介导磷脂酶C-蛋白激酶C-ERK信号通路(PLC-PKC-ERK pathway)引起CREB活化[18]。CREB是脂肪细胞分化的关键调控通路因子,其可以刺激脂肪细胞分化关键调控因子CCAAT/增强子结合蛋白β(C/EBPβ)的表达[19]。C/EBPβ不仅可以激活前脂肪细胞有丝分裂扩增期间细胞周期基因的表达,而且还可以诱导PPARγ和C/EBPα的表达[20]。PPARγ和C/EBPα两者协同控制着脂肪细胞内一些特异性基因和脂质代谢相关基因的表达,促进前脂肪细胞分化为终末脂肪细胞。另外,在脂肪细胞中特异性表达的基因也受CREB的直接调控,CREB活化后与几种脂肪细胞特异性基因——磷酸烯醇丙酮酸羧激酶(PEPCK)、脂肪酸结合蛋白(FABP)、脂肪酸合成酶(FAS)的启动子中假定cAMP反应元件(CRE)序列结合[19],从而促进上述基因的表达。
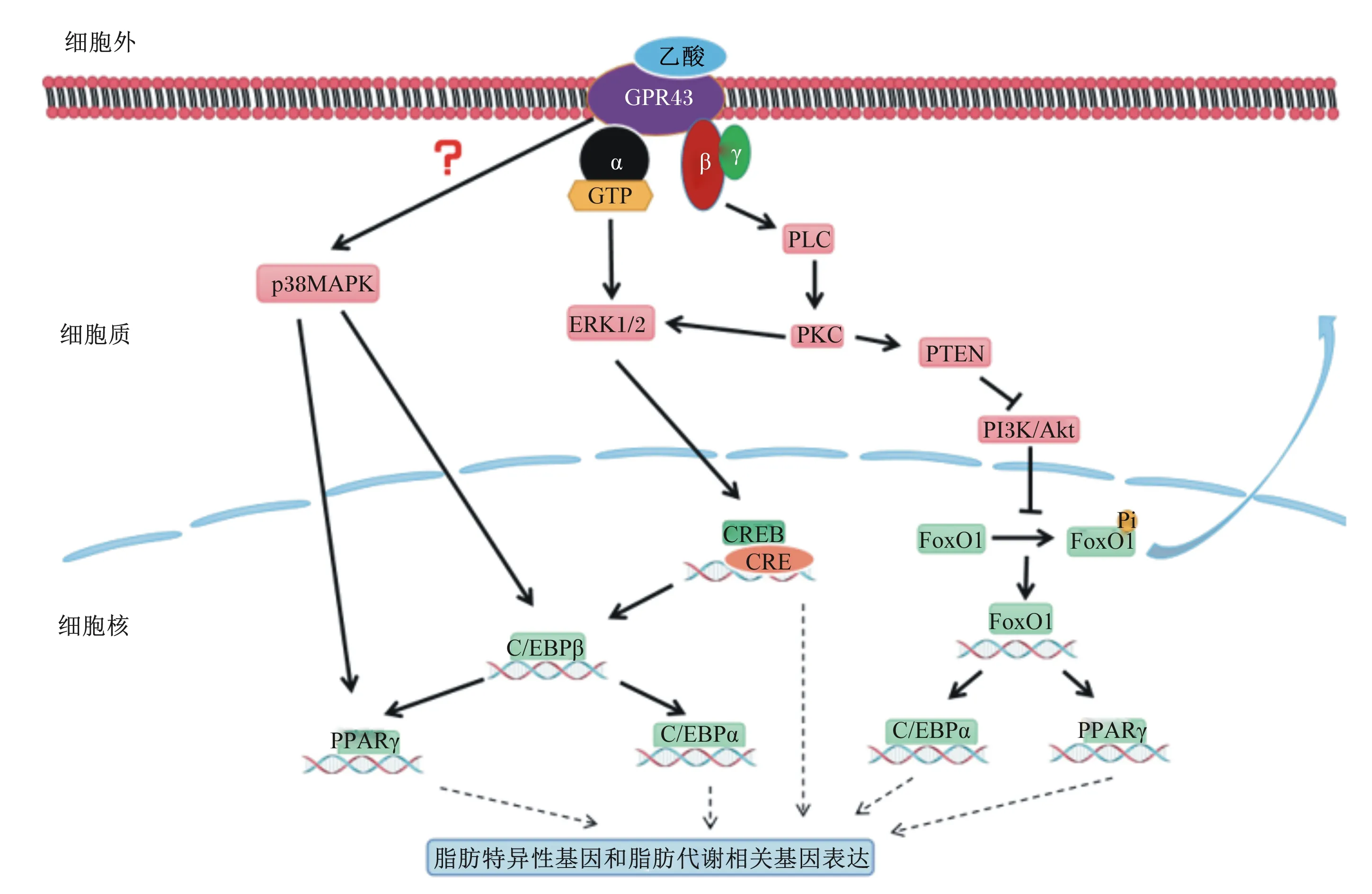
GPR43:G蛋白偶联受体43 G protein-coupled receptor 43;PLC:磷脂酶C phospholipase C;PKC:蛋白激酶C protein kinase C;ERK1/2:细胞外信号调节激酶1/2 extracellular regulated protein kinases 1/2;CREB:环磷腺苷效应元件结合蛋白 cAMP-response element binding protein;CRE:cAMP反应元件 cAMP response element;C/EBPβ:CCAAT/增强子结合蛋白β CCAAT/enhancer binding protein β;C/EBPα:CCAAT/增强子结合蛋白α CCAAT/enhancer binding protein α;PPARγ:过氧化物酶体增殖物激活受体γ peroxisome proliferators-activated receptors γ;p38MAPK:p38丝裂原活化蛋白激酶 p38 mitogen-activated protein kinase;PTEN:蛋白酪氨酸磷酸酶基因 gene of phosphate and tension homology deleted on chromsome ten;FoxO1:叉头转录因子1 forkhead box transcription factor 1;PI3K:磷脂酰肌醇3-激酶 phosphatidylinositol 3-kinase;Akt:丝氨酸-苏氨酸蛋白激酶 protein kinase B。
乙酸对脂肪细胞分化的调控还与p38丝裂原活化蛋白激酶(p38MAPK)通路相关,乙酸可以通过介导前脂肪细胞p38MAPK通路促进其分化[15]。乙酸介导p38MAPK通路也与GPR43的激活有关,已经有研究表明,乙酸可以通过激活GPR43来增加p38MAPK的磷酸化[21]。目前,有在人单核细胞中GPR43通过Gαq亚基诱导p38MAPK磷酸化的报道[21],但关于GPR43激活如何在前脂肪细胞或脂肪细胞中诱导p38磷酸化的机制未见报道,所以前脂肪细胞中GPR43激活促进p38MAPK磷酸化的分子机制尚不清楚。已经研究报道p38MAPK的磷酸化可以激活转录调控因子C/EBPβ和PPARγ[22],继而促进靶基因的表达和脂肪细胞的分化过程。
磷脂酰肌醇3-激酶(PI3K)/丝氨酸-苏氨酸蛋白激酶(Akt)信号通路也是脂肪细胞分化的重要调控通路[23]。PI3K/Akt信号通路调控的叉头转录因子1(FoxO1)是一种重要转录调控因子,其可以参与前脂肪细胞成脂分化过程的调控[24]。研究表明,FoxO1在前脂肪细胞克隆扩增后的终末分化早期起着重要调控作用,克隆扩增完成时FoxO1的积累可以增强PPARγ和C/EBPα的表达,进而促进终末分化过程[25]。PI3K/Akt信号通路的激活可以导致FoxO1的磷酸化[26]。在细胞核内,磷酸化的FoxO1会被转运至核外细胞质,其转录活性由于核内FoxO1数量的减少而降低,从而使FoxO1靶基因的表达被抑制[27]。乙酸激活GPR43后,其G(i/o)βγ亚基通过G(i/o)βγ-PLC-PKC途径激活蛋白酪氨酸磷酸酶基因(PTEN)[28];PTEN的激活可以抑制Akt的磷酸化,从而抑制FoxO1磷酸化,阻止其从细胞核向细胞质转运,上调其转录活性,进而促进脂肪细胞的分化。
4 乙酸对脂肪沉积的影响及其作用机制
脂肪沉积与机体的代谢稳态和能量平衡相关联。随着对乙酸影响脂肪代谢的深入研究,大量研究都表明乙酸通过多种途径降低了机体脂肪沉积,对机体代谢稳态和能量平衡产生积极影响。
4.1 乙酸通过影响能量摄入减少脂肪沉积
乙酸是食醋中主要的功能成分。在生活中,经常能听到饮醋可以减肥的说法。饮醋之所以能减肥是因为乙酸的摄入,乙酸可以抑制食欲,通过减少能量摄入达到减肥的目的。其作用机制之一是通过介导肠脑轴来调节食欲[29]。乙酸可以激活肠道组织中短链脂肪酸受体来刺激肠道激素肽YY(PYY)、胰高血糖素样肽-1(GLP-1)的分泌[30-31];PYY与GLP-1可以刺激肠道迷走神经将肠道信号传递至下丘脑。GLP-1与PYY不仅可以抑制下丘脑弓状核(ARC)中促进食欲的中性神经肽Y(NPY)神经元,还可以激活抑制食欲的阿黑皮素原(POMC)神经元,从而影响食欲和饱腹感,抑制胃排空[32]。除了介导肠脑轴以外,乙酸还可以通过激活脂肪组织中的GPR43来刺激瘦素的分泌[33]。瘦素可以穿过血脑屏障作用于下丘脑的代谢调节中枢,其不仅可以抑制脂肪合成,还可以通过增加POMC的表达,并降低NPY和刺鼠相关蛋白(AgRP)的表达来抑制食欲[2]。另外,乙酸自身也可以穿过血脑屏障,作为信号分子直接作用于下丘脑神经元,激活神经元内乙酰羧化酶A,从而介导神经肽表达来抑制食欲,减少能量摄入[34]。
4.2 乙酸通过增强线粒体代谢减少脂肪沉积
在真核生物体内,线粒体是提供能量的结构,其不仅是氧化代谢的场所,也是脂肪等营养物质最终氧化释放能量的部位。线粒体代谢的增强能增加耗能及产热,而甘油三酯是机体耗能及产热的主要原料,所以线粒体代谢的增强可以增加甘油三酯的利用,将脂肪转化为能量供给全身或者通过产热散发,从而减少脂肪沉积。研究表明,乙酸可以促进棕色脂肪细胞线粒体生成及其线粒体UCP1的表达[17],后者可以介导H+内流,使呼吸链短路,将能量通过产热的方式消耗。乙酸促进棕色脂肪细胞线粒体生成和UCP1表达也与乙酸通过激活GPR43介导CREB的激活有关。CREB的激活上调了PPARγ共激活因子-1α(PGC-1α)和UCP1的表达[35-36]。PGC-1α是线粒体生物发生的主要调节剂[37],其表达会增强核呼吸因子-1(NRF-1)和核呼吸因子-2(NRF-2)的转录,从而增强电子传输链复合体中细胞色素c氧化酶Ⅳ、β-ATP合酶和细胞色素c等核编码线粒体亚基的表达以及线粒体转录因子A(mtTFA)的表达[38-39];mtTFA可以易位至线粒体并刺激线粒体DNA复制和基因表达,从而促进线粒体生成[40]。
乙酸还可以刺激白色脂肪组织褐变,使白色脂肪细胞线粒体数量及能耗增加。乙酸诱导白色脂肪组织褐变是通过上调PR结构域蛋白16(PR domain-containing 16,PRDM16)的表达实现的。Sahuri-Arisoylu等[41]报道醋酸盐的摄入能使小鼠皮下脂肪组织褐变,并且使PRDM16的表达显著增加,PGC-1α的表达也呈相似趋势。PRDM16在白色脂肪组织和棕色脂肪组织相互转化的过程中起着“开关”的作用[42],其作用机制为:PRDM16可以直接通过与蛋白质结合来激活PGC-1(PGC-1α、PGC-1β);白色脂肪组织内PGC-1的表达增加促进了线粒体的生成,并且调控棕色脂肪细胞特性基因的表达[43]。
4.3 乙酸通过影响脂肪氧化分解和合成减少脂肪沉积
脂肪沉积与脂肪的氧化分解和合成紧密相关。研究表明,乙酸可以促进体内脂肪酸的氧化、抑制肝脏内脂肪的从头合成,从而减少脂肪沉积。乙酸影响脂肪氧化分解和从头合成的主要作用机制有以下几种:1)乙酸可以诱导腺苷单磷酸活化蛋白激酶(AMPK)的激活来调控脂肪的氧化和从头合成[44]。乙酸被机体吸收后可以转化为乙酰辅酶A,该过程需要乙酰辅酶A合成酶1(ACS1)的催化,并且会消耗大量的ATP,产生大量的一磷酸腺苷(AMP),AMP/ATP的比值增加诱导了AMPK的激活[45]。AMPK对机体的代谢有重要调控作用,尤其是在脂肪代谢的调控中,AMPK的激活可以增强脂肪的氧化分解,调控肝脏内脂肪的从头合成[46]。乙酸可以通过激活AMPK上调PPARα的表达[47]、下调固醇调节元素结合蛋白-1c(SREBP-1c)的表达[48],而PPARα和SREBP-1c均是影响脂肪代谢的关键转录因子。Araújo等[49]报道,乙酸通过激活AMPK/PGC-1α/PPARα通路促进肠道上皮细胞对饮食脂类氧化分解来促进饮食脂类的消耗,进而减少饮食脂类与载脂蛋白结合释放入淋巴液和血液。Li等[44]报道,乙酸可以激活BRL-3A细胞AMPK增加PPARα的表达,减少SREBP-1c的表达,并上调脂肪氧化基因的表达,降低生脂基因的表达。PPARα表达的上调可以促进肉碱棕榈酰易位酶(carnitine acetyltranslocase,CPT)-1、CPT-2[50]、脂肪酸β氧化限速酶酰基辅酶A氧化酶(ACO)[51]、长链酰基辅酶A合成酶-1(ACSL-1)的表达[52],从而促进脂肪酸运输、活化和β-氧化,增强脂肪的氧化分解。SREBP-1c则与脂肪合成密切相关[53],可以调控脂肪从头合成相关酶的表达,如硬脂酰辅酶A去饱和酶-1(SCD-1)[53]、乙酰辅酶A羧化酶α(ACCα)[54]、FAS的表达均受其调控[55]。SREBP-1c表达的下调可以抑制ACCα、FAS和SCD-1的表达,从而抑制肝脏内脂肪的从头生成,减少肝脏和机体的脂肪沉积。2)乙酸通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,减少脂肪从头合成来降低机体脂肪沉积。mTOR也是脂肪合成代谢的重要调节器,mTOR的激活可以正向调控脂肪合成相关酶的活性。Chakrabarti等[56-57]报道,3T3-L1细胞中mTOR的激活可以增加促进脂肪合成的转录因子SREBP-1的表达,促进甘油三酸酯在细胞内蓄积,而抑制mTOR通路可以抑制脂肪从头合成。伏春燕[58]报道,乙酸盐处理显著抑制了家兔脂肪细胞mTOR蛋白的磷酸化,减少了脂滴沉积量。常莹[59]报道,在家兔动物模型上也观察到乙酸对mTOR通路的抑制,并减少了机体的脂肪沉积。乙酸通过抑制mTOR通路减少SREBP-1的表达,抑制脂肪从头合成,从而减少机体脂肪沉积。3)乙酸可以通过特异性抑制脂肪组织中胰岛素信号的传导,从而减少胰岛素促进的脂肪合成和贮存[28]。乙酸对脂肪组织胰岛素信号的特异性抑制可能与GPR43在脂肪组织中大量表达、在肌肉和肝脏等组织表达较少有关。前文概述过乙酸可以通过激活GPR43抑制PI3K/Akt信号通路,而PI3K/Akt信号通路可以介导胰岛素信号的传导,是其重要传导途径[60],所以脂肪组织中的胰岛素信号传导由于乙酸对GPR43的激活而被抑制。而胰岛素在脂肪合成代谢中起着重要调节作用,其可以通过激活上游刺激因子(upstream stimulatoty factor,UCF)、SREBP-1c、肝X受体α(liver X receptor α,LXRα)等转录因子调控脂肪合成相关酶的转录,进而促进脂肪的合成[61]。由此可知,乙酸能通过抑制脂肪组织胰岛素信号传导抑制脂肪合成相关转录因子的激活,进而抑制脂肪合成,减少脂肪沉积。
综上所述,乙酸抑制机体的脂肪沉积的途径有以下几个:1)通过抑制食欲减少机体能量摄入;2)通过增强机体代谢加强能量利用;3)通过促进脂肪氧化抑制脂肪合成。其具体作用机制如图2所示。
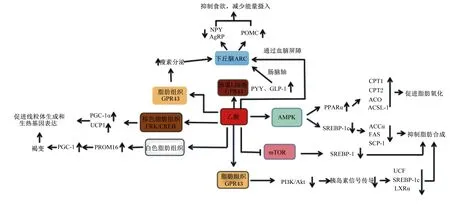
NPY:中性神经肽Y neuropeptide Y;AgRP:刺鼠相关蛋白 agouti-related protein;POMC:阿黑皮素原 proopiomelanocortin;PYY:肽YY peptide YY;GLP-1:胰高血糖素样肽1 glucagon-like peptide 1;PGC-1:PPARγ共激活因子-1 peroxisome proliferator-activated receptor γ coactivator-1;UCP1:解偶联蛋白1 uncoupling protein-1;AMPK:腺苷单磷酸活化蛋白激酶 AMP-activated protein kinase;SREBP-1:固醇调节元素结合蛋白-1 sterol regulatory element binding protein-1;CPT:肉碱棕榈酰易位酶 carnitine acetyltranslocase;ACO:酰基辅酶A氧化酶 acyl coenzyme A oxidase;ACSL-1:长链酰基辅酶A合成酶-1 long-chain acyl-CoA synthetases;ACCα:乙酰辅酶A羧化酶α acetyl-CoA carboxylase α;FAS:脂肪酸合成酶 fatty acid synthetase;SCD-1:硬脂酰辅酶A去饱和酶-1 stearyl coenzyme A dehydrogenase-1;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;UCF:上游刺激因子 upstream stimulatory factor;LXRα:肝X受体α liver X receptor α;PI3K:磷脂酰肌醇3-激酶 phosphatidylinositol 3-kinase;Akt:丝氨酸-苏氨酸蛋白激酶 protein kinase B。
5 乙酸改善胰岛素抵抗及其作用机制
胰岛素是机体内调节血浆中葡萄糖浓度的重要内分泌激素,当其对机体血糖浓度的调节作用降低时,为了维持血糖浓度平衡,机体会分泌过量胰岛素。机体胰岛素的敏感性由于血浆中胰岛素浓度的升高而降低,从而产生胰岛素抵抗。导致机体产生胰岛素抵抗的原因有许多,其中肥胖是主要原因之一。因为过多的脂肪储存会导致脂肪酸向其他组织的流量增加,导致血液中游离脂肪酸(free fatty acid,FFA)浓度升高。FFA的过量供应会导致细胞内二酰基甘油和神经酰胺等有毒FFA衍生代谢产物的积累,这些衍生代谢物可以激活作用于胰岛素受体底物1(insulin receptor substrate 1,IRS1)的一些激酶,如c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、IκB激酶β(inhibitor kappa B kinase β,IKKβ)、蛋白激酶Cθ(PKCθ),从而导致IRS1上丝氨酸磷酸位点被磷酸化;该位点的磷酸化会导致IRS1构象的改变,使胰岛素与IRS1的结合被抑制,继而导致胰岛素信号通路传导的阻断[62]。
乙酸可以降低血液中FFA浓度,有效地改善胰岛素抵抗。乙酸降低血液中FFA浓度的途径主要有2个:1)乙酸通过抑制脂肪细胞脂解作用减少甘油三酯的水解,从而降低血浆中FFA浓度。体外细胞试验和动物试验均有报道,乙酸能抑制脂肪细胞的脂解。Fernandes等[63]报道,体循环中乙酸浓度的升高可以减少脂解作用,降低血液中FFA浓度。Ge等[64]报道,用醋酸盐处理过的体外分化3T3-L1细胞和从小鼠分离的初级脂肪细胞在脂解活性上降低,并且在小鼠体内模型中,用500 mg/kg剂量乙酸盐腹腔注射到小鼠体内,观察到随着血浆中乙酸盐浓度的升高,小鼠血浆FFA浓度降低;乙酸盐浓度逐渐回归基准线,小鼠血浆FFA浓度也逐渐回升。乙酸抑制脂解的机制之一是介导GPR43的激活。激活的GPR43通过Gαi亚基使细胞内cAMP水平降低,减少蛋白激酶A(protein kinase A,PKA)的活化,进而降低激素敏感性脂肪酶(HSL)的活性[65]和阻止其从胞质溶胶转移至脂质液滴的表面[66],从而抑制脂肪的脂解。乙酸抑制脂解的另一个可能作用机制是对AMPK的激活。研究表明,AMPK的激活可以阻止活化的HSL向脂质滴转移,从而抑制脂肪细胞的基础脂解作用以及在异丙肾上腺素作用下诱导的脂解作用[66-67]。2)乙酸通过抑制脂蛋白内甘油三酯的水解来减少FFA的释放。乳糜微粒(CM)和极低密度脂蛋白(VLDL)内运输的甘油三酯,可以在脂蛋白脂肪酶(LPL)和肝脂酶(HL)的作用下生成FFA释放入血液供机体组织利用和贮存[68-69]。研究表明,乙酸可以通过降低机体内LPL和HL的活性来降低血浆中FFA浓度。张治国等[70]报道,摄食0.2%浓度的乙酸可以降低大鼠肝脏总脂酶(HL和LPL)和脂肪组织LPL活性,从而降低血浆中FFA浓度,有效改善胰岛素抵抗。
乙酸除了通过降低血浆中FFA浓度的途径来改善胰岛素抵抗之外,还可以直接改善骨骼肌、肝脏等其他组织胰岛素敏感性,进而增加机体对葡萄糖的吸收利用,改善胰岛素抵抗。Kimura等[28]观察到乙酸通过激活脂肪组织GPR43不仅抑制了脂肪组织内胰岛素信号的传导,还改善了小鼠其他组织(如肝脏和肌肉)的胰岛素敏感性,另外,小鼠肌肉中的能量消耗和糖酵解相关基因表达也显著增加。Mitrou等[71]报道,饮食中补充乙酸可以改善葡萄糖耐量降低患者骨骼肌胰岛素敏感性,增强骨骼肌对葡萄糖的吸收和利用;与正常饮食的患者相比,饮食中补充乙酸显著降低餐后血液中的胰岛素浓度。虽然多个报道均指出,乙酸可以改善机体胰岛素敏感性,但是否具有直接作用机制尚不清楚,这可能与上文论述的乙酸通过多种途径抑制脂肪沉积有关。因为周围组织中过多脂质的蓄积会干扰胰岛素的信号传导,乙酸对骨骼肌和肝脏中脂质沉积的抑制作用可能导致葡萄糖耐量增加和胰岛素抵抗改善。
综上所述,乙酸改善机体胰岛素抵抗的可能机制有:1)通过抑制脂肪细胞脂解作用使血浆中FFA的浓度降低,改善机体胰岛素抵抗;2)通过降低HL和LPL的活性减少脂蛋白中甘油三酯的水解,减少FFA的释放,降低血浆中FFA浓度,改善机体胰岛素抵抗;3)通过改善机体肝脏和骨骼肌等组织的胰岛素敏感性,增强机体对葡萄糖的利用,改善机体胰岛素抵抗。其可能的作用机制如图3所示。
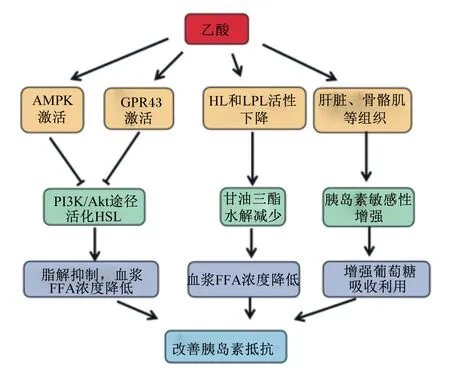
AMPK:腺苷单磷酸活化蛋白激酶 AMP-activated protein kinase;GPR43:G蛋白偶联受体43 G protein-coupled receptor 43;HL:肝脂酶 hepatic lipase;LPL:脂蛋白脂肪酶lipoprotein lipase;PI3K:磷脂酰肌醇3-激酶 phosphatidylinositol 3-kinase;Akt:丝氨酸-苏氨酸蛋白激酶 protein kinase B;HSL:激素敏感性脂肪酶 hormone sensitive lipase;FFA:游离脂肪酸 free fatty acid。
6 乙酸在畜禽生产上的应用前景
在现代集约化养殖中,畜禽过肥不仅会导致其繁殖性能降低,而且会增加畜禽脂肪肝及肥胖相关疾病的发病率,在减少生产效益的同时,还导致饲料资源的浪费。乙酸所具有的调节机体脂肪代谢、抑制脂肪沉积、预防肥胖相关疾病作用可以有效缓解这些不利影响,这些已经在一些动物试验上得到证实。Sahuri-Arisoylu等[41]报道,向小鼠腹膜内注射用慢性脂质体封装的乙酸盐后,其通过减少循环中的FFA减少肝脏中脂肪的从头生成以及增加线粒体效率来减少脂肪沉积,而在脂肪组织中,它会诱导“褐变”,从而导致体内脂肪收缩。Fushimi等[72]报道,大鼠饮食中添加乙酸可以降低喂食富含胆固醇饮食的大鼠血清中胆固醇和甘油三酯的浓度,并具有降低肝脏中胆固醇和甘油三酯浓度的趋势。另外,乙酸本身属于酸化剂范畴,还被列为与所有动物饲料一起使用的防腐剂[73],具有防霉抑菌功能,可以调节胃肠道微生物菌群的结构。Ndelekwute等[74]报道,肉鸡饲粮中添加0.25%的乙酸可以降低十二指肠的pH和消化物黏度,从而抑制治病性微生物群的繁殖和改善营养物质的消化率。Pasha等[75]报道,在基础饲粮中添加0.3%的乙酸可以显著降低嗉囊和腺胃的pH,抑制致病菌的生长,并增加肉鸡十二指肠绒毛高度、隐窝深度、绒毛表面积。综上可知,乙酸所具有的多种功能在畜禽生产中都具有广阔的应用潜力,特别是在全面禁抗的大背景下,进一步深入研究乙酸,并将其开发应用于畜禽生产中具有深远的现实意义。
7 小结与展望
综上可知,乙酸通过调控基因转录因子与信号通路在促进脂肪细胞分化、抑制脂肪沉积和改善肥胖引发的胰岛素抵抗等方面具有重要调节作用。研究乙酸发挥上述生理功能的分子机制,不仅对改善机体健康以及提升畜禽生产效益有重要意义,还可以促进乙酸在医学及畜牧行业的合理应用。目前对乙酸对脂肪代谢的影响及分子机制已经进行了大量研究,虽然取得了一些重大进展,但还有许多需要深入研究的方面:1)乙酸影响脂肪代谢的机制非常复杂,并且还存在组织差异性。在今后的研究中,需要研究乙酸调节脂肪代谢的更复杂机制及乙酸在不同组织中影响动物脂肪代谢差异性的原因;2)乙酸一方面可以促进脂肪分化,抑制脂解,另一方面可以减少脂肪沉积,这种看似矛盾的影响是如何统一的是值得探究的方向;3)目前,乙酸对脂肪代谢的研究主要集中于体外细胞模型和小鼠模型上,有关其对畜禽脂肪代谢影响的报道较少。另外,畜禽体内过多的脂肪沉积不仅造成饲料资源的浪费,而且导致动物产品品质下降。所以,加强乙酸对畜禽脂肪代谢的影响和合理利用,对构建动物健康养殖模式和促进我国畜牧业可持续发展具有重要意义。
