复合菌发酵稻草对安格斯牛生长性能、瘤胃发酵参数及菌群结构的影响
2021-06-05谢建林张巧娥张转弟梁小军王瑞刚
谢建林 张巧娥* 张转弟 梁小军 王瑞刚 姜 武
(1.宁夏大学农学院,银川 750021;2.宁夏农林科学院动物科学研究所,银川 750002;3.宁夏犇旺生态农业有限公司,银川 750104)
反刍动物瘤胃具有发酵能力,其内部定植着复杂且多样的原虫、细菌、古细菌以及真菌等多种微生物,各种微生物相互作用维持着瘤胃内环境的稳定和动物健康[1]。稻草作为常见的粗饲料,主要由复合木质纤维素聚合物、果胶、二氧化硅和蜡组成[2],因为具有较厚的外皮蜡质层和较高的木质素含量,在瘤胃中的养分消化率较低[3],极大地影响了稻草在畜牧业上的推广使用。微生物发酵作为一种新型的饲料处理方式,具有降解抗营养因子(ANFs)、打破发酵前饲料基质中紧致的木质纤维结构、促进瘤胃发育和微生物定植等优点[4-6]。相比单一菌种,采用复合菌发酵往往能取得更好的效果。Li等[7]通过试验证明,相比单一菌种,采用复合菌发酵能提高发酵稻草中的氨态氮(NH3-N)、粗蛋白质(CP)和乙酸含量,使得发酵稻草营养水平更高,发酵品质更好。陈帅[8]用膨化秸秆生物发酵饲料饲喂辽育白牛,不仅显著提高了血液中葡萄糖、免疫球蛋白G(IgG)和免疫球蛋白A(IgA)含量,而且显著降低了血液中总胆固醇含量,并且有提高血液中白蛋白和总蛋白含量的趋势。高通量测序技术因其可大规模平行测序、完美定量以及低廉成本的优点,已广泛使用在对反刍动物瘤胃微生物研究上[9-11]。本试验旨在测定复合菌发酵稻草后主要营养成分的改变、霉菌毒素含量以及利用扫描电镜探究复合菌发酵对稻草纤维结构的影响,并通过在饲粮中添加复合菌发酵稻草,研究其对安格斯牛生长性能和瘤胃发酵参数的影响,同时运用高通量测序技术测定其对瘤胃菌群结果的影响,从而为开发利用复合菌发酵稻草提供科学依据。
1 材料与方法
1.1 复合菌发酵稻草的制备
复合菌是由枯草芽孢杆菌(Bacillussubtilis)CICC10071、嗜酸乳杆菌(Lactobacillusacidophilus)CICC20248和酿酒酵母(Saccharomycescerevisiae)CICC1355按照活菌数目1∶4∶5比例组成的液体复合微生物发酵菌剂(有效活菌数1.0×1010CFU/g)。将稻草、玉米面(为微生物提供快速繁殖所需要的碳水化合物)、复合菌和水按照质量22.5∶12.5∶1.0∶64.0比例加入全混合日粮(TMR)机中搅拌30 min混匀,用拉伸膜裹包机(ZQY-55)压实捆扎成高度70 cm、直径45 cm、包膜4层的包裹,再用同样的方式制作3个不加复合菌(复合菌部分用水替代)的发酵对照包裹。在室温下将所有包裹放置到干燥的平地上,盖上塑料膜和草席,保证干燥避光发酵30 d。
1.2 复合菌发酵稻草主要营养成分测定、纤维结构变化与霉菌毒素评定
在发酵第30天打开包裹,按照九点法[12]从每个包裹取样后混合,一部分用于测定发酵稻草的主要营养成分、霉菌总数、细菌总数以及呕吐毒素、玉米赤酶烯酮和黄曲霉毒素B1含量;另一部分样品放入温度为65 ℃的烘箱内,烘干24 h,再回潮12 h,制成约3 mm×3 mm×3 mm大小的样品,样品送往宁夏大学省部共建煤炭高效利用与绿色化工国家重点实验室,用扫描电镜(SEM)(SU-3500,日本日立公司)观察干燥后的样品。霉菌总数按照GB/T 13092—2006检测,细菌总数按照GB/T 13093—2006检测,呕吐霉素含量按照DB45—T607-2009检测,玉米赤酶烯酮含量按照GB/T 13085—2005检测,黄曲霉毒素B1含量按照GB/T 17480—2008检测。
1.3 试验动物与试验设计
选用14月龄左右、体重[(390.47±50.14) kg]相近、体况良好的20头安格斯牛作为试验动物,随机分为2组,每组10个重复,每个重复1头牛。稻草组(rice straw group,RS组,对照组)饲喂稻草+玉米青贮+精料TMR,发酵稻草组(fermented rice straw group,FRS组,试验组)饲喂复合菌发酵稻草+玉米青贮+精料TMR,2组营养水平基本一致。根据NRC(2016)安格斯牛饲养标准配制饲粮,TMR组成及营养水平见表1,采用小型饲料混合机将原料搅拌后饲喂,全天自由饮水。试验期100 d (预试期7 d,正试期93 d)。
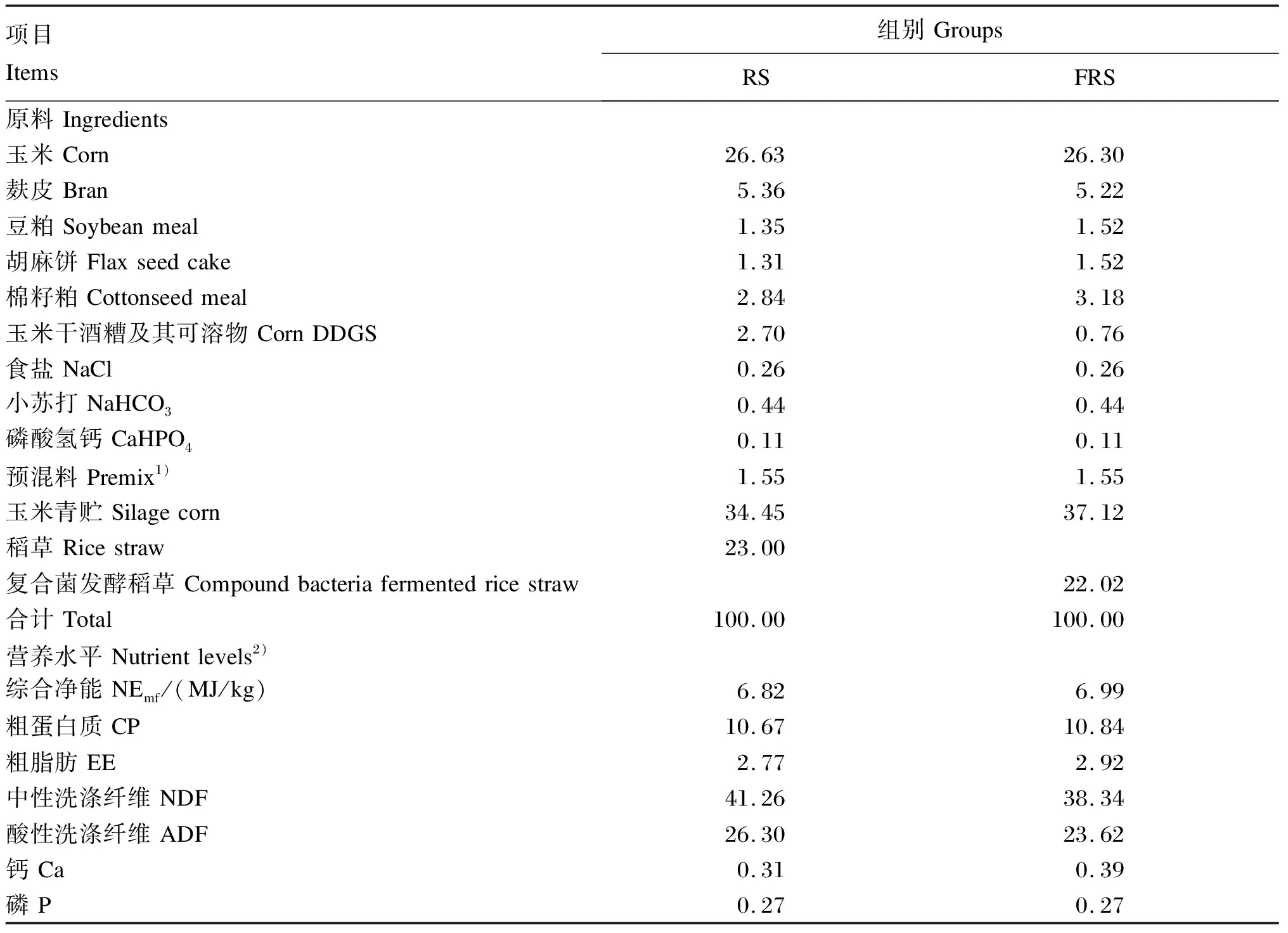
表1 TMR组成及营养水平(干物质基础)
1.4 生长性能测定
每天07:00和16:00进行饲喂,早上饲喂前收集称量记录前1天的剩料,用于计算试验期每组的平均日采食量。试验牛于试验正式开始当天空腹测定初始体重,在93 d后空腹测定终末体重,计算每组的平均日增重和料重比。
1.5 样品采集与处理
每组随机选取6头试验牛,在试验结束当天晨饲后6 h从口腔采集瘤胃液。首先用牛鼻夹把牛头固定,接着用胃管式瘤胃液采样器通过食道采集瘤胃液,弃去最初的20 mL瘤胃液(避免唾液影响),4层纱布过滤后立即使用便携式pH酸度计(SW-780S)测定瘤胃液pH,然后分装到5 mL无菌冻存管中,放入液氮罐,迅速带回实验室,置于-80 ℃冰箱保存,用于微生物DNA提取和瘤胃发酵参数的测定。
1.6 瘤胃发酵参数测定
NH3-N含量按照冯宗慈等[13]方法测定;微生物蛋白(MCP)含量采用差速离心法(考马斯亮蓝法),具体方法参照徐晓锋等[14];挥发性脂肪酸(VFA)含量利用气相色谱仪[7890A,安捷伦科技(中国)有限公司]测定。
1.7 瘤胃微生物多样性测定
1.8 数据处理与分析
数据通过Excel 2019整理后,再使用SPSS 19.0进行t检验分析,结果以平均值±标准差表示,P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著,0.05≤P<0.10表示有趋势。
2 结果与分析
2.1 复合菌发酵对稻草主要营养成分和霉菌毒素含量以及纤维结构的影响
从表2可以看出,经过30 d密封避光发酵,与稻草以及发酵对照相比,复合菌发酵稻草的NDF和ADF含量降低,CP含量提高。发酵粗饲料中黄曲霉毒素含量应当低于20 μg/L,呕吐毒素含量应当低于6 μg/L,玉米赤酶烯酮含量应当低于300 μg/L,霉菌总数应当低于4.0×103CFU/g[12]。本试验复合菌发酵稻草中未检测出呕吐霉素和黄曲霉毒素B1,玉米赤酶烯酮含量和霉菌总数未超标,因此本试验复合菌发酵稻草并未发生霉变,且霉菌毒素含量低于发酵对照。

表2 稻草、发酵对照及复合菌发酵稻草的主要营养成分和霉菌毒素含量(干物质基础)
从图1可以看出,在1 500倍扫描电镜下,稻草的表面规整紧致,复合菌发酵稻草的表面出现了空鼓和开裂。由此可见,复合菌发酵稻草的纤维结构发生了一定程度的变化。

图1 稻草(A)和复合菌发酵稻草(B)的表面结构
2.2 复合菌发酵稻草对安格斯牛生长性能的影响
从表3可以看出,与RS组相比,FRS组的平均日增重显著提高(P<0.05),平均日采食量显著提高(P<0.05),料重比显著降低(P<0.05)。
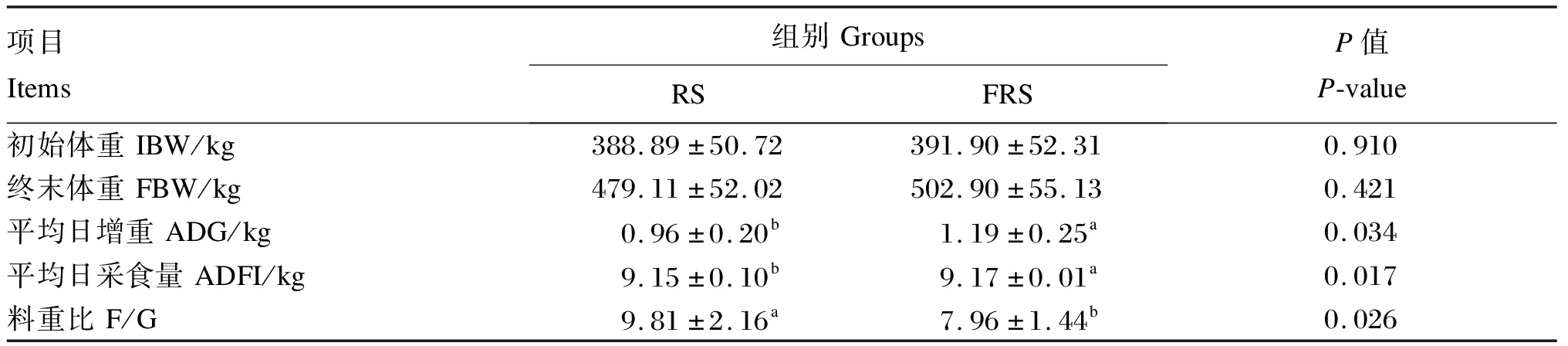
表3 复合菌发酵稻草对安格斯牛生长性能的影响
2.3 复合菌发酵稻草对安格斯牛瘤胃发酵参数的影响
从表4可以看出,FRS组和RS组的瘤胃pH和NH3-N、总挥发性脂肪酸(TVFA)、乙酸含量及乙酸/丙酸差异不显著(P>0.05)。与RS组相比,FRS组的瘤胃乙酸含量有降低的趋势(P=0.090),丙酸含量有升高的趋势(P=0.089),MCP含量极显著升高(P<0.01)。
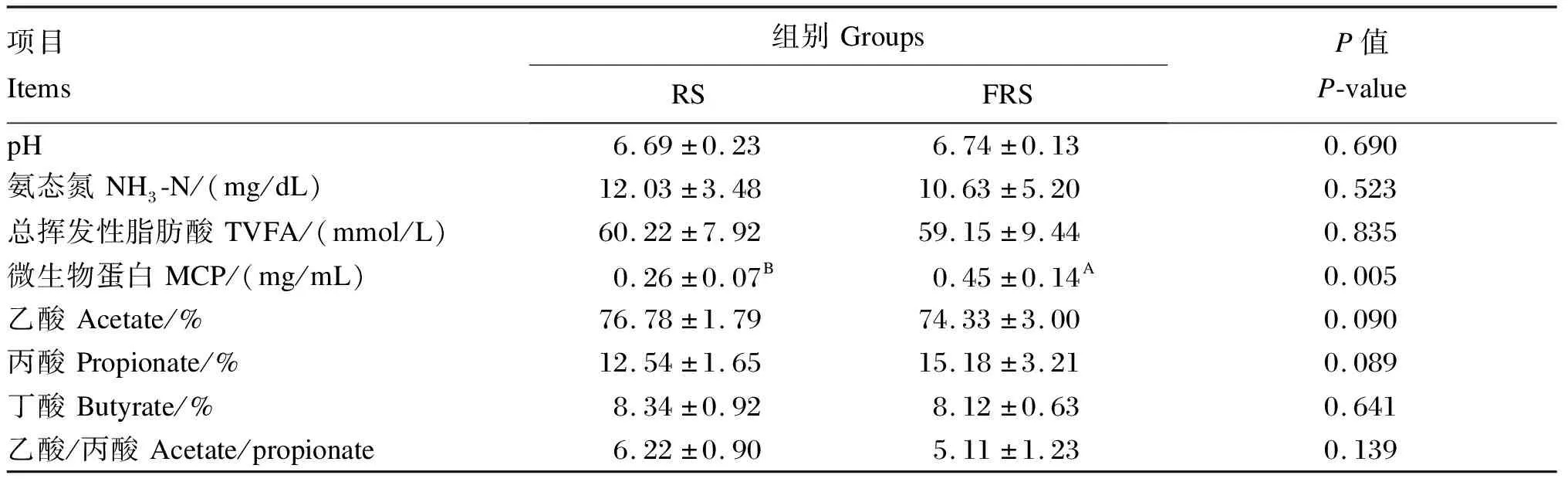
表4 复合菌发酵稻草对安格斯牛瘤胃发酵参数的影响
2.4 复合菌发酵稻草对安格斯牛瘤胃菌群组成的影响
2.4.1 Venn图
Illumina MiSeq测序后,基于97%物种相似性,将12个瘤胃液样品中获得的序列进行操作分类单元(operational taxonomic units,OTUs)聚类,对样品进行OTUs的统计,剔除稀有OTUs后,从图2可以看出,RS组获得1 631个OTUs,FRS组获得1 733个OTUs,2组共有1 505个OTUs,RS组特有126个OTUs,FRS组特有228个OTUs,说明2组瘤胃内容物菌群组成有所差异。

FRS:发酵稻草组 fermented rice straw group;RS:稻草组 rice straw group。下图同 the same as below。
2.4.2 OTUs稀释曲线
从图3可以看出,随着测序深度增加,2组OTUs数量和物种丰富度持续增加,在测序深度超过2 000以后,OTUs数量仍持续增长,而物种丰富度虽继续增加但已趋于平缓,表明测序深度已基本覆盖样品中的细菌物种。
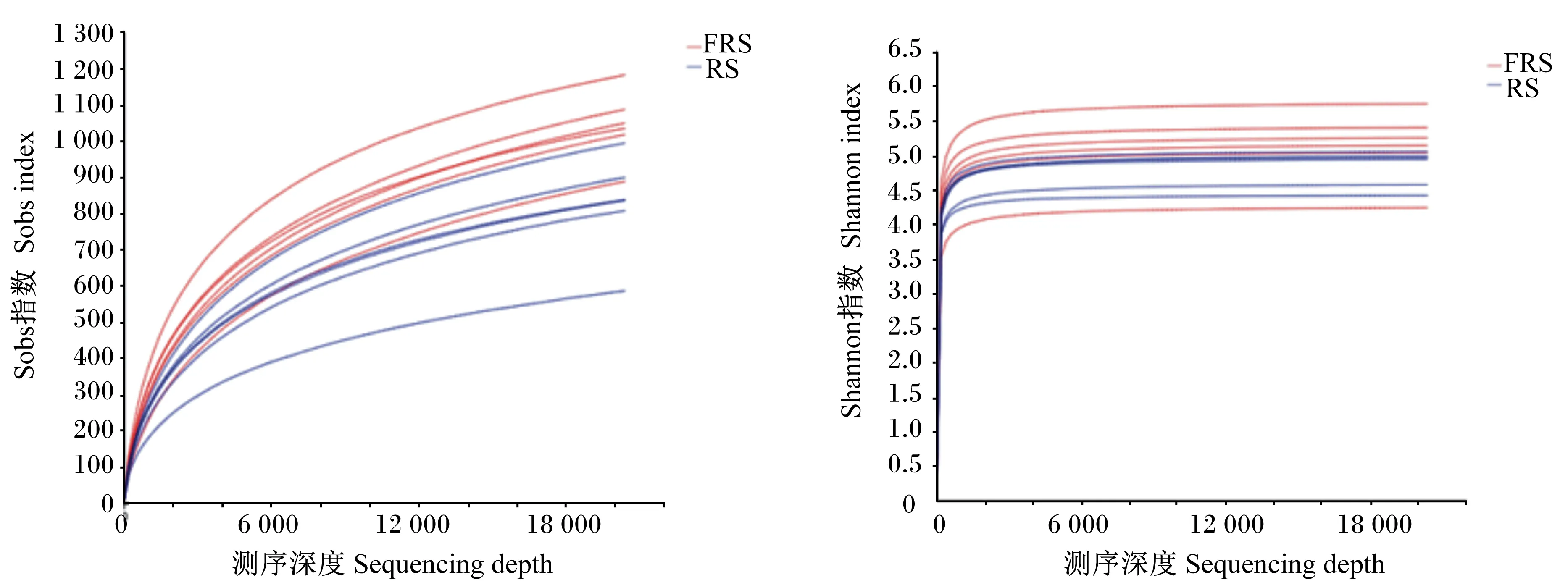
图3 OTUs稀释曲线
2.5 复合菌发酵稻草对安格斯牛瘤胃菌群多样性的影响
2.5.1 α多样性分析
从表5可以看出,FRS组的Sobs指数显著高于RS组(P<0.05),Ace指数、Chao指数极显著高于RS组(P<0.01)。FRS组的Shannon指数相比RS组有升高趋势(P=0.093),而Simpson指数2组差异不显著(P>0.05)。
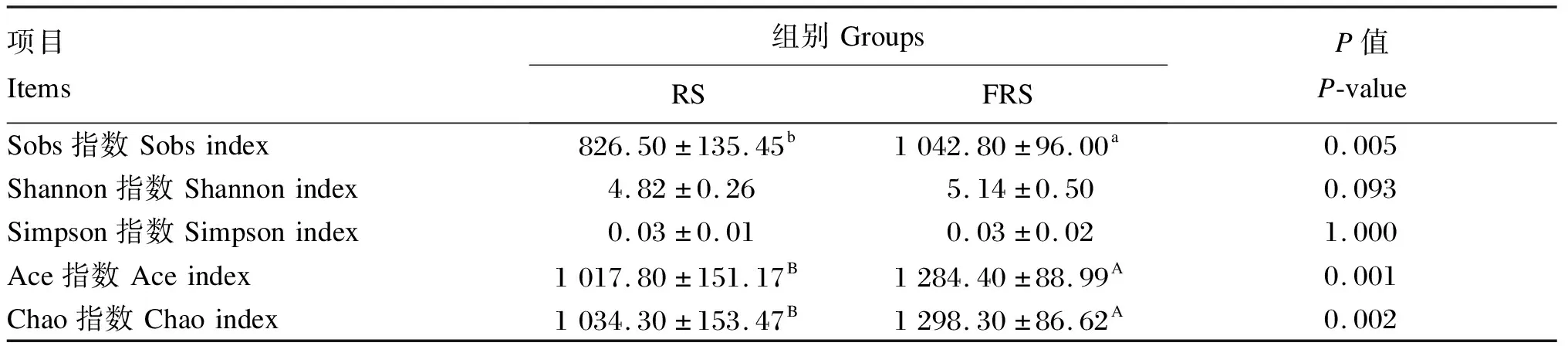
表5 α多样性指数
2.5.2 β多样性分析
β多样性分析通过对2组微生物群落间的物种多样性进行比较分析,探索2组样品间菌群组成的相似性或差异性。主坐标分析(PCoA)表示每个样品间的差异,物种组成差异越大则样品间距离越远。从图4可以看出,在主成分1贡献率23.54%,主成分2贡献率18.81%时,FRS组与RS组之间分布距离较远,说明2组菌群多样性差异较大。FRS组除了A6样品,其余样品位置紧密;RS组样品组内距离较接近,说明组内菌群多样性差异较小。
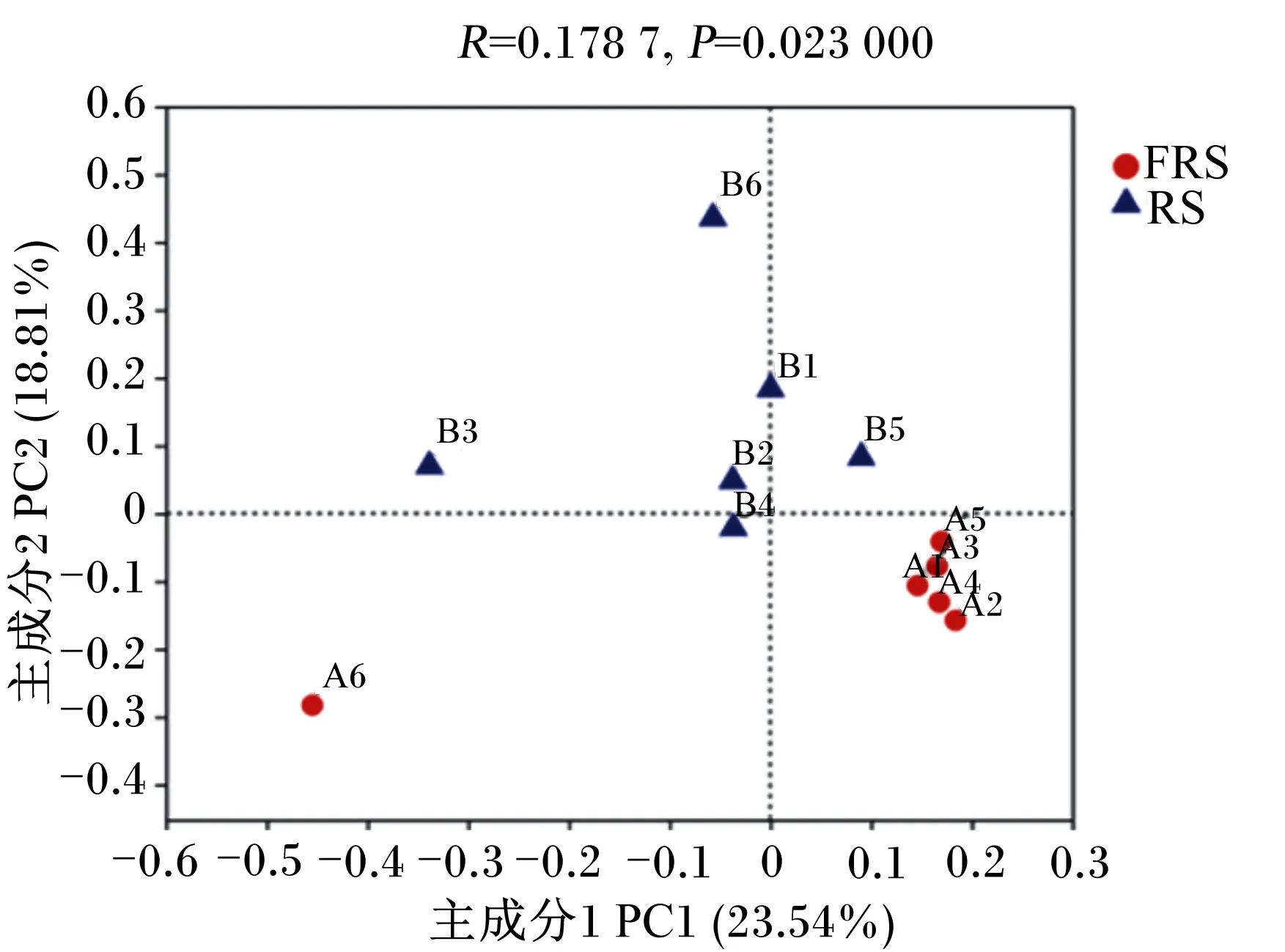
A1~A6代表FRS组的6个样品,B1~B6代表RS组的6个样品。
2.6 复合菌发酵稻草对安格斯牛瘤胃菌群结构的影响
本试验12个样品经过比对共得到21个门,30个纲,59个目,100个科,228个属。
从表6可以看出,在门水平上,2组均由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、螺旋体门(Spirochaetes)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)、髌骨细菌门(Patescibacteria)以及其他相对丰度<1%的菌门组成。2组中厚壁菌门均为优势菌门,RS组的厚壁菌门相对丰度显著高于FRS组(P<0.05);与之相反,在第二优势菌门拟杆菌门中,FRS组的拟杆菌门相对丰度显著高于RS组(P<0.05)。另外,RS组的放线菌门相对丰度显著高于FRS组(P<0.05),其他菌门相对丰度2组间差异不显著(P>0.05)。
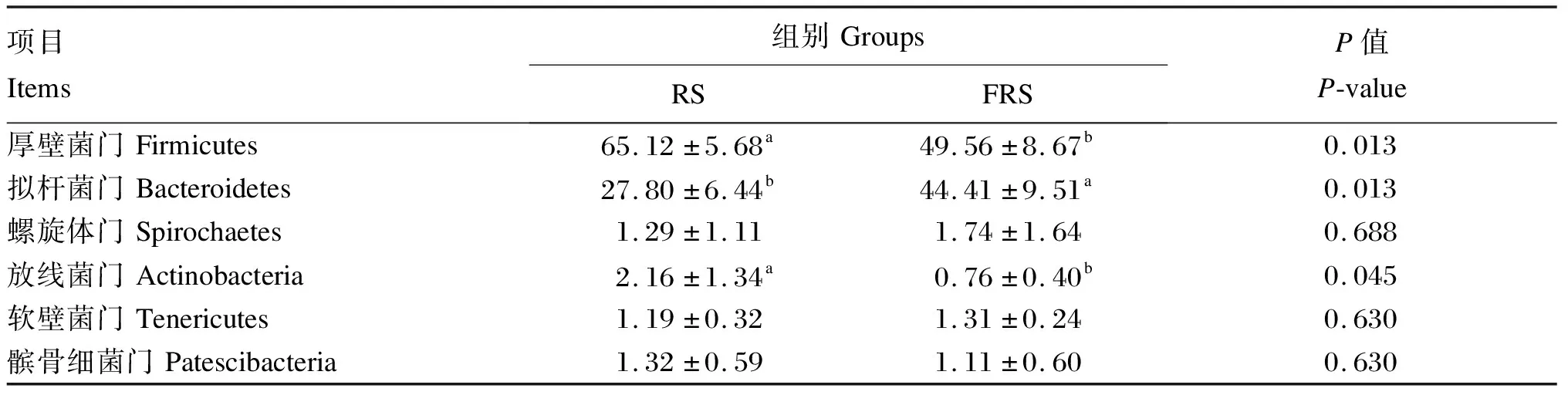
表6 复合菌发酵稻草对安格斯牛瘤胃门水平上(相对丰度>1%)菌群结构的影响
从表7可以看出,在属水平上,RS组的优势菌属为瘤胃球菌属_2(Ruminococcus_2)、其次为毛螺菌科_NK3A20群(Lachnospiraceae_NK3A20_group)、瘤胃球菌科_NK4A214群(Ruminococcaceae_NK4A214_group)、理研菌科_RC9肠道群(Rikenellaceae_RC9_gut_group)、普雷沃氏菌属_1(Prevotella_1);FRS组的优势菌属为瘤胃球菌属_2,其次为普雷沃氏菌属_1、理研菌科_RC9肠道群、毛螺菌科_NK3A20群、瘤胃球菌科_NK4A214群、普雷沃氏菌属_7(Prevotella_7),其相对丰度均在5%以上。其中,RS组的毛螺菌科_NK3A20群相对丰度极显著高于FRS组(P<0.01),RS组的未分级_o_梭菌目菌属(unclassified_o_Clostridiales)、醋香肠菌属(Acetitomaculum)相对丰度均显著高于FRS组(P<0.05),FRS组的普雷沃氏菌科_UCG-001群(Prevotellaceae_UCG-001_group)相对丰度显著高于RS组(P<0.05)。

表7 复合菌发酵稻草对安格斯牛瘤胃属水平上(相对丰度>1%)菌群结构的影响
从图5可以看出,厚壁菌门由瘤胃菌科(Ruminococcaceae)、毛螺菌科(Lachnospiraceae)、克里斯滕森菌科(Christensenellaceae)等11个菌科组成,拟杆菌门由进化接近的普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)等13个菌科组成,螺旋体门由螺旋体菌科(Spirochaetaceae)组成,放线菌门由双歧杆菌科(Bifidobacteriaceae)等5个菌科组成。
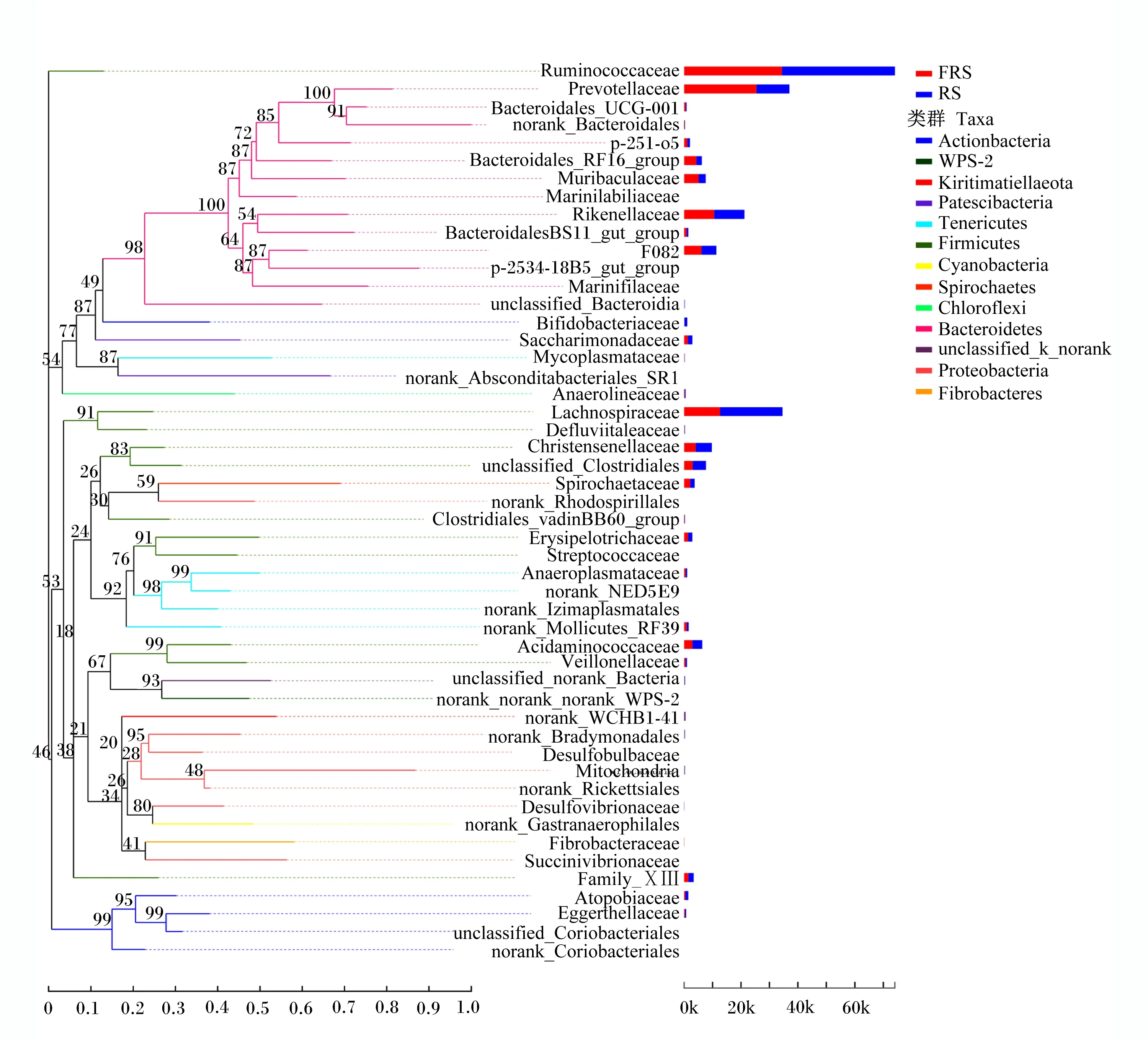
Ruminococcaceae:瘤球菌科;Prevotellaceae:普雷沃氏菌科;Bacteroidales_UCG-001:拟杆菌目_UCG-001;norank_Bacteroidales:未分类_拟杆菌目;Bacteroidales_RF16_group:拟杆菌目_RF16群;Rikenellaceae:理研菌科;Bacteroidales_BS11_gut_group:拟杆菌目_Bacteroidales_BS11肠道群;unclassified_Bacteroidia:未分级_拟杆菌纲;Bifidobacteriaceae:双歧杆菌科;Sphingomonadaceae:鞘脂单胞菌科;Mycoplasmataceae:支原体科;Anaerolineaceae:厌氧绳菌科;Lachnospiraceae:毛螺菌科;Christensenellaceae:克里斯滕森菌科;unclassified_Clostridiales:未分级_梭菌目;Spirochaetaceae:螺旋体科;norank_Rhodospirillales:未分级_红螺菌目;Clostridiales_vadinBB60_group:梭菌目_vadinBB60群;Erysipelotrichaceae:丹尼丝菌科;Streptococcaceae:链球菌科;norank_Mollicutes_RF39:未分类_柔膜菌纲_RF39;Acidaminococcaceae:氨基酸球菌科;Veillonellaceae:韦荣氏菌科;Mitochondria:线粒体;norank_Rickettsiales:未分类_立克次氏体目;Desulfovibrionaceae:脱硫弧菌科;Fibrobacteraceae:纤维杆菌科;Succinivibrionaceae:琥珀酸弧菌科;Atopobiaceae:阿托波菌科;unclassified_Coriobacteriales:未分级_红蝽菌目;norank_Coriobacteriales:未分类_红蝽菌目;Actinobacteria:放线菌门;Tenericutes:软壁菌门;Firmicutes:厚壁菌门;Cyanobacteria:蓝细菌门;Spirochaetes:螺旋体门;Chloroflexi:绿湾菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Fibrobacteres:纤维菌门。
3 讨 论
3.1 复合菌发酵对稻草主要营养成分和霉菌毒素含量以及纤维结构的影响
稻草主要由纤维素(32%~47%)、半纤维素(19%~27%)和木质素(5%~24%)组成[15]。研究表明,枯草芽孢杆菌能分泌纤维素酶,有降解纤维素的功能,但并不具备降解半纤维素和木质素的功能[16]。酵母菌因含有较高蛋白质、脂肪和酶等成分,能影响枯草芽孢杆菌分泌更多纤维素酶,因此复合菌发酵后的稻草表面出现了空鼓、龟裂和开裂,改变了稻草的纤维结构。李国栋[17]研究发现,微生物在秸秆表面粗糙、结构疏松、有缝隙的情况下可更好地黏附和形成生物被膜。所以经过复合菌发酵的稻草在发酵期间以及瘤胃中能促进微生物定植。此外,分解的纤维素产生可溶性碳源,为微生物提供良好的生长条件,引起细菌增殖,乳酸菌发酵代谢产生乳酸,能够降低pH,此外,乳酸菌在有酵母菌的情况下,因为酵母菌代谢产物(丙酮酸、二氧化碳和其他盐类)可以刺激乳酸菌代谢,所以能够促进乳酸菌增殖并发酵产生更多乳酸,进而抑制霉菌生成[18]。本试验中,复合菌发酵稻草的霉菌总数低于发酵对照,而细菌总数高于发酵对照,所以复合菌参与稻草发酵可阻止霉变的产生。纤维性碳水化合物(FC)是反刍动物获得碳水化合物的重要来源。本试验中,稻草经过复合菌发酵,NDF和ADF含量降低,CP含量升高,这与刘玉琴[19]等研究结果一致,因此拥有更好的适口性和营养价值。
3.2 复合菌发酵稻草对安格斯牛生长性能的影响
本试验中,与RS组相比,FRS组的平均日增重显著提高了23.96%,料重比显著降低了18.86%,这说明饲喂复合菌发酵稻草能提高安格斯牛增重效果。本试验中FRS组平均日采食量和平均日增重的升高可能是因为复合菌发酵稻草NDF含量的降低,也有可能是因为复合菌对瘤胃发酵产生了积极的影响。复合菌中的枯草芽孢杆菌能够产生多种酶类,可以促进饲粮中营养成分的吸收利用,提高育肥效果和消化率[20];酿酒酵母通过刺激瘤胃纤维素分解菌的生长,加速FC分解吸收[21];乳酸菌在产生乳酸降低肠道pH的同时可合成维生素并分泌有利于生长的消化酶[22]。因此,复合菌可改善消化道生理过程,进而促进营养物质在消化道内的吸收,有利于生长发育,并降低了料重比。
3.3 复合菌发酵稻草对安格斯牛瘤胃发酵参数的影响
瘤胃pH是反刍动物瘤胃生理状态的重要体现,一般维持在5.00~7.50,FRS组和RS组的瘤胃pH均处在正常范围,说明复合菌发酵稻草并未增加酸中毒风险。NH3-N能为瘤胃微生物生长提供氮源,2组瘤胃NH3-N含量差异不显著,表明复合菌并不能够影响氮代谢。这与赵雅丽等[23]的研究结果一致。MCP是反刍动物小肠中氨基酸的重要来源,添加益生菌(酵母培养物和芽孢杆菌)可显著提高瘤胃MCP含量[24]。本试验中,FRS组瘤胃MCP含量极显著高于RS组,同样说明复合菌能提高瘤胃MCP含量。Hao等[25]研究发现,较高的瘤胃MCP含量有助于公羊生长性能,这与本试验结果一致,说明较高瘤胃MCP含量同样能提高安格斯生长性能。饲粮中的碳水化合物经过瘤胃微生物发酵产生乙酸、丙酸和丁酸等挥发性脂肪酸,能为反刍动物提供充足的能量[26]。高比例的丙酸可在糖异生作用下合成更多的葡萄糖,为肉牛生长提供丰富能量,而乙酸是乳脂合成的主要前体。本试验中,与RS组相比,FRS组的瘤胃乙酸含量有降低的趋势,丙酸含量有升高的趋势,说明复合菌发酵稻草能够引起瘤胃中乙酸含量的减少和丙酸含量的增加,促进安格斯牛增重。
3.4 复合菌发酵稻草对安格斯牛瘤胃菌群结构的影响
反刍动物瘤胃是一个充满微生物的复杂厌氧生态系统,高通量测序可以快速了解瘤胃内微生物菌群结构和种类[27],能够高效地研究复合菌发酵稻草对安格斯牛瘤胃菌群结构的影响。Sobs指数、ACE指数和Chao指数反映菌群丰富度,而Simpson指数越小,Shannon指数越大,说明菌群多样性越大。本试验中,FRS组的Ace指数和Chao指数极显著高于RS组,Sobs指数显著高于RS组,说明复合菌发酵稻草能提高菌群丰富度。而FRS组的Simpson指数有增长的趋势,并通过β多样性分析,说明复合菌发酵稻草可增加瘤胃菌群多样性。
吴琼等[28]研究发现,安格斯牛瘤胃中共有13个门,123个属,其中,门水平上的优势菌群为拟杆菌门和厚壁菌门,这与本试验结果相同。本试验中,2组的优势菌门为厚壁菌门,其次为拟杆菌门,这和董春晓等[29]在研究不同粗饲料来源对育肥湖羊瘤胃微生物区系影响中结果一致,但本研究结果与前人研究的第一优势菌门为拟杆菌门,其次为厚壁菌门的结果[30]不同。曾钰等[31]研究发现,随着饲粮中酵母培养物添加水平的提高,会引起拟杆菌门相对丰度提高,厚壁菌门相对丰度降低,这与本试验结果相似。同样地,张婷等[20]发现在饲粮中添加枯草芽孢杆菌有利于提高断奶早期驴驹平均日增重,增加拟杆菌门相对丰度。Evans等[32]研究发现,厚壁菌门主要参与纤维物质的分解,而拟杆菌门主要参与非纤维物质的降解。这有可能也与稻草经复合酶发酵后NDF等纤维素类物质降低有关。
在属水平上,瘤胃球菌属包括黄色瘤胃球菌和白色瘤胃球菌,是主要的纤维降解菌[33]。研究证明,纤维杆菌属和瘤胃球菌属_2均是动物胃肠道中重要的纤维分解菌[34],因此含有更高NDF等纤维素类物质的RS组含有更高的瘤胃球菌属_2相对丰度。本试验中,2组都含有瘤胃球菌属_2,且RS组的瘤胃球菌属_2相对丰度高于FRS组,本试验证实了这一推断,但这与前人研究中关于普雷沃氏菌属是瘤胃内相对丰度最高的一类细菌结果[35-36]不一致,这可能因为动物品种、年龄、饲粮结构与饲养管理的不同而引起拟杆菌门相对丰度低于厚壁菌门,从而导致属于拟杆菌门的普雷沃氏菌属相对丰度低于属于厚壁菌门的瘤胃球菌属。有研究表明,普雷沃氏菌属除了可以高效降解半纤维素,并能水解蛋白质、淀粉以外,还能发酵糖和氨基酸[37]。郭威等[38]在研究复合菌剂发酵玉米秸秆对绵羊瘤胃液细菌多样性影响时发现,饲喂发酵玉米秸秆的绵羊中普雷沃氏菌属相对丰度更高。这与本试验中FRS组的普雷沃氏菌属相对丰度高于RS组的结果一致。毛螺菌科_NK3A20群属于毛螺菌科,并属于厚壁菌门。王炳[39]通过试验发现,毛螺菌科_NK3A20群具有参与纤维降解的作用。本试验中,FRS组的毛螺菌科_NK3A20群相对丰度比RS组降低了6.67%。瘤胃菌科_NK4A214群属于厚壁菌门,具有降解纤维物质产生乙酸的作用[40]。本试验中,FRS组的瘤胃球菌科_NK4A214群相对丰度低于RS组,这也解释了本试验FRS组瘤胃中乙酸含量相比RS组有降低趋势的原因。以上结果表明,复合菌发酵稻草中较低的NDF等纤维素类物质含量,可能引起了瘤胃细菌含量及相对丰度地改变。
4 结 论
① 复合菌发酵稻草表面出现了空鼓、龟裂和开裂,在一定程度上改变了稻草纤维结构,经过复合菌发酵后的稻草营养价值更高,有减缓霉变的效果。
② 复合菌发酵稻草能提高安格斯牛的平均日增重和平均日采食量,降低料重比。
③ 复合菌发酵稻草能改善瘤胃发酵环境,提高瘤胃中MCP含量,并有提高丙酸含量和降低乙酸含量的趋势。
④ 复合菌发酵稻草可增加安格斯牛瘤胃菌群多样性和丰富度,同时影响门和属水平的菌群结构。
