外源褪黑素缓解奶(水)牛热应激的研究进展
2021-06-05王子晨高腾云刘深贺
王子晨 林 峰 高腾云 刘深贺
(河南农业大学动物科技学院,郑州 450046)
夏季牛场面临严峻的热应激问题,导致产奶量、奶品质、采食量、繁殖力下降,免疫功能受损,生理机能障碍,造成代谢疾病和蹄病多发,使牧场的经济效益下降[1-3]。据统计,热应激造成美国每年奶牛业损失达8.97亿~15.00亿美元[4],是限制养牛业发展的重要因素。基于此,牧场多采取3种措施缓解热应激:1)物理降温,如安装水帘、喷淋设备以及通风、遮阴设施,从而改善牛场环境[5];2)营养调控,主要是在饲粮中补充中草药、氨基酸类、维生素和微生态制剂等添加剂[6];3)培育耐热品种,虽能够从根源上降低热应激带来的经济损失,但周期较长[7]。由于热诱导下细胞功能受损的主要因素是引起氧化应激反应,研究者应用多酚、视黄醇、虾青素、维生素E和褪黑素(melatonin,MT)等抗氧化剂来降低热应激引起的细胞凋亡[8-9]。有研究发现褪黑素在清除自由基方面比谷胱甘肽更有效,甚至是维生素效果的2倍[10]。
MT又称为抑黑素、松果腺素,作为色氨酸衍生物,首次在脊椎动物的松果体中被发现,后陆续在胃肠道、胎盘、卵巢、视网膜和皮肤中被发现[11]。MT广泛参与机体生理活动,是季节性繁殖和昼夜节律的重要调节因子,与免疫调节、肿瘤发生、神经内分泌调节、清除自由基、抗氧化和延缓衰老等密切相关[12]。MT及其代谢产物作为一种强效的内源性自由基清除剂和抗氧化剂,通过一系列抗氧化反应来清除活性氧(reactive oxygen specie,ROS),从而防止自由基介导的氧化应激损伤[13]。天然来源的MT安全可靠、价格便宜、易提取、半衰期短且毒副作用小[14],对其功能和作用机理的深入研究,将为畜牧工作者对缓解奶(水)牛热应激的研究工作提供新思路。
1 外源MT缓解奶(水)牛热应激
1.1 奶牛热应激
我国奶牛多为北欧的荷斯坦牛,繁殖力低下和奶品质下降等难题在夏季热应激期间尤为突出[15]。奶牛热应激通常用温湿度指数(temperature humidity index,THI)作为评价指标,随着奶牛产奶量的提高,THI阈值已从72降为68,高于此值时奶牛出现热应激反应[16]。轻度热应激引起奶牛直肠温度与呼吸频率升高,奶牛生理状况、采食量、免疫能力和健康状况下降,最终导致奶牛患病率升高[17]。Lecchi等[18]指出热应激导致ROS水平升高从而引起奶牛免疫抑制。因此,不同学者采用不同给药方式,在夏季应用MT进行了奶牛抗热应激方法的研究(表1)。
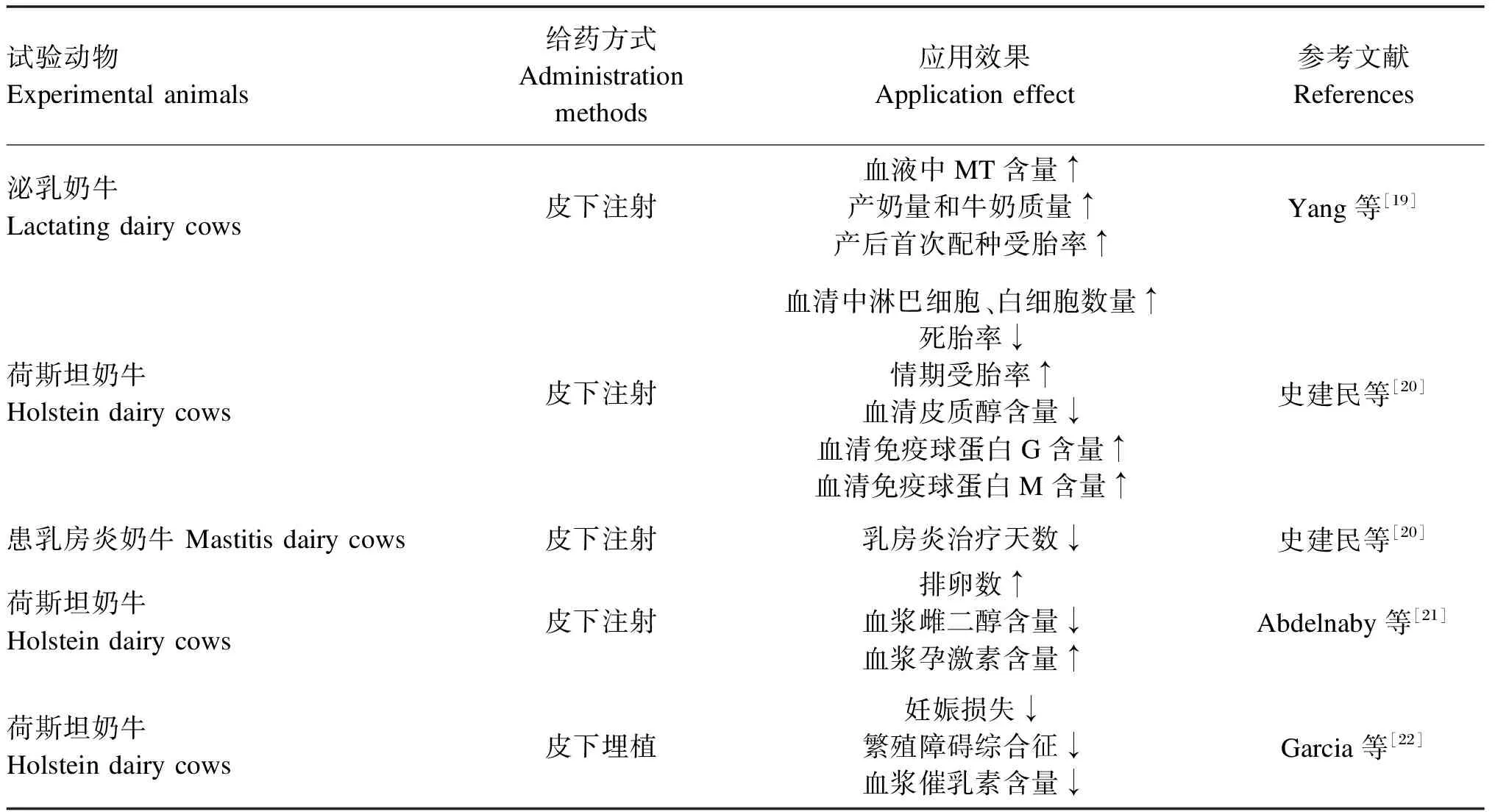
表1 外源MT缓解奶牛热应激的应用效果
MT能够缓解热应激对奶牛繁殖性能产生的负面影响。史建民等[20]研究MT在荷斯坦奶牛体内的分泌规律及代谢速度,发现皮下注射和静脉注射时血液MT含量最高。皮质醇含量与母牛卵母细胞质量有关,在热应激条件下血清皮质醇含量升高,补充MT后能够抑制这种变化并提高孕激素含量[21]。此外,皮下注射MT,降低了奶牛死胎率、妊娠损失和繁殖障碍综合征,提高了情期受胎率、产后首次配种受胎率[18]。Garcia等[22]对热应激牛进行皮下埋植MT,同样使奶牛妊娠损失和繁殖障碍综合征下降,并降低了死胎率、难产率和流产率。
目前,MT缓解夏季热应激奶牛相关的生理指标数据较少见报道,对不同动物生长性状的影响结果也并不一致[21]。MT更多地被应用于提高夏季奶牛场热应激奶牛的泌乳潜能。MT作为抗氧化剂具有杀菌作用,可增强机体免疫活性的能力,MT的应用能够提高奶牛产奶量和奶品质,治疗乳房炎、酮病和酸中毒[23]。白细胞数量和免疫球蛋白含量是判断热应激奶牛免疫能力的关键指标,研究人员对热应激奶牛皮下注射MT后将其血液进行常规指标分析,发现皮质醇含量降低至正常范围,血液中淋巴细胞、白细胞数量增加,免疫球蛋白G(IgG)、免疫球蛋白M(IgM)含量升高,白蛋白含量、谷丙转氨酶和乳酸脱氢酶活性也有所升高,最终牛奶体细胞数(SCC)降低[19,24-26]。SCC作为奶牛生产性能测定的重要指标用于衡量牛奶质量和乳房健康,SCC降低伴随着乳脂率和乳蛋白率的升高,牛奶产量和营养价值提高[27-28]。由于口服MT的生物利用率较低,皮下埋植难以准确控制剂量[25],所以研究中多应用皮下注射MT提高热应激奶牛的产奶性能。相比易引起耐药性和残留物有害的抗生素,MT能更有效、安全和快速地降低SCC[18]。但连续注射MT引起的应激不容忽视,且夏季长时间的注射或许会增加奶牛注射处伤口感染机率。
1.2 水牛热应激
水牛多栖居于炎热潮湿的地带,深色的皮肤和稀疏的毛发吸收大量太阳辐射,汗腺却不发达,极易发生热应激[29]。区别于奶牛,THI>75时水牛出现热应激[30]。热应激是水牛乏情的主要原因,在印度,水牛产后不发情率为20%~80%,并在夏季达到最高[31]。热应激造成繁殖力低下是水牛产业发展的瓶颈,主要包括母牛受孕率降低、胚胎死亡率升高、公牛精子质量与活力降低[32-35]。因此,研究人员在夏季应用MT来进行水牛抗热应激方法研究。
高温引起精子细胞的氧化应激,可以导致精子活力和活率降低,Ramadan等[34]对摩拉水牛皮下埋植18 mg/50 kg的MT后可以显著改善这一状况。对热应激下的公牛而言,MT能够清除ROS来提高精子活力,同时MT的使用改善了精液质量和精浆代谢产物,保护雄性生殖器官免受环境的氧化应激损伤,提高水牛非繁殖季节的繁殖力[35]。郭振伟等[36]在试验中发现MT能够有效缓解水牛卵母细胞氧化应激,促进孕激素的生成,促进促黄体激素和雌二醇的生成,提高卵母细胞的体外成熟率与体外受精的胚胎发育。外源注射MT引起血液中MT含量的升高,由此引起血浆促性腺激素释放激素(GnRH)含量升高,促进卵泡生长和排卵[37]。有研究指出外源MT使血液中MT含量升高可能与抗氧化能力的提高呈正相关[38]。佟桂芝等[39]研究发现,MT的抗氧化能力辅助卵泡生长因子调节,降低了繁殖综合征和妊娠损失的发生率,促进体外培养的牛胚胎质量和发育。外源MT缓解水牛热应激的应用效果见表2。

表2 外源MT缓解水牛热应激的应用效果
水牛作为单胎动物,季节性发情且性成熟晚,炎热条件下发情特征不明显,热应激水牛发情持续时间缩短,生产上应用同期发情技术结合人工授精、超数排卵和胚胎移植从而提高生产效率[41]。D’occhi等[42]的研究中发现,在应用GnRH和孕酮进行同期发情前使用MT治疗的水牛,其黄体功能增强,且维持妊娠能力提高。Ramadan等[33]在内控药物释放装置(controlled internal drug release,CIDR)+马绒毛膜促性腺激素(eCG)方案应用前添加MT,通过减少大卵泡的闭锁增加了排卵卵泡的数量,使夏季热应激水牛的受胎率升高至100%。不仅是水牛,高翔[38]对夏季乏情的西门塔尔牛应用诱导促排卵技术(Ovsynch方案)实施前采用MT治疗,卵泡直径增大,受孕率提高。MT通过恢复热应激状态下乏情水牛的发情周期,从而提高发情率和受孕率。在牛体外研究中MT的剂量多在10-6~10-9mol/L[36,40],皮下埋植MT的剂量多为18 mg/50 kg[33,40],然而MT的添加对牛抗热应激的有益作用呈一定范围的剂量依赖,不同的给药方式效果比较以及与同期发情方案的最佳组合均有待进一步研究。
2 外源MT对热诱导动物细胞损伤的保护机理
2.1 MT与氧化应激
近年来,随着分子遗传学发展,国内外对热应激的研究深入到细胞水平。相比精液质量不佳,卵母质量下降是造成高温季节牛繁殖力低的主要原因[43]。与此观点一致,Sakatani等[44]无论使用哪种季节采集的奶牛精液,在高温季节受孕率都较低。Li等[45]指出热应激引起的氧化应激反应是危害细胞生理功能的主要因素。
MT主要通过3个途径保护动物细胞免受热应激诱导的氧化应激影响(图1):1)作为自由基清除剂,保持细胞中氧化还原水平和保护细胞免受自由基的损伤[46];2)通过结合MT受体间接作用于抗氧化酶[47],以更好地保护机体免受自由基的氧化损伤;3)依靠其化学结构提供电子以及抑制一氧化氮合酶(nitric oxide synthase,NOS)的活性[48],Galano等[49]认为电子转移是决定MT自由基清除活性的主要机制。
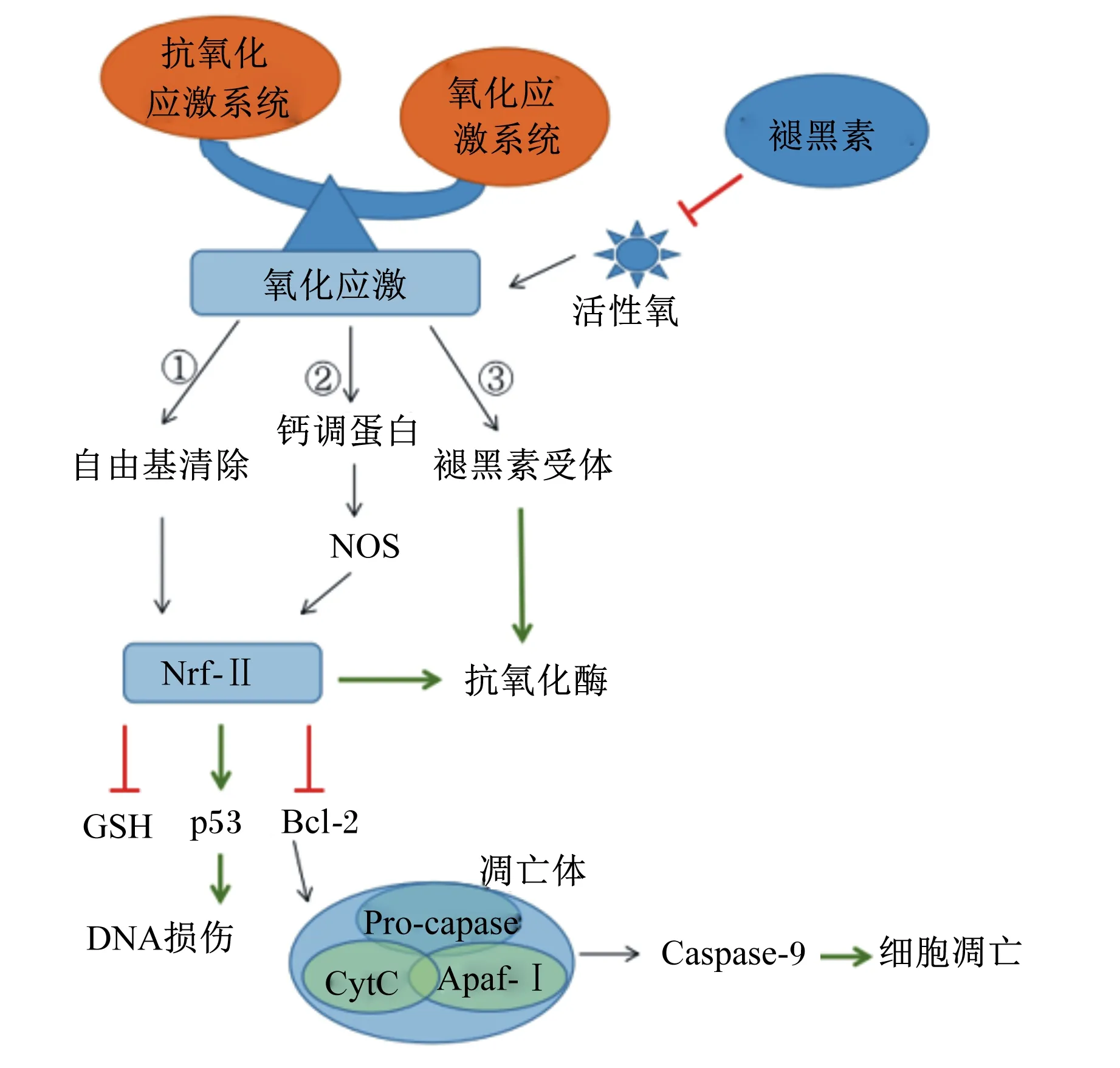
NOS:一氧化氮合酶nitric oxide synthase;Nrf-Ⅱ:核因子E2相关因子-Ⅱ nuclear factor erythroid 2-related factor-Ⅱ;GSH:谷胱甘肽glutathione;CytC:细胞色素C cytochrome C;Apaf-Ⅰ:凋亡酶激活因子-Ⅰapoptotic protease activating factor-Ⅰ;Bcl-2:B细胞淋巴瘤-2 B-cell lymphoma-2;Caspase-9:半胱氨酸天冬氨酸蛋白酶-9 cysteine aspartic acid protease-9。
清除细胞内的ROS对牛卵母细胞成熟发育至关重要,MT通过清除ROS和NOS阻止氧化损伤可能是通过核因子E2相关因子-Ⅱ(Nrf-Ⅱ)抗氧化反应元件信号通路[50]。通过激活抗氧化基因,降低ROS水平、升高谷胱甘肽(GSH)的表达水平和活性。Reiter等[51]指出生理剂量的MT能够促进GSH的大量生成,从而调节卵母细胞受精能力,提高奶(水)牛卵母细胞和胚胎发育质量。此外,MT促进抗凋亡基因B细胞淋巴瘤-2(Bcl-2)基因的表达,抑制促凋亡基因p53的表达,减少了热诱导的细胞凋亡。在牛体细胞核移植胚胎[52]、猪卵母细胞[45]、绵羊卵母细胞[53]和小鼠颗粒细胞[54]等试验中均有报道MT对细胞氧化应激的保护作用。Fu等[55]报道了外源性MT的补充保护了配子和羊早期胚胎的发育,减少了DNA、蛋白质和脂质免受ROS和自由基损伤。Papis等[56]的试验在培养液中添加MT,减少了氧化应激,从而提高牛体外受精胚胎发育。
2.2 MT与内质网应激
热应激下未折叠或错误折叠蛋白的积累会产生内质网应激(endoplasmic reticulum stress,ERS),并引起未折叠蛋白反应(unfolded protein response,UPR)[57](图2)。内质网应激损害颗粒细胞功能,造成卵母细胞成熟延迟,损害受精和植入前胚胎发育,最终损害动物的繁殖效率[58-59]。Alemu等[57]研究结果显示热应激显著增加了24 h培养的牛颗粒细胞内质网应激标记基因葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)和葡萄糖调节蛋白94(glucose regulated protein 94,GRP94)的表达。
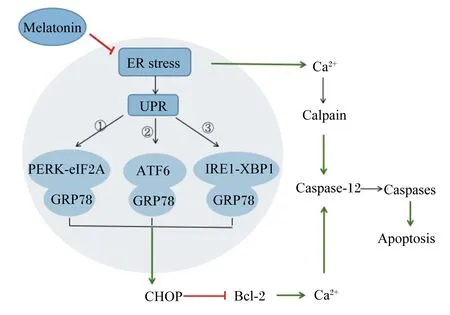
Melatonin:褪黑素;ER stress: 内质网应激 endoplasmic reticulum stress;UPR: 未折叠蛋白反应 unfolded protein response; GRP78: 葡萄糖调节蛋白78 glucose regulated protein 78;Caspase-12: 半胱氨酸天冬氨酸蛋白酶-12 cysteine aspartic acid protease-12;Bcl-2:B细胞淋巴瘤-2 B-cell lymphoma-2;PERK-eIF2A:蛋白激酶样内质网激酶-真核启示因子2α protein kinase-like ER kinase-eukaryotic translation initiation factor 2 alpha;ATF6:活化转录因子6 activating transcription factor 6;IREⅠ-XBPⅠ:肌醇需求酶Ⅰ-盒结合蛋白Ⅰ inositol requiring enzyme Ⅰ-X-box binding protein-Ⅰ;CHOP:C/EBP同源蛋白C/EBP homologous protein;calpain:钙蛋白酶;Caspases:细胞凋亡蛋白酶;Apoptosis:细胞凋亡。
MT可以影响内质网中抑制蛋白合成的蛋白折叠和降解途径,通过ER伴侣GRP78和蛋白激酶样内质网激酶-真核启示因子2α(PERK-eIF2A)、活化转录因子6(ATF6)、肌醇需求酶Ⅰ-盒结合蛋白Ⅰ(IREⅠ-XBPⅠ)3种跨膜蛋白结合影响下游基因的表达,而MT对UPR通路的影响体现于它调节细胞凋亡的能力[59]。MT抑制热休克蛋白的表达,再通过细胞凋亡途径下调促凋亡基因半胱氨酸天冬氨酸蛋白酶-3(cysteine aspartic acid opalase-3,Caspase-3)和半胱氨酸天冬氨酸蛋白酶-12(cysteine aspartic acid opalase-12,Caspase-12)的表达水平,阻止热诱导的细胞凋亡同时维持细胞稳态[60]。Hassan等[60]指出热休克蛋白与家畜的耐热性以及奶牛断奶体重、繁殖力和疾病易感性均相关。在小鼠的卵母细胞成熟和胚胎发育过程中,MT可有效抵抗热应激引起的内质网应激[61]。Park等[62]的试验中证实了MT在猪卵母细胞体外培养过程中可调节UPR信号通路从而降低内质网应激。贾甜甜等[50]研究发现MT的使用作为内质网应激抑制剂可恢复受热应激影响的牛卵母细胞成熟。尽管许多研究已经报道了MT在缓解热应激中的重要作用,有关内质网应激在牛产业上的详细机制有待深入研究。
3 小结与展望
近几年MT提取方法升级,利用化学合成方法制备MT的工艺较成熟,纯度高,生产成本大大降低,基于MT生物功能的多样性,MT应用于奶(水)牛抵抗热应激的研究不断发展,但局限于试验阶段,诸多问题有待解决,如MT的给药方式和有效浓度有待进一步探究,长期使用的安全性、对奶(水)牛的生殖生理功能和机体健康的不利影响有待进一步确定。随着科研人员致力于MT作用机制的研究,MT正确安全的应用于养牛业抗热应激方面指日可待。
