DYRK2高表达介导结直肠癌奥沙利铂耐药
2021-06-05陈颖杨博文包博文李智车晓芳
陈颖,杨博文,包博文,李智,车晓芳
(1.中国医科大学附属第一医院肿瘤内科,沈阳 110001;2.辽宁省抗肿瘤药物与生物治疗重点实验室,沈阳 110001)
全球结直肠癌发病率一直呈上升趋势,每年新诊断的肠癌超过120万例,死亡病例高达60余万例[1]。但不幸的是,肠癌患者的存活率仍然很低,大约10%~15%的术后患者在5年内发生转移,近一半的肠癌患者生存时间不足5年[2]。奥沙利铂是晚期肠癌一线化疗方案不可或缺的药物之一,但仍有将近50%患者对奥沙利铂治疗无反应,且目前为止仍缺乏化疗疗效的预测因子[3]。
奥沙利铂是铂类家族化合物的一种,对肠癌细胞杀伤作用主要是与DNA碱基结合并与DNA相互作用,触发凋亡途径,造成DNA损伤[4]。截至目前,奥沙利铂耐药机制主要包括细胞内药物的低效摄取、抗氧化谷胱甘肽系统的解毒激活、DNA修复的增强和抗凋亡途径的激活以及上皮-间充质转化等[5-6]。但对奥沙利铂药物敏感性没有特定的疗效预测因子,找到奥沙利铂疗效相关的分子生物标志物至关重要。
1 材料与方法
1.1 数据来源
从基因表达数据库(gene expression omnibus,GEO)下载结直肠癌基因表达芯片数据集,筛选条件为晚期肠癌患者,含有奥沙利铂药物的疗效评价信息,病例数>30例,包含全基因组RNA表达谱数据。筛选出5个CEO数据集,分别为GSE27702、GSE69657、GSE72968、GSE72969和GSE72970。在 人类癌细胞系(national cancer institute,NCI60)数据库中找到与奥沙利铂相关的基因,按照相关性进行排序,P< 0.05纳入统计。合并了CEO中5例的公开测序数并除去批间差,筛选出与奥沙利铂相关的基因。将2种方法筛选出来的奥沙利铂耐药相关分子取交集,找出28个基因,其中包含双特异性酪氨酸磷酸化调节激酶(dual specificity tyrosine phosphorylation regulated kinase 2,DYRK2),见图1。
1.2 在线数据库分析
应用基因、蛋白质相互作用关系检索工具(search tool for the retrival of interacting genes/proteins,String)找到与DYRK2相关蛋白,功能富集分析数据库(the database for annotation,visualization and integrated discovery,DAVID)和功能富集分析数 据库(Metascape)进行在线通路富集分析,基因表达谱分析数据库(gene expression profilling interactive analysis,GEPIA)分 析DYRK2与Notch蛋白的相关性。
1.3 细胞系培养
HCT116和Caco2肠癌细胞购自上海中国科学院典型培养物保藏委员会细胞库,应用含有10%灭活胎牛血清、1%青链霉素的1640培养液培养。细胞置于37 ℃、5%CO2、饱和湿度的常氧培养箱内培养。待细胞长满培养基90%左右,使用0.25%胰蛋白酶消化传代,传代频率为3~4 d。所有实验均采用对数生长期细胞。每8周弃掉细胞并复苏冻存细胞。
1.4 MTT试验
MTT法测定细胞活性,将细胞悬液(3×103/180 μL)加入到96孔培养板中,在37 ℃和5%CO2条件下进行培养。待细胞贴壁后,加入不同浓度的奥沙利 铂(1 μmol/L、3 μmol/L、10 μmol/L、30 μmol/L、50 μmol/L),在1640培养液中培养48 h,每孔加入20 μL MTT溶液(5 mg/mL),在37 ℃和5%CO2条件下培养4 h。吸弃每孔中的溶液,并加入200 μL DMSO。采用酶标仪检测570 nm处的光密度(optical density,OD)值。按照公式计算细胞增殖百分比:相对细胞活性=(OD570测量-OD570空白)/(OD570对照-OD570空白)×100%。使用GraphPad Prism 7.0计算半抑制浓度(50%inhibiting concentration,IC50)值。
1.5 脂质体介导siRNA转染
HCT116和Caco2以8×104/孔接种在6孔板内,待24 h细胞贴壁。将15 μL siRNA-DYRK2-NC、15 μL siRNA-DYRK2-1、15 μL siRNA-DYRK2-2分别加入于235 μL无血清无抗生素(双无)的培养液静置5 min,等待过程中将6 μL Lipofectamin2000轻轻加入于244 μL双无的1640培养液中。后续将含有siRNA的培养液混入后含有Lipofectamin2000培养液静置20 min。原培养板更换为1.5mL的双无培养液。最后将总体积500 μL的混合液加入培养孔中,轻轻混匀。将细胞置入培养箱孵育6 h后,更换含10%胎牛血清和1%青链霉素的培养液,转染72 h后收取PCR样。
1.6 实时PCR
加入TRIzol溶解RNA。按照PrimeScript® RT reagent Kit with gDNA Eraser(日本TaKaRa公司)试剂盒说明书将800 ng总RNA反转录成cDNA。后续按照SYBR®Premix EX TaqTM2(日本TaKaRa公司)试剂盒流程将800 ng cDNA配置成实时PCR反应液。RT-qPCR用Applied Biosystems® 7500 Real-Time PCR Systems(美国Thermo公司)进行检测,以18 S作为内参,检测DYRK2mRNA的表达。
1.7 统计学分析
2 结果
2.1 药物敏感性检测
CELL细胞系NCI60中包括乳腺癌、中枢神经系统、肠癌、白血病、恶性黑色素瘤、肺癌、卵巢癌、前列腺癌以及肾癌肿瘤的细胞系,DYRK2与奥沙利铂的药物敏感性为负相关。在单独肠癌细胞系中,DYRK2与奥沙利铂的药物敏感性也为负相关。即DYRK2的表达越高,奥沙利铂越耐药。见图2。
2.2 DYRK2在肠癌细胞系Caco2和HCT116中的敲减效率
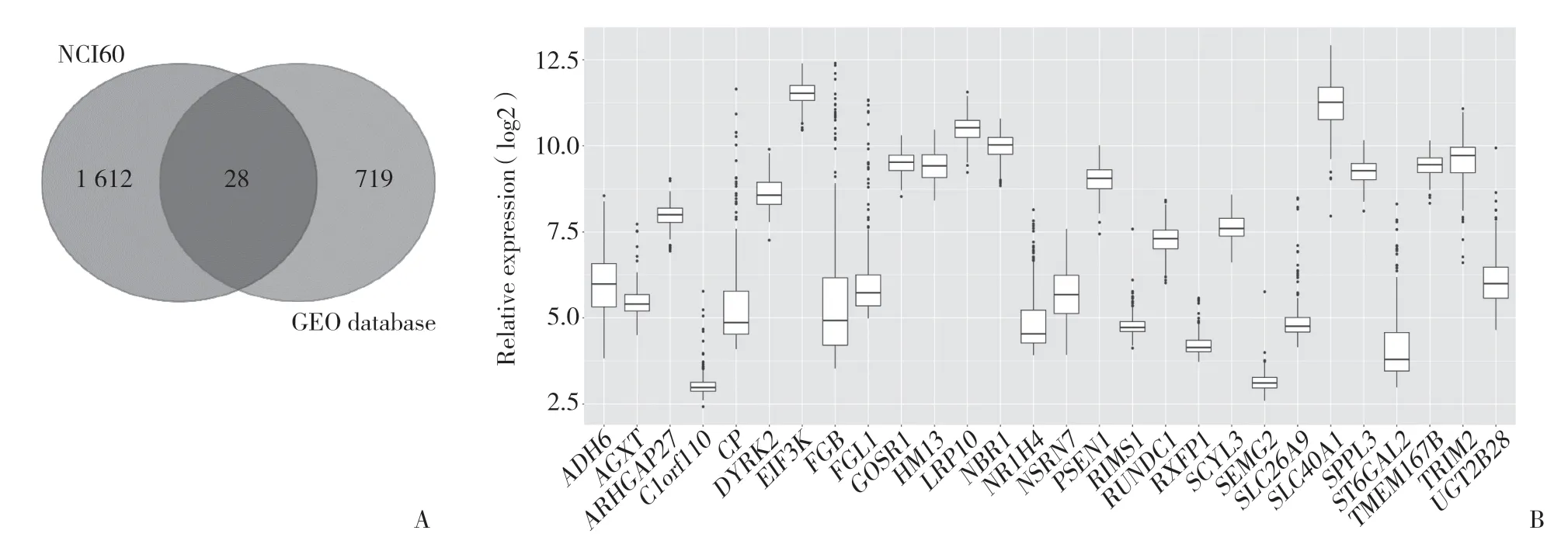
图1 GEO数据集与NCI60筛选出的基因交集及mRNA表达Fig.1 Intersection of gene screening in GEO and NCI60 databases,and mRNA expression

图2 DYRK2与奥沙利铂敏感性Fig.2 DYRK2 and oxaliplatin sensitivity
将Caco2和HCT116细胞系分为对照组和不同DYRK2敲减序列组,48 h实时PCR验证各组细胞中DYRK2的mRNA表达。结果显示,与对照组相比,Caco2细胞系中si-DYRK2-1(0.299±0.037)和si-DYRK2-3(0.190±0.016)的mRNA表达减少(P< 0.000 1),HCT116细胞系中si-DYRK2-1(0.232±0.004)和si-DYRK2-3(0.223 ±0.019)的mRNA表达减少(P< 0.000 1)。见图3。

图3 转染后Caco2和HCT116细胞中DYRK2的mRNA表达Fig.3 DYRK2 mRNA expression in Caco2 and HCT116 cells after siRNA knockdown
2.3 DYRK2敲减后Caco2和HCT116对奥沙利铂的敏感性
Caco2和HCT116中DYRK2敲减48 h后,加入不同浓度奥沙利铂进行MTT试验,48 h后显示敲减后细胞对奥沙利铂敏感性增加。说明DYRK2在肠癌奥沙利铂耐药中发挥作用。见图4。

图4 敲减DYRK2后Caco2和HCT116细胞在不同奥沙利铂浓度下的OD值Fig.4 After DYRK2 knockdown,OD values of Caco2 and HCT116 cells exposed to different oxaliplatin concentrations
2.4 String在线分析
将DYTK2输入String数据库中,设定中度相关,找到与DYRK2相关的11个蛋白,其中包括TP53等肿瘤相关蛋白,见图5。

图5 String在线分析Fig.5 String online analysis
2.5 DAVID和Metascape在线通路富集分析
将得到的28个基因,利用DAVID线数据库进行GO分析,Metascape在线数据库进行基因聚类分析,设定P< 0.05。结果显示,GO分析中分子功能(molecular function,MF)包括锌离子结合、氧化还原酶、天冬氨酸蛋白酶。细胞组分(cellular component,CC)包括高尔基体相关、细胞整体组分相关、内质网相关。生物过程(biological process,BP)包括细胞内铁离子、信号肽、膜蛋白、Notch信号通路。此外,基因聚类分析到二羧酸转运子、膜蛋白胞外域蛋白水解等9个信号通路。GEPIA在线分析结果显示,DYRK2与Notch的4个亚型Notch1相关性为0.33,Notch2相关性为0.63,Notch3相关性为0.43,Notch4相关性为0.30。提示DYRK2可能通过Notch其中的后续通路发挥奥沙利铂的耐药作用。见图6。

图6 在线数据库进行后续通路分析及相关性分析Fig.6 Online databases queried for follow-up pathway and correlation analyses
3 讨论
奥沙利铂为肠癌患者带来生存获益,但奥沙利铂耐药也是导致化疗失效或者疗效减弱的重要原因之一。本研究筛选出5个GEO数据集,并且将NCI60中奥沙利铂耐药相关基因取交集,筛选出可能与奥沙利铂相关的预测因子DYRK2。DYRK2是一个双特异性酪氨酸(Y)磷酸化调节激酶基因,是进化保守的DYRKs家族的成员[7-9]。有研究[10]表明DYRK2参与许多生物学事件,如细胞周期进程和DNA损伤。癌细胞中DYRK2基因的敲除缩短了G1期,加速了细胞增殖[11]。此外,DYRK2与含有EDD、DDB1和VPRBP蛋白的E3连接酶复合体(EDVP复合体)结合。小干扰RNA介导的DYRK2缺失破坏了EDD-DDB1-VPRBP复合物的形成,这些观察表明蛋白激酶DYRK2是促进E3连接酶组装的支架[12]。DYRK2曾报道与肠癌肝转移相关[13],肝癌中与奥沙利铂敏感性相关[14],但在肠癌中与奥沙利铂关系不清。
将选取的Caco2、HCT116肠癌细胞进行了DYRK2敲减,证实DYRK2表达减少后对奥沙利铂的敏感性增加,说明DYRK2高表达与奥沙利铂耐药相关,对在线数据分析结果进行了验证。首先应用String数据库分析了与DYRK2相关的11个蛋白,其中包括著名的TP53蛋白,研究[15]显示,KRAS/TP53突变显著增加了肠癌HCT116细胞对奥沙利铂的活性,T53的半衰期缩短能够抑制奥沙利铂诱导的大肠癌细胞凋亡[16]。前期有研究[17]显示DYRK2可以通过磷酸化Ser46调节TP53诱导DNA损伤诱导凋亡,DYRK2是否在奥沙利铂耐药中与TP53有协同作用后续有待基础实验验证。通路富集中包括经典Notch通路,Notch1受体胞内区NICD1和非磷酸化的β-catenin是Notch1和Wnt信号转导的报告因子,在既往研究[18]建立的HCT116耐药细胞系中表达上调。激活的Notch信号促进了肠癌干性相关基因的表达,从而导致了奥沙利铂的耐药[19]。GEPIA在线数据中看到DYRK2与Notch的4个亚型高度相关,后续可能通过Notch通路发挥作用。
综上所述,DYRK2高表达提示奥沙利铂耐药,可能作为结直肠癌奥沙利铂疗效的预测因子,后续需要进一步在临床患者中进行验证,并且后续作用机制需要进一步深入研究,如能找到阻断药物,将使肠癌患者更大获益。
