β-环糊精辅助提取黑果腺肋花楸多酚的工艺优化
2021-06-04李瑜王周利蔡瑞杨逍迪岳田利袁亚宏崔璐
李瑜,王周利,蔡瑞,杨逍迪,岳田利,袁亚宏,崔璐
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
黑果腺肋花楸又名不老莓、野樱莓,是蔷薇科,腺肋花楸属多年生落叶灌木,原产地在美国东北部,在20世纪90年代初,为改善土壤、环境条件,引入我国辽宁省西北部[1,2]。其果实为紫黑色圆形浆果,可加工成果汁、果酒、果酱、罐头、果脯等食品和饮料,是一种具有极高营养价值与经济价值的新型小浆果[3]。研究结果表明,黑果腺肋花楸果实中富含花青素、原花青素和酚酸等多酚类物质[4],且多酚含量是已知植物中最高[5]。这些多酚类物质具有极强的抗氧化活性[6]、抗衰老[7]、抗癌[8]、预防心脑血管疾病[9]、免疫调节和抗炎[10]等功能,可以保持人体正常生理机能。目前,黑果腺肋花楸中多酚类物质的提取大多采用溶剂提取法,如Wangensteen等[11]使用80%乙醇作为溶剂提取提取黑果腺肋花楸浆果酚类物质;郑悦等[12]分别用水、50%~100%乙醇溶液和50%~100%甲醇溶液作为提取溶剂提取黑果腺肋花楸中花色苷。但有机溶剂具有一定的危害性,因此尝试使用无污染的有机食品添加剂β-环糊精提取多酚具有一定的研究价值。
近年来,利用β-环糊精作为提取剂,提取植物重要活性成分的研究逐渐增多[13]。β-环糊精是一种环状低聚糖,具有外亲水、内疏水的独特结构[14]。在水溶液中,由于其特殊的环状中空圆筒型结构,可以选择性的包合大小和形状合适的分子形成β-环糊精包合物,如挥发油和多酚类化合物等[15]。朱德艳[16]采用β-环糊精为辅助材料对紫茄皮中的花青素进行提取。冯欢欢等[17]以β-环糊精为提取介质,蒸馏水为提取溶剂,从茶末中提取多酚类物质。与有机溶剂提取相比,采用β-环糊精提取多酚物质,更安全、经济和环保[18]。
本试验首先通过单因素试验和响应面优化试验得到β-环糊精提取黑果腺肋花楸中多酚的最佳条件,然后在最佳提取条件下对β-环糊精提取的黑果腺肋花楸多酚类物质进行HPLC分析。本研究旨在探讨β-环糊精辅助提取黑果腺肋花楸中多酚类物质的可行性,以期为黑果腺肋花楸的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸冻果(产自辽宁省),除去叶片、枝干等杂质后常温解冻,榨汁机充分打碎果实至浆(成汁状),置于棕色瓶于4 ℃冰箱中密封储存备用。
甲醇:分析纯,四川西陇化工有限公司;β-环糊精:分析纯,天津市科密欧化学试剂有限公司;福林酚:分析纯,北京索莱宝科技有限公司;没食子酸:分析纯,天津市科密欧化学试剂有限公司;无水碳酸钠:分析纯,四川西陇化工有限公司;乙腈,色谱纯,安徽天地高纯溶剂有限公司;乙酸、甲醇,色谱纯,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
HR2096飞利浦搅拌机:飞利浦电子香港有限公司;SBL-30DTY超声波恒温清洗机:宁波新芝生物科技有限公司;JA2003电子分析天平:上海舜宇恒平科学仪器有限公司;RE-5205旋转蒸发器:上海亚荣生化仪器厂;HC-3018R高速冷冻离心机:安徽中科中佳科学仪器有限公司;优普超纯水制造系统:西安优普仪器设备有限公司;UVmini-1240紫外可见分光光度计、LC-20ADpump高效液相色谱仪:岛津公司。
1.3 试验方法
1.3.1 多酚物质的提取
准确称取3.0 g黑果腺肋花楸匀浆置于50 mL具塞三角瓶中,分别加入水、50%甲醇溶液和33 g/Lβ-环糊精溶液各20 mL,在功率400 W、33 kHz、温度40 ℃条件下,超声提取60 min后,于5000×g、4 ℃条件下离心10 min。分别取上清液1.0 mL旋转蒸干,用20 mL甲醇溶解多酚并沉淀β-环糊精,过滤,将上清液置于50 mL锥形瓶中封口避光待用。
1.3.2 总酚含量的测定
采用福林-酚法测定总酚含量[19]。配制没食子酸的质量浓度分别为0、2、4、8、16、32、64、100 μg/mL,量取0.5 mL没食子酸溶剂于10 mL离心管中,依次加入2.0 mL、7.5% Na2CO3溶液和2.0 mL蒸馏水和0.5 mL Folin-Ciocalteau试剂,摇匀,于40 ℃水浴中避光反应90 min后,在波长765 nm处测定吸光度,平行设计3组试验。以没食子酸质量浓度(C)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得回归方程。
其中按照标准曲线制作方法,测定样品吸光度,多酚含量的计算公式如下:
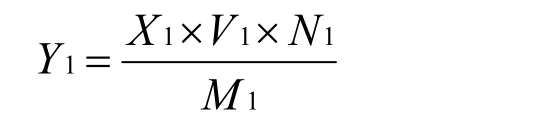
式中:Y1为样品中多酚的浓度(mg/g);X1为样品中多酚的浓度(mg/mL);V1为样液体积(mL);N1为稀释倍数;M1为样品的质量(g)。
1.3.3 单因素试验
准确称取3.0 g黑果腺肋花楸匀浆置于50 mL具塞三角瓶中,分别考察β-环糊精质量浓度(5、10、15、20、25、30、35 g/L)、温度(30、40、50、60、70 ℃)及提取时间(20、40、60、80、100 min)对多酚提取率的影响。
1.3.4 响应面优化试验
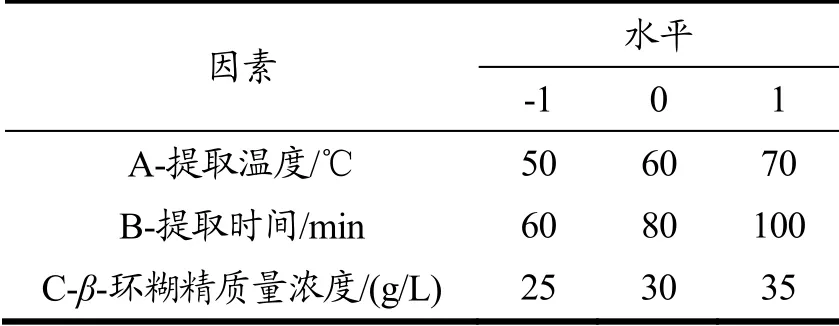
表1 响应面试验因素水平及编码Table 1 Response surface test factor level and coding
在单因素试验的基础上,采用统计分析软件Design-Expert 8.0.6中Box-Behnken试验方法[20],以β-环糊精浓度、提取温度和提取时间为自变量,以多酚的提取量为响应值,设计3因素3水平试验方案,试验因素水平及编码见表1。
1.3.5 HPLC分析
色谱条件:岛津HPLC系统(LC20AD高压泵、SPD-M20A型二极管、CTO-10AS柱温箱);色谱柱:Agilent5 TC-C18 250×4.6 mm;柱温30 ℃;流动相A为乙腈(含0.5%乙酸):超纯水=1:1,流动相B为2%乙酸超纯水溶液;280 nm、320 nm双通道检测;洗脱程序:洗脱程序:0 min~3 min,A为10%,3 min~15 min,A为15%,15 min~25 min,A为45%,25 min~35 min,A为55%,35 min~45 min,A为80%,45 min~50 min,A为80%,50 min~51 min,回到初始状态。
精确称取9种多酚标准品(香草酸、表儿茶素、p-香豆酸、阿魏酸、根皮苷、肉桂酸、绿原酸、咖啡酸、槲皮素)各1.0 mg,配置成5 mL 0.02 mg/mL单标和混标,经液相分析得到单标和混标图,通过保留时间对混合标准色谱图中的各个峰进行定性,并通过峰面积进行定量。
1.3.6 数据处理
单因素试验采用Excel 2010进行数据处理。Box-Behnken设计采用统计分析软件Design Expert 8.0.6对响应面实验数据进行二次多项回归拟合方差分析、显著性检测和响应面分析,获取回归模型及最佳提取工艺参数[21]。
2 结果与分析
2.1 标准曲线的制备

图1 没食子酸标准曲线Fig.1 Gallic acid standard curve
由线性模拟试验结果得标准曲线如图1所示,没食子酸标准的线性回归方程为y=0.0067x+0.023,由回归系数(R²=0.9998)可知,当没食子酸浓度在0~100 μg/mL范围内时,没食子酸浓度和吸光度线性关系良好。
2.2 单因素试验结果
2.2.1β-环糊精浓度对黑果腺肋花楸提取多酚的影响
如图2所示,在超声400 W、33 kHz、40 ℃、60 min的提取条件下,当β-环糊精浓度从5 g/L升高至25 g/L时,多酚的提取量显著增加,从6.46 mg/g提高到8.19 mg/g,这是因为β-环糊精的浓度提高,提取过程中形成的β-环糊精-多酚包合物越多,最终得到的多酚提取量也越多;再继续增大β-环糊精的浓度至35 g/L,提取的多酚量没有显著性增加,为8.37 mg/g(30 g/L)、8.34 mg/g(35 g/L)。因此,选择β-环糊精质量浓度25 g/L、30 g/L、35 g/L进行后续响应面优化试验。
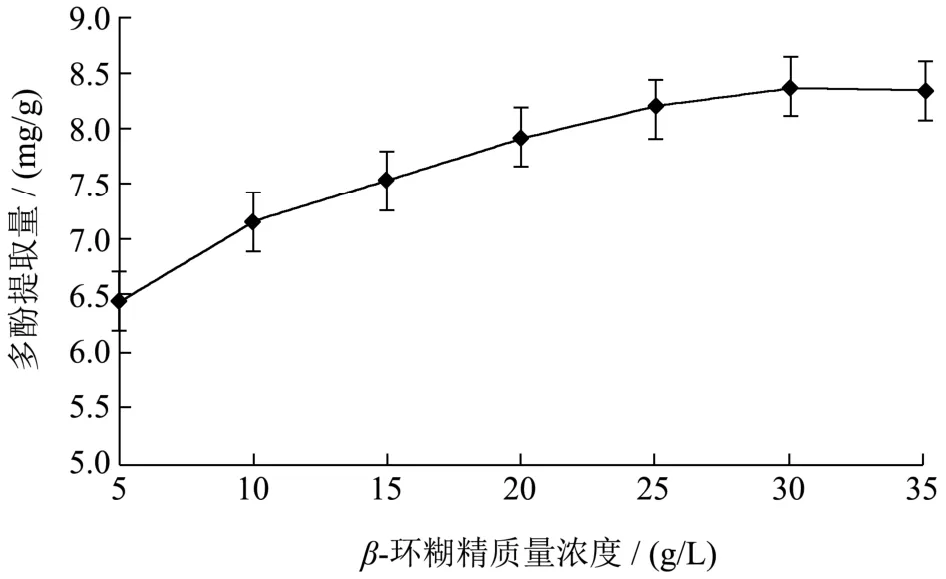
图2 β-环糊精浓度对黑果腺肋花楸提取多酚的影响Fig.2 The effect of β-cyclodextrin concentration on the extraction of polyphenols from Aronia melanocarpa
2.2.2 提取温度对β-环糊精提取黑果腺肋花楸中多酚的影响

图3 提取温度对β-环糊精辅助提取黑果腺肋花楸中多酚的影响Fig.3 The effect of extraction temperature on β-cyclodextrin-assisted extraction of polyphenols from Aronia melanocarpa
如图3所示,在β-环糊精浓度为15 g/L,超声400 W、33 Hz、提取时间60 min的提取条件下,提取温度从30 ℃升高到50 ℃时,多酚的提取量显著增加,从6.14 mg/g提高到7.96 mg/g,分析原因可能是因为温度升高有利于多酚的溶出;继续升高提取的温度至70 ℃,多酚的提取量没有显著性增加,为8.21 mg/g(60 ℃)、8.46 mg/g(70 ℃)。判断可能是因为温度升高一方面导致β-环糊精-多酚包合物脱包合,另一方面部分多酚被氧化,多酚浓度不再上升[22]。因此,选择提取温度50 ℃、60 ℃、70 ℃进行后续响应面优化试验。
2.2.3 提取时间对β-环糊精提取黑果腺肋花楸中多酚的影响
如图4所示,在β-环糊精浓度为15 g/L,超声400 W、33 Hz、40 ℃的提取条件下,提取时间从20 min延长至80 min时,多酚的提取量显著增加,从6.48 mg/g提高到7.81 mg/g,继续延长提取的时间至100 min,提取的多酚量没有显著性增加,为7.90 mg/g。判断可能是因为提取时间延长,多酚的溶出已经达到饱和,故提取量趋于平衡。因此,选择处理时间60 min、80 min、100 min进行后续响应面优化试验。
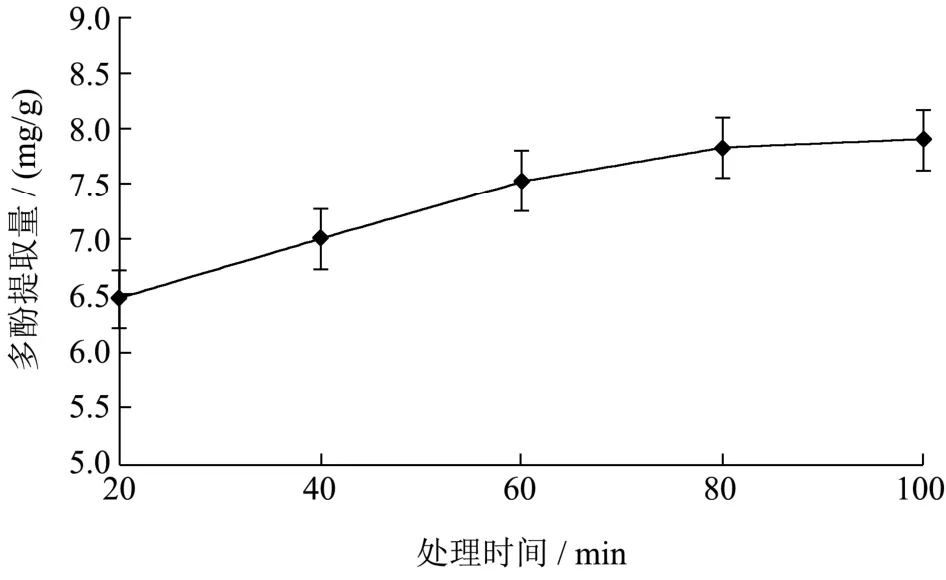
图4 提取时间对β-环糊精辅助提取黑果腺肋花楸中多酚的影响Fig.4 The effect of extraction time on β-cyclodextrin-assisted extraction of polyphenols from Aronia melanocarpa
2.3 响应面试验结果
2.3.1 二次响应面回归模型的建立与方差分析

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken experimental design and results
响应面试验设计及结果见表2。采用Design-Expert 8.0.6软件对表2试验数据进行回归分析,得到方差分析结果见表3。对各因素进行回归拟合,得到多酚提取量(Y)和提取温度(A)、提取时间(B)、β-环糊精质量浓度(C)之间的二次多项回归方程为:
Y=109.02+2.58A+0.23B+1.53C+1.46E-0.030AB-0.015AC-2.22E-0.040BC-0.017A2-1.70E-0.030B2-7.92E-0.030C2(R2=0.9859)
对该模型回归方差分析,结果如表3所示。由表可知:此二次回归模型方程是显著的(p<0.0001<0.05);失拟项不显著(p=0.7888>0.05),说明该回归模型方程显著。相关系数R2为0.9859,表明该模型的二次多项回归方程拟合良好,即这种试验方法是准确可靠的,可以使用该方程模拟真实的3因素3水平分析,用该模型对多酚得率进行分析和预测是可行的。模型的一次项A、B、C、AC和二次项A2、B2对多酚提取量的影响极显著(p<0.01);其他项对多酚提取量的影响不显著。其中各变量的一次项F值能很好地反应各因素(β-环糊精质量浓度、提取温度及提取时间)对多酚得率影响的大小,且F值越大说明对多酚提取率的影响越大[23],因此可知回归方程一次项系数表明影响因素的主次顺序为提取温度>β-环糊精质量浓度>提取时间。
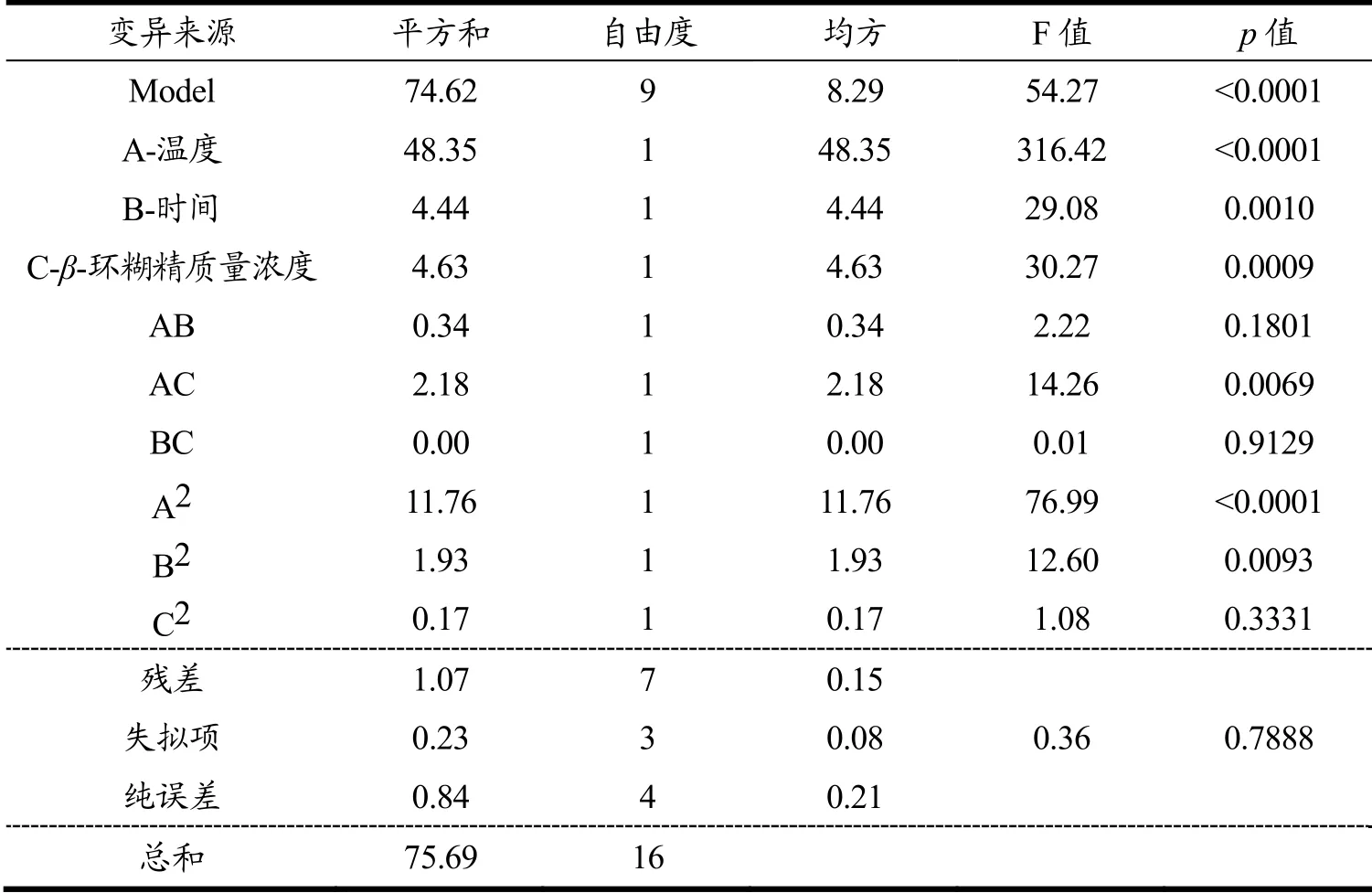
表3 回归模型方差分析Table 3 Analysis of variance of regression model
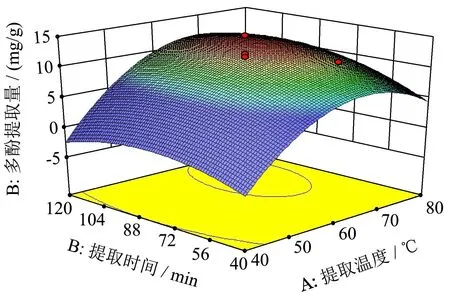
图5 提取温度和提取时间的响应面图Fig.5 The contour map of extraction temperature and extraction time

图6 提取温度和β-环糊精质量浓度的响应面图Fig.6 The contour map of extraction temperature and β-cyclodextrin mass concentration
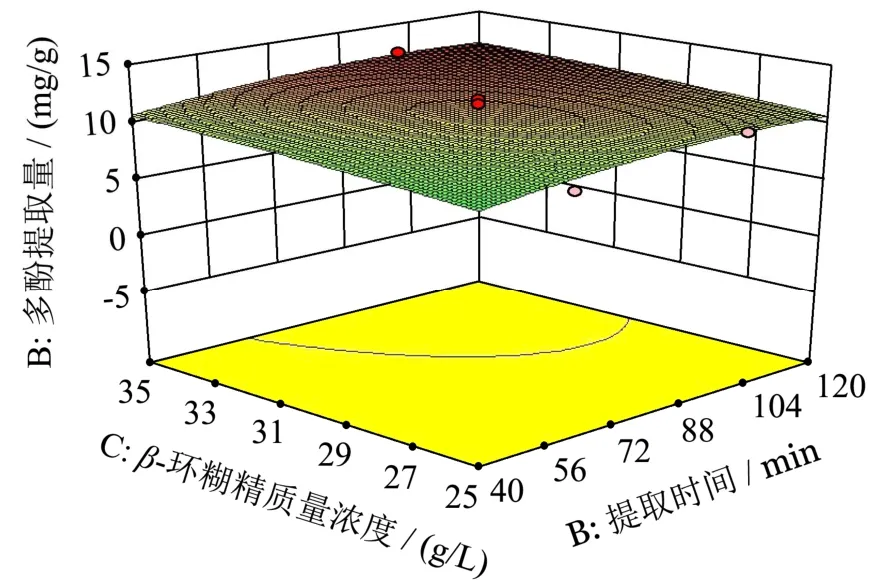
图7 提取时间和β-环糊精质量浓度的响应面图Fig.7 The contour map of extraction time and β- cyclodextrin mass concentration
2.3.2 两因素交互作用的分析
通过DesignExpert 8.0.6软件对回归结果做响应面,结果见图5~7。各图显示了β-环糊精质量浓度、提取温度和提取时间中任意1个变量处于零水平时,其余2个变量对多酚得率的影响。其中响应曲面的坡度反映出因素之间两两交互作用对响应值的影响,坡度越陡峭响应值越敏感[24]。
通过比较图5~图7可知,图形均成向上的凸状,其中提取温度和提取时间的交互作用对多酚提取量的影响最显著,表现为凸起形状最明显;β-环糊精质量浓度和提取时间的交互作用对多酚提取量最不显著,表现为图形最平缓;提取温度和β-环糊精质量浓度影响程度位于两者之间。
2.3.3 最佳提取条件的确定和模型的验证试验
由Design-Expert 8.0.6分析回归模型,得到黑果腺肋花楸多酚的提取最佳条件为提取温度66.44 ℃、提取时间93.55 min、β-环糊精质量浓度33.42 g/L。考虑到实际操作和仪器的便利性,将总多酚的最佳提取条件修正提取温度66 ℃、提取时间93 min、β-环糊精质量浓度33 g/L。在上述条件下,进行三次验证性试验,实际测定值与理论预测值的相对误差为0.96%,说明试验结果与模型拟合良好,利用响应面法优化β-环糊精辅助提取黑果腺肋花楸中多酚的工艺条件结果准确。
2.3.4 不同提取方法对多酚提取率的影响
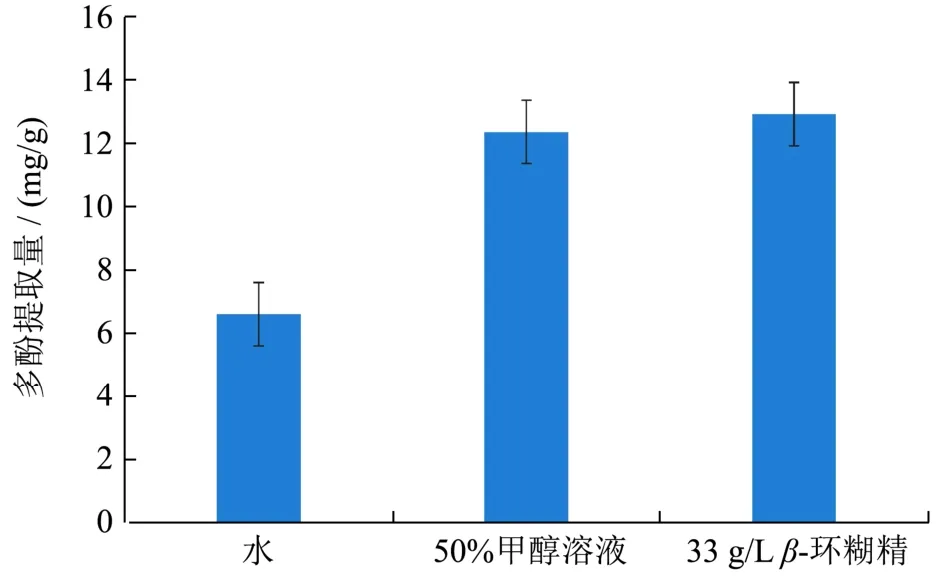
图8 不同提取剂的多酚提取量比较Fig.8 Comparison of the extraction amount of polyphenols with different extractants
在最佳工艺条件下:提取温度66 ℃、提取时间93 min、β-环糊精质量浓度33 g/L,比较3种不同提取剂对多酚提取率的影响,试验结果见图8。由图8可知,β-环糊精对黑果花楸中多酚的提取量最大,为12.93 mg/g,50%甲醇溶液提取所得的多酚量次之,为12.37 mg/g,而水作为提取剂所得多酚提取量最小,为6.61 mg/g。β-环糊精可使多酚提取量提高,主要是由于在提取过程中,β-环糊精与多酚形成的包合物,增加了多酚的溶解度以及溶出的速度[25]。表明与传统提取法比较,β-环糊精辅助法提取的黑果腺肋花楸中多酚提取量有所提高。
2.4 HPLC分析

图9 样品280 nm色谱图Fig.9 Sample 280 nm chromatogram
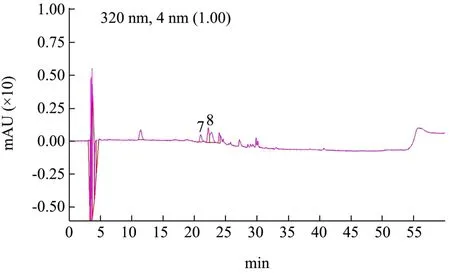
图10 样品320 nm色谱图Fig.10 Sample 320 nm chromatogram

表4 黑果腺肋花楸中各类多酚组分分析Table 4 Analysis of various polyphenols in Aronia melanocarpa
在β-环糊精辅助提取多酚的最佳工艺条件下,提取黑果腺肋花楸中多酚,得到多酚甲醇溶液,过0.45 μm滤膜后,进行液相分析得到样品图,如图9和图10所示,通过与标准品色谱图进行对比,可以得出样品中的多酚有:香草酸、表儿茶素、阿魏酸、绿原酸及咖啡酸,从表4中可知它们的含量分别为:239.80 μg/g、613.00 μg/g、17.48 μg/g、30.93 μg/g和16.11 μg/g。
3 结论
本试验通过单因素(β-环糊精浓度、提取温度和提取时间)和响应面优化试验获得了β-环糊精辅助提取黑果腺肋花楸中多酚最佳工艺参数,再对β-环糊精辅助提取所得黑果腺肋花楸多酚提取液进行HPLC分析。试验结果表明:3个因素影响多酚提取的主次顺序为提取温度>β-环糊精质量浓度>提取时间;β-环糊精辅助提取黑果腺肋花楸中多酚的最佳工艺参数是提取温度66 ℃、提取时间93 min、β-环糊精浓度33 g/L,在该条件下,多酚提取量为12.93 mg/g;对β-环糊精辅助提取所得黑果腺肋花楸多酚提取液进行HPLC分析,结果显示提取液中含有的多酚种类有香草酸、表儿茶素、阿魏酸、绿原酸及咖啡酸,它们的含量分别为239.80 μg/g、613.00 μg/g、17.48 μg/g、30.93 μg/g和16.11 μg/g。本研究为β-环糊精辅助提取黑果腺肋花楸中多酚类物质和黑果腺肋花楸的开发利用提供了理论依据,但本文中所作研究均来自同一产地同一品种同一批次的黑果腺肋花楸,今后可在本研究的基础上,对不同品种不同产地黑果腺肋花楸多酚的种类、提取量和提取条件进行比较性研究。
