玻璃体腔注射康柏西普联合PPV治疗增殖型糖尿病视网膜病变
2021-06-04欧舟,王沁,蒋洁,刘曦
欧 舟,王 沁,蒋 洁,刘 曦
0引言
增殖型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)为糖尿病视网膜病变(diabetic retinopathy,DR)晚期表现,属糖尿病常见眼部严重并发症之一,是导致患者视力下降,甚至致盲的重要原因[1]。PDR增生早期可通过全视网膜激光光凝术控制眼内新生血管增生,但晚期PDR常并发玻璃体积血或新生血管膜,需行玻璃体切割术治疗,但该术式操作过程中出血多可能影响手术视野,延长手术时间,增加并发症,影响术后恢复[2]。近年来越来越多研究认为,血管内皮生长因子(vascular endothelial growth factor,VEGF)可通过促内皮细胞增殖、迁移,提升血管通透性等途径参与PDR新生血管增殖过程,导致PDR进展,建议应用抗VEGF药物控制新生血管性眼病进展[3]。但有报道认为,常规抗VEGF药物如贝伐单抗、雷珠单抗等在抑制视网膜及脉络膜新生血管生成的同时可能存在一定的毒性反应,影响视网膜光感受器功能[4]。而康柏西普为我国自主研发多靶点抗VEGF药物,较进口雷珠单抗、贝伐单抗价格低廉,经济性更高,更符合我国国情。已有报道证实,康柏西普可特异性与VEGF-A/B结合,抑制新生血管增殖,减轻出血及渗漏,降低玻璃体切割术难度[5]。但对其与玻璃体切割术联合对眼内VEGF相关因子的影响及其应用的安全性尚缺乏系统化报道。为进一步验证玻璃体腔内注射康柏西普用于PDR治疗的价值,现对我院收治的PDR患者64例75眼分别采用单纯玻璃体切割术及其术前联合玻璃体腔注射康柏西普治疗,观察最佳矫正视力(best corrected visual acuity,BCVA)、黄斑中心凹厚度(central macular thickness,CMT)、房水中VEGF相关因子变化、术中情况及术后恢复等方面探讨玻璃体切割术前玻璃体腔注射康柏西普的价值,以期为PDR治疗提供参考。
1对象和方法
1.1对象前瞻性研究。选取2016-01/2019-10我院收治的PDR患者64例75眼。纳入标准:(1)年龄>18岁;(2)依据我国糖尿病视网膜病变临床诊疗指南(2014年)确诊为PDR[6];(3)经散瞳后眼底检查确诊;(4)伴明显视力降低;(5)DR分期Ⅴ期,拟行玻璃体切割术治疗;(6)入组前未接受手术或抗VEGF药物治疗;(7)眼压、屈光介质正常;(8)已签署知情同意书。排除标准:(1)急慢性感染;(2)合并严重白内障、青光眼、高眼压、角膜病、息肉样视网膜脉络膜血管病变等其他眼部疾病患者;(3)严重心肝肾肺功能不全;(4)严重脑血管疾病;(5)精神疾病;(6)孕期或哺乳期女性;(7)自身免疫性疾病;(8)全身恶性肿瘤;(9)无法控制高血压;(10)长期抗凝药物服用史;(11)过敏体质。本研究通过医院伦理委员会审查通过。
1.2方法两组患者术前均完善视力、裂隙灯显微镜、房角镜、眼部B超、眼压、荧光素血管造影等眼科检查。并检查血糖,术前控制血糖至正常范围(空腹血糖<7mmol/L,餐后血糖<9.0mmol/L)。两组患者均由同一手术团队完成手术治疗。观察组采用玻璃体切割术联合术前玻璃体腔注射康柏西普治疗。术前5d术眼点左氧氟沙星滴眼液,4次/天。玻璃体腔注射康柏西普治疗:患者仰卧位,消毒铺巾,盐酸奥布卡因滴眼液点眼,表面麻醉,指导患者鼻上方注视,勿转动眼球,注射针抽取康柏西普0.05mL(0.5mg),垂直眼球壁,自颞下方角巩膜缘后侧约3.5mm处倾斜刺入巩膜,进入玻璃体腔,避免损伤晶状体,确定针头刺入玻璃体腔后,缓慢注入康柏西普0.05mL,结束后缓慢退针,无菌棉球按压穿刺部位避免药液反流,结膜囊涂妥布霉素地塞米松眼膏,包扎术眼。术后妥布霉素地塞米松滴眼液点眼,4次/天,连续5d。出现高眼压者适当予降眼压药物控制眼压。玻璃体腔注射康柏西普5d后行玻璃体切割术,布比卡因(0.75%)+利多卡因(2%)3mL球后、球旁、结膜下浸润麻醉,经睫状体扁平部行标准三通道玻璃体切割术,接灌注,导入导光纤维、玻璃体切割头,2500r/min速率切割玻璃体,清除前部、套管周边及基底部玻璃体和血性玻璃体液,23G眼内镊与玻璃体切割口配合剥离纤维增殖膜,彻底剥除视盘纤维血管黏连,玻璃体切割头切割致密大片黏连视网膜前膜,眼内镊剥除纤维增生膜,合并视网膜下增殖膜者电凝血管后切开周边视网膜,眼内镊游离纤维膜并取出,切开处配合激光光凝,轻微出血者常规压迫止血或适当提高灌注压,反复出血者电凝止血;依据眼底情况选择是否行眼内激光光凝[7],气液交换,玻璃体腔填充惰性气体或硅油,术毕结膜囊涂妥布霉素地塞米松眼膏,左氧氟沙星滴眼液点眼,包扎术眼。对照组仅行玻璃体切割术治疗,手术方法同观察组。
观察指标:(1)BCVA:两组患者均于术前,术后1wk,1、3mo检测BCVA(LogMAR);(2)CMT:术前、术后3mo采用光学相干断层扫描仪测定CMT,重复检测3次,取平均值;(3)实验室指标:观察组患者于玻璃体腔注射康柏西普前、注药5d后行玻璃体切割术时采集房水标本,对照组于入院散瞳检查眼底时及行玻璃体切割术时采集房水标本0.1mL,采用酶联免疫吸附试验法测定VEGF、胎盘生长因子(placental growth factor,PIGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)浓度,VEGF酶联免疫吸附试验试剂盒购自武汉博士德生物工程有限公司,人PIGF及bFGF酶联免疫吸附试验试剂盒均购自美国Sigma公司,抗人VEGF/PIGF/bFGF单克隆抗体包被至酶标板,孔板加入样品与标准品,滴加生物素化抗VEGF/PIGF/bFGF抗体,洗涤液洗涤后甩净,滴加亲和素-过氧化酶复合物,洗涤,滴加显色液显色,过氧化物酶催化。Epoch型酶标仪(美国Biotek公司)于450nm波长处测定各孔吸光度值,绘制标准曲线,计算VEGF、PIGF、bFGF浓度。(4)记录两组患者手术时间、术中出血量、术后视网膜水肿、眼底出血等症状改善时间及渗出吸收时间。(5)记录两组患者术后3mo内并发症发生情况。
2结果
2.1两组患者术前基本资料比较按照随机数字表法分为观察组32例38眼采用玻璃体切割术联合玻璃体腔注射康柏西普治疗与对照组32例37眼采用单纯玻璃体切割术治疗。两组患者术前基本资料比较差异无统计学意义(P>0.05,表1)。两组患者随访至术后3mo,无失访及脱落病例。

表1 两组患者术前基本资料比较
2.2两组患者术中情况比较观察组术中使用电凝20眼(53%);对照组术中电凝26眼(70%),两组患者术中电凝使用情况比较差异无统计学意义(χ2=2.459,P=0.117)。
2.3两组患者手术前后BCVA比较两组患者手术前后BCVA比较差异有统计学意义(F组间=93.542,P组间<0.001;F时间=67.039,P时间<0.001;F交互=40.467,P交互<0.001)。两组患者术前BCVA比较差异无统计学意义(P>0.05),术后不同时间两组患者BCVA均较术前改善,差异有统计学意义(P<0.05),观察组术后不同时间BCVA优于对照组,差异有统计学意义(P<0.05),见表2。
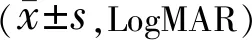
表2 两组患者手术前后BCVA比较
2.4两组患者手术前后CMT比较两组患者术前CMT比较差异无统计学意义(P>0.05),术后3mo两组患者CMT均较同组术前降低,差异有统计学意义(P<0.001),观察组术后3mo CMT低于对照组,差异有统计学意义(P<0.001,表3)。
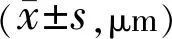
表3 两组患者手术前后CMT比较
2.5两组患者实验室指标比较两组患者房水基线VEGF、PIGF、bFGF比较差异无统计学意义(P>0.05),术前观察组VEGF、PIGF、bFGF低于对照组,差异有统计学意义(P<0.001,表4)。

表4 两组患者实验室指标比较
2.6两组患者术中及术后恢复情况比较观察组患者手术时间短于对照组,术中出血量少于对照组,差异均有统计学意义(P<0.001),观察组视网膜水肿吸收时间、眼底出血吸收时间及渗出吸收时间均短于对照组,差异有统计学意义(P<0.05,表5)。

表5 两组患者术中及术后恢复情况比较
2.7两组患者并发症发生率比较两组患者术后出现术后一过性高眼压酌情予降压药物后改善;玻璃体出血者予口服化瘀药物治疗后出血吸收;新生血管性青光眼行抗青光眼手术治疗后好转;视网膜纤维增殖取出眼内填充物后改善。观察组总并发症发生率低于对照组,差异有统计学意义(P<0.05,表6)。

表6 两组患者并发症发生率比较 眼(%)
3讨论
PDR为糖尿病微血管并发症之一,统计报道糖尿病患者5a内DR发生率超过40%,其中有较大一部分患者进展为PDR,影响患者视力,增加致盲风险[8]。多项研究证实,新生血管生成与PDR发生密切相关[9-10]。正常生理条件下,眼内血管内皮细胞、视网膜色素上皮细胞及神经胶质细胞均可合成及释放VEGF,维持眼部血管正常发育。糖尿病持续高血糖状态下,VEGF释放增多,提升血管通透性,导致内皮细胞增殖,提升内皮细胞对葡萄糖转运活性,诱导新生血管生成;同时可通过激活蛋白激酶C等途径破坏血-视网膜屏障,导致视网膜缺血、缺氧损伤,VEGF异常释放,诱导新生血管生成,导致DR发生及进展[11-12]。此类患者常因视网膜纤维增殖、玻璃体出血等导致视力下降,严重者可能失明[13]。玻璃体切割术是治疗纤维增生及增生晚期PDR的常用手段,其中23G微创玻璃体切割术仍为主流术式,可减少牵拉损伤,降低医源性裂孔发生,同时手术灵活性高、切口小、损伤小[14]。但PDR大多眼底情况复杂,即便通过玻璃体切割或全视网膜光凝仍有部分新生血管继续发展,导致复发或反复玻璃体出血,影响预后[15]。故多主张先行抗VEGF治疗消退新生血管后再行玻璃体切割术。
前期有研究发现,PDR围术期抗VEGF治疗可降低术中出血,改善手术视野,降低手术难度,促进视力恢复[16]。但以往抗VEGF药物选择多为进口贝伐单抗、雷珠单抗等,费用高,且存在一定的毒副反应。本研究中,对照组仅应用玻璃体切割术,观察组术前玻璃体腔注射康柏西普治疗,结果发现观察组术中电凝使用率低于对照组,且术后不同时间BCVA改善情况优于对照组,同时术后3mo CMT显著低于对照组,获得与上述研究围术期应用进口抗VEGF药物基本一致的结论,术前玻璃体腔注射康柏西普较单纯应用玻璃体切割术治疗更利于PDR患者术后视力改善,有助于减轻黄斑水肿。考虑机制为:术前玻璃体腔注射康柏西普可通过VEGF-A/B及PIGF多靶点拮抗VEGF生成,抑制玻璃体内VEGF表达及活性,消退PDR眼部新生血管,降低血管通透性,减少黄斑区血管渗漏,抑制新生血管生成,减少术中出血,降低术中新生血管膜剥离难度,避免术中反复止血,电凝或交换器械,有助于彻底清除玻璃体积血,促进黄斑水肿消退,降低CMT,减少其对视神经破坏,促进视力改善。
VEGF是目前公认最强促血管生成因子,PIGF为VEGF家族成员之一,属分泌型二聚体糖蛋白,与VEGF氨基酸序列同源性较高,早期促血管生成作用不被重视[17]。近年来发现,PIGF具多种生物学功能,可诱导内皮细胞增殖,调节其活性,刺激新生血管生成,促进内皮细胞及单核细胞增殖及迁移,提升血管通透性[18]。动物试验发现,PIGF过表达可诱导病理性新生血管生成,增加血管渗漏[19]。但对不同程度糖尿病视网膜病变患者房水内PIGF表达尚未确立统一意见,国内对PDR眼内PIGF水平的报道也相对少见。本研究发现,两组基线VEGF、PIGF均处于较高水平,支撑以上结论及前期相关报道[20-21]提出的VEGF可能参与PDR视网膜新生血管形成的结论,同时本研究还发现PIGF同样与PDR新生血管增殖及血管渗漏有关,且与组织缺氧、缺血程度密切相关,为本研究的创新点。bFGF又称肝磷脂结合生长因子,参与内皮细胞有丝分离及趋化、迁移过程,介导基底膜破坏及新生血管形成过程,与VEGF存在类似生物学功能,近年来发现与DR视网膜新生血管生成有关[22]。本研究发现基线时PDR眼内bFGF浓度上升。而观察组经玻璃体腔注射康柏西普治疗5d后眼内VEGF、PIGF、bFGF浓度明显下降,对照组无任何改善,说明术前辅助应用康柏西普抗VEGF治疗可通过抑制促血管内皮生成因子VEGF、PIGF及bFGF生成,减轻脉络膜血管扩张,消退新生血管,降低血管通透性,阻断血管内皮异常增殖,降低视网膜脉络膜厚度,减轻组织缺氧、缺血,改善视网膜微循环,可为玻璃体切割术奠定良好的基础。但受伦理因素制约,本研究未能获取术后眼内VEGF、PIGF、bFGF的变化数据,尚有一定的局限,有待后续丰富结论后补充。
此外,本研究还发现,观察组手术时间较对照组短,术中出血较对照组少,视网膜水肿吸收时间、眼底出血吸收时间及渗出吸收时间均短于对照组,与文晓霞等[23]结论,证明术前玻璃体腔注射康柏西普可加快眼底渗出及出血吸收,可能与康柏西普可通过抑制PIGF、VEGF所诱导VEGF受体激活,抑制新生血管增生,促使增殖膜变薄,降低玻璃体切割术复杂程度,从而减少手术出血,优化视野,术中无需反复切割增殖膜,进而可缩短手术时间,促进视网膜水肿吸收,减少血管渗漏,促进术后恢复有关。在安全性方面,本研究发现,观察组总并发症发生率较对照组低,突出表现在玻璃体出血率降低方面,考虑仅行玻璃体切割术可能由于术中新生血管止血不彻底,导致纤维血管膜残端或基底部渗血,受炎症刺激,导致血管通透性提升,引起新生血管再次破裂出血[24]。相对而言,术前玻璃体腔注射康柏西普治疗可消退新生血管,减少手术出血,降低术后玻璃体出血风险。
综上,本研究采用术前玻璃体腔注射康柏西普联合玻璃体切割术治疗PDR可降低促血管生成因子VEGF、PIGF、bFGF浓度,抑制新生血管生成,改善视力,促进黄斑水肿吸收,促进视网膜水肿、出血及渗出吸收,减少并发症。且康柏西普价格较进口抗VEGF药物低廉,更能被患者接受。但本研究样本量少,且未能观察术后眼内促血管生成因子的变化,尚存在一定的局限,有待后期扩充样本量、并收集术后促血管生成因子变化数据进一步充实结论。
