miR-146b对急性呼吸窘迫综合征大鼠肺组织中ICAM-1表达的调控作用
2021-06-04龙光文杨秀林吉春玲董裕康
龙光文,张 谦,杨秀林,吉春玲,董裕康
(贵州省人民医院急诊内科,贵州 贵阳550002)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是重症监护病房患者常见的急性肺损伤并发症,可引起严重的全身炎症并导致多器官功能障碍和高死亡率[1]。目前,开发新的治疗方法加强肺修复仍是治疗该病的关键。微小RNA(microRNAs,miRNAs)作为非编码微小单链RNA分子,参与呼吸系统的疾病进展过程[2]。miR-146b通过抑制MyD88/NF-κB信号通路减轻肺炎患儿肺组织的炎症损伤[3]。miR-146b过度表达可有效改善脂多糖诱导的急性肺损伤[4],说明miR-146b对不同病因引起的肺组织损伤具有一定的治疗作用。此外,细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)作为一种细胞表面黏附受体,可促进受炎症过程影响的组织中多个效应器/靶细胞相互作用,参与ARDS疾病进程,并在ARDS患者血清中高表达[5]。在ARDS小鼠模型中,抑制ICAM-1表达有助于改善肺部炎 症[6]。研究[7]显示:miR-146抑制 剂对白细 胞 介 素1β(interleukin-1β,IL-1β) 诱 导 的ICAM-1表达具有明显促进作用,说明miR-146对炎症条件下ICAM-1表达具有一定的调控能力,但miR-146b是否通过调控ICAM-1表达缓解ARDS患者肺组织损伤尚未明确。本研究通过过表达miR-146b干预ARDS大鼠,检测其对肺组织中ICAM-1表达水平的影响,探讨miR-146b对ARDS大鼠肺组织损伤的作用,为ARDS的治疗提供潜在靶点。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器健康雄性8周龄SD大鼠60只,体质量220~250 g,购自贵州医科大学实验动物中心提供,实验动物生产许可证:SCXK(黔)2018-0001。HEK-293T细胞(美国保藏中心ATCC)。agomir-NC、miR-146b agomir、miR-146b mimic和mimic-NC(广州锐博生物科技有限公司),油酸(湖南长沙恒昌化工有限公司),转染试剂Lipofectamine 3000(美国Invitrogen公司),TRIzol试剂(上海晶抗生物工程有限公司),BCA蛋白质定量检测试剂盒和蛋白裂解液(上海碧云天生物技术有限公司),IL-1β、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(上海酶联生物科技有限公司),逆转录试剂盒和双荧光素酶报告基因检测试剂盒(美国Promega公司),实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(日本TaKaRa公司),兔抗鼠ICAM-1抗体和GAPDH抗体(英国Abcam公司)。血气分析仪(美国雅培公司),LightCycler480 RT-qPCR仪(瑞士Roche公司),电泳仪(美国Bio-Red公司),低温离心机(德国Eppendorf公司)。
1.2 动物模型构建参考文献[8]的方法,采用尾静脉注射油酸构建ARDS大鼠模型。所有大鼠术前禁食12 h,腹腔注射40 mg·kg-1戊巴比妥麻醉,尾静脉注射0.15 mL·kg-1油酸。6 h后大鼠呼吸频次增加,若动脉血液氧合指数(oxygenation index,OI)<200 mmHg,则表明造模成功。造模成功24 h后取材,进行各项指标检测。
1.3 实验分组和处理将大鼠分为假手术组、模型组、agomir阴性对照组和miR-146b agomir组。假手术组:大鼠麻醉后,尾静脉注射0.15 mL·kg-1生理盐水;模型组:大鼠麻醉后,尾静脉注射0.15 mL·kg-1油酸;agomir阴性对照组:大鼠麻醉后,在术前1 h,采用微量注射器经颈部气管注射50μL转染复合物agomir-NC,并将大鼠直立旋转,然后进行ARDS造模;miR-146b agomir组:与agomir阴性对照组相似,采用微量注射器经颈部气管注射50μL miR-146b agomir转染复合物,再进行ARDS造模。每组大鼠15只。
1.4 各组大鼠动脉血气指标检测取1 mL大鼠股动脉血,采用血气分析仪检测各组大鼠血氧分压(PaO2)和吸入氧浓度(FiO2),并计算OI,OI=PaO2/FiO2。
1.5 各组大鼠肺组织湿/干重(W/D)比值检测处死大鼠,开胸切除右肺中叶,称湿重。将切除的组织置于恒温干燥箱中48 h,待组织恒重后,称干重。肺组织W/D比值=湿重/干重。
1.6 ELISA法检测各组大鼠肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中IL-1β、IL-6和TNF-α水平处死大鼠,开胸结扎肺。取预冷的等渗生理盐水分3次灌洗左肺支气管肺泡,依次为2、2和1 mL,直到回收率达到85%以上。采用IL-1β、IL-6和TNF-α水平检测ELISA试剂盒检测各组大鼠BALF中IL-1β、IL-6和TNF-α水平。
1.7 HE染色观察各组大鼠肺组织病理形态表现处死大鼠,开胸切除右肺后叶,置于4%多聚甲醛中固定后,常规制成肺组织石蜡切片。将石蜡切片干燥、脱蜡后,进行HE染色。滴加适量苏木素染色5 min,蒸馏水冲洗,采用1%乙醇-盐酸分色30 s,加入伊红染色2 min,蒸馏水冲洗后,梯度浓度乙醇脱水,二甲苯透明后,采用中性树胶封固,最后采用光学显微镜观察各组大鼠肺组织病理形态表现。
1.8 RT-qPCR法检测各组大鼠肺组织中miR-146b和ICAM-1 mRNA表达水平取各组大鼠肺左叶部分,采用TRIzol法提取组织中总RNA。根据逆转录试剂盒操作说明将提取的RNA逆转录成cDNA。根据荧光定量试剂盒操作说明,取1μL cDNA为模板进行荧光定量扩增。miR-146b上游引物 为 5′-ATGCGCGCTGAGAACTGAATT-3′,miR-146b下游引物为5′-CAGTGCAGGGTCCGAGGT-3′;ICAM-1上游引物为5′-GTGATGCTCAGGTATCCATCCA-3′,下 游 引 物 为5′-CACAGTTCTCAAAGCACAGCG-3′;GAPDH上 游引 物 为5′-AACGGATTTGGTCGTATTG-3′,下游 引 物 为5′-GGAAGATGGTGATGGG ATT-3′。反应条件:95℃、5 min,95℃、15 s,60℃、40 s,共40个循环,72℃、1 min。采用2-ΔΔCt法计算大鼠肺组织中miR-146b和ICAM-1 mRNA表达水平。
1.9 Western blotting法检测各组大鼠肺组织中ICAM-1蛋白表达水平取各组大鼠肺左叶部分提取总蛋白。加入1 mL预冷的裂解液,快速匀浆后,4℃、12 000 r·min-1离心3 min。取少量上清液,BCA检测蛋白浓度。进行SDS-聚丙烯酰胺凝胶电泳分离蛋白,待完成电泳后,湿转法将蛋白质转移到聚偏二氟乙烯膜(polyvinylidene difluoride,PVDF)上。室温下用5%脱脂奶粉封闭1 h,采用含Tween20的Tris-HCl缓冲盐溶液洗涤3次,再加入一抗ICAM-1(1∶5 000)和GAPDH(1∶2 500),4℃孵育过夜,采用TBST溶液冲洗PVDF膜3次,室温下用辣根过氧化物酶标记的二抗孵育1 h,TBST溶液洗涤3次。加入ECL化学发光液进行蛋白条带显像,以GAPDH作内参蛋白,采用Image J软件对蛋白灰度值进行分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.10 双荧光素酶报告系统检测miR-146b和ICAM-1的靶向关系采用Targetscan(http://www.targetscan.org)网站预测miR-146b和ICAM-1的靶向关系和碱基互补序列(3′-UTR)。合成含miR-146b结合位点的ICAM-1 3′-UTR序列,构建野生型ICAM-1 3′-UTR荧光素酶报告基因质粒(WT-ICAM-1)。同时,根据ICAM-1 3′UTR构建突变型ICAM-1 3′UTR荧光素酶报告基因质粒(MUT-ICAM-1)。将人HEK-293T细胞以1×104个/孔接种于96孔板上,达到60%汇合。将WT-ICAM-1和MUT-ICAM-1荧光素酶报告基因质粒分别与miR-146b mimic或mimic NC共转染至HEK-293T细胞中,作为miR-146b mimic组和mimic NC组。转染48 h后收集2组细胞,检测2组HEK-293T细胞中相对荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性/肾素荧光素酶活性。1.11 统计学分析 采用SPSS 22.0统计软件进行统计学分析。各组大鼠动脉PaO2和OI、肺组织W/D比值、肺泡灌洗液中IL-1β、IL-6和TNF-α水平、肺组织中miR-146b和ICAM-1 mRNA及蛋白表达水平以及HEK-293T细胞中相对荧光素酶活性均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠动脉血气指标和肺组织W/D比值与假手术组比较,模型组和agomir阴性对照组大鼠动脉血气PaO2和OI值均明显降低(P<0.01),肺组织W/D比值明显升高(P<0.01);与模型组和agomir阴性对照组比较,miR-146b agomir组大鼠动脉血气PaO2和OI均明显升高(P<0.01),肺组织W/D比值明显降低(P<0.01)。见表1。
表1 各组大鼠PaO2、OI和肺组织W/D比值Tab.1 PaO2 and OI and ratios of W/D in lung tissue of rats in various groups (n=15,±s)

表1 各组大鼠PaO2、OI和肺组织W/D比值Tab.1 PaO2 and OI and ratios of W/D in lung tissue of rats in various groups (n=15,±s)
*P<0.01 compared with sham operation group;△P<0.01 compared with model group;#P<0.01 compared with agomir negative control group.
Group Sham operation Model Agomir negative control MiR-146b agomir PaO 2(P/mmHg)102.00±10.00 58.00±7.00*61.00±6.00*75.00±9.00△#OI(P/mmHg)533.00±39.00 312.00±25.00*337.00±41.00*465.00±27.00△#Ratio of W/D 3.82±0.41 6.35±0.28*6.47±0.52*4.56±0.65△#
2.2 各组大鼠BALF中IL-1β、IL-6和TNF-α水平与假手术组比较,模型组大鼠BALF中IL-1β、IL-6和TNF-α水平均明显升高(P<0.01);与模型组和agomir阴性对照组比较,miR-146b agomir组大鼠BALF中IL-1β、IL-6和TNF-α水平均明显降低(P<0.05或P<0.01)。见表2。
2.3 各组大鼠肺组织病理形态表现假手术组大鼠肺组织无明显损伤。模型组和agomir阴性对照组大鼠肺组织结构损坏,肺泡腔出血,肺泡壁增厚,嗜中性粒细胞聚集,红细胞渗出。与模型组和agomir阴性对照组比较,miR-146b agomir组大鼠的肺损伤情况得到明显缓解。见图1。
2.4 各组大鼠肺组织中miR-146b和ICAM-1 mRNA和蛋白表达水平与假手术组比较,模型组大鼠肺组织中miR-146b表达水平明显降低(P<0.01),ICAM-1 mRNA和蛋白表达水平均明显升高(P<0.01);与模型组和agomir阴性对照组比较,miR-146b agomir组大鼠肺组织中miR-146b表达水平明显升高(P<0.05),ICAM-1 mRNA和蛋白表达水平均明显降低(P<0.01)。见图2~4。
表2 各组大鼠BALF中IL-1β、IL-6和TNF-α水平Tab.2 IL-1β,IL-6,and T NF-αlevels in BALF of rats in various groups [n=5,±s,ρB/(ng·L−1)]

表2 各组大鼠BALF中IL-1β、IL-6和TNF-α水平Tab.2 IL-1β,IL-6,and T NF-αlevels in BALF of rats in various groups [n=5,±s,ρB/(ng·L−1)]
*P<0.01 compared with sham operation group;△P<0.01 compared with model group;#P<0.05,##P<0.01 compared with agomir negative control group.
Group Sham operation Model Agomir negative control MiR-146b agomir IL-1β 35.06±7.54 71.32±8.43*71.60±6.11*50.08±5.29△##IL-6 41.28±4.92 63.07±5.88*62.84±6.01*53.93±5.14△#TNF-α 60.12±6.83 113.58±10.20*109.64±11.36*81.05±7.55△##
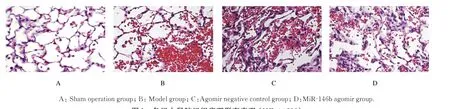
图1 各组大鼠肺组织病理形态表现(HE,×200)Fig.1 Pathomorphology of lung tissue of rats in various groups(HE,×200)
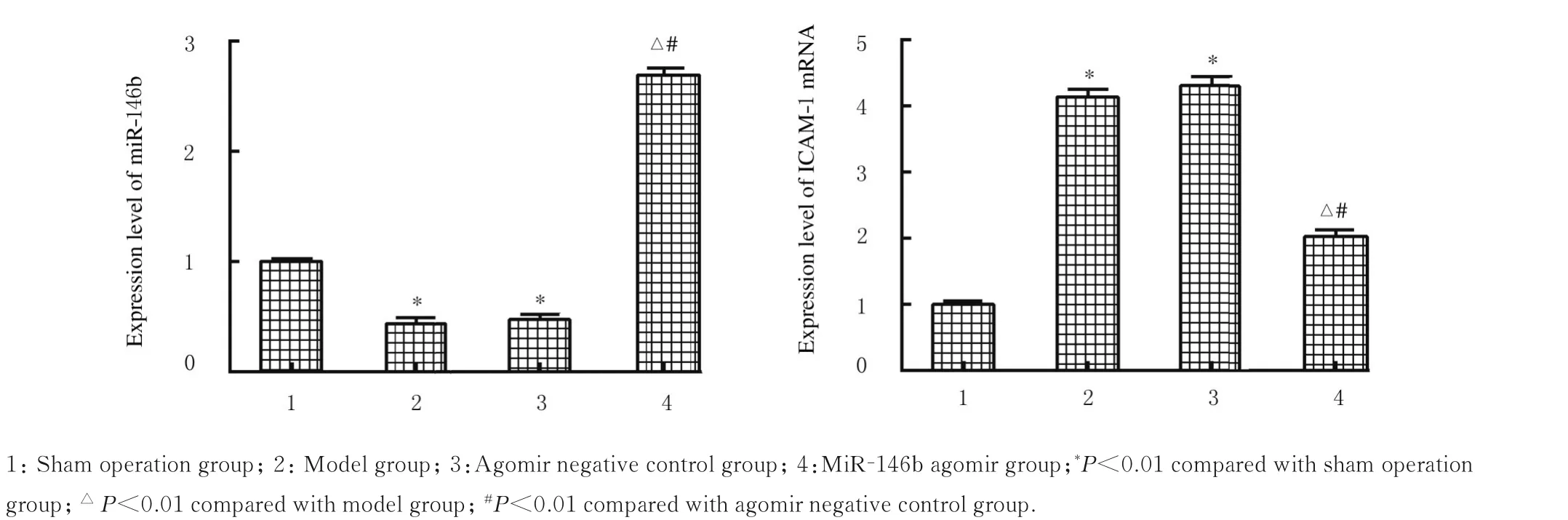
图2 各组大鼠肺组织中miR-146b和ICAM-1 mRNA表达水平Fig.2 Expression levels of miR-146b and ICAM-1 mRNA in lung tissue of rats in various groups
2.5 miR-146b和ICAM-1的靶向关系根据Targetscan预测的miR-146b-3p与ICAM-1基因3′-UTR区的靶向结合位点,采用双荧光素酶基因报告系统验证。在转染了WT-ICAM-1的HEK-293T细胞中,与mimic NC组比较,miR-146b mimic组HEK-293T细胞中的相对荧光素酶活性明显降低(P<0.01);而在转染了MUT-ICAM-1的HEK-293T细胞中,与mimic NC组比较,miR-146b mimic组HEK-293T细胞中的相对荧光素酶活性无明显变化(P>0.05)。见图5和6。
3 讨 论
ARDS是一种多因素疾病,能引起危重患者呼吸衰竭,是急性肺损伤的严重表现[9-10]。ARDS可由肺直接或间接损伤引起,包括败血症、肺炎、胃内容物吸入和严重创伤[1]。肺损伤主要由中性粒细胞依赖性损伤肺内皮和上皮细胞屏障引起,以肺水肿、严重通气障碍和肺部炎症为特征[11]。研究[12]显示:在脂多糖诱导的ARDS大鼠中,脂多糖诱发的炎症反应能破坏肺泡腔的上皮细胞和内皮细胞,引起血管内液体渗漏至肺泡腔,诱发肺水肿,导致肺泡与血管之间的气体交换障碍,最终导致呼吸衰竭。本研究结果表明:与假手术组大鼠比较,尾静脉注射油酸诱导的ARDS大鼠动脉血PaO2和OI均明显降低,肺组织W/D比值、BALF中IL-1β、IL-6和TNF-α水平明显升高,并且肺组织结构损坏,肺泡壁增厚,大量红细胞渗漏,说明ARDS大鼠模型构建成功。

图3 各组大鼠肺组织中ICAM-1蛋白表达电泳图Fig.3 Electrophoregram of expressions of ICAM-1 protein in lung tissue of rats in various groups

图4 各组大鼠肺组织中ICAM-1蛋白表达水平Fig.4 Expression levels of ICAM-1 protein in lung tissue of rats in various groups
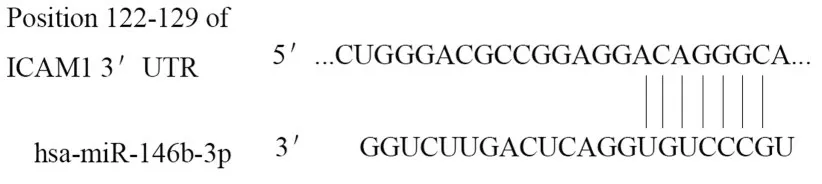
图5 miR-146b-3p与ICAM-1基因3′-UTR区的靶向结合位点Fig.5 Targeted binding sites of miR-146b-3p and 3′-UTR region of ICAM-1 gene

图6 转染WT-ICAM-1和MUT-ICAM-1的HEK-293T细胞中相对荧光素酶活性Fig.6 Relative luciferase activities of HEK-293T cells after transfected with WT-ICAM-1 and MUTICAM-1
miR-146b是miR-146家族的一员,位于人类染色体10q24.32上。研究[13-15]显示:miR-146b高度参与炎症调节。miR-146b在脓毒症ARDS患者中异常低表达,且是独立预测ARDS的危险性的关键因子,可作为脓毒症ARDS预防和预后判断的潜在生物标志物[16]。miR-146b-3p过表达通过抑制PI3K/AKT信号通路降低ARDS小鼠炎症反应,改善脓毒症小鼠ARDS[17]。本研究结果显示:在油酸诱导的ARDS大鼠中,miR-146b异常低表达,miR-146b过表达后,ARDS大鼠的肺损伤情况减轻,BALF中炎症因子水平均明显降低,说明miR-146b对油酸诱导的ARDS大鼠也具有肺保护作用,提示miR-146b可能通过抑制炎症反应缓解油酸诱导的ARDS肺损伤,但其分子机制尚不清楚。
ICAM-1是一种细胞表面糖蛋白,在中性粒细胞流入肺组织的过程中起重要调控作用。在TNF-α的刺激下,ICAM-1基因敲除小鼠肺血管通透性和中性粒细胞计数均降低70%以上[18]。此外,阻断肺组织中ICAM-1的表达可以通过减少中性粒细胞、降低微血管通透性,进而减轻饮食低胆碱/乙硫氨酸诱导的胰腺炎肺损伤[19]。ICAM-1在肝切除术后的肝再生过程中可诱导促炎因子IL-6和TNF-α的产生[20],上述研究表明:ICAM-1高度参与机体炎症因子的调控,并与炎症因子诱导的肺损伤有关。另外,抑制ICAM-1有助于保护肺微血管内皮屏障对抗LPS诱导的ARDS[21],表明ICAM-1也是一种用于评估ARDS严重程度和预后的生物标志物。本研究结果显示:ARDS大鼠肺组织中ICAM-1 mRNA和蛋白表达水平明显升高,经miR-146b过表达干预后,ARDS大鼠肺组织中ICAM-1表达水平明显降低。关于miR-146b和ICAM-1的研究[7]显示:抑制miR-146表达能明显促进炎症因子诱导的人脐静脉内皮细胞ICAM-1蛋白表达,说明在炎症条件下,miR-146与ICAM-1的表达呈负相关关系。为了验证两者的作用关系,本研究采用双荧光素酶基因报告系统验证了miR-146b能靶向负调控ICAM-1基因,说明miR-146b可能通过靶向负调控ICAM-1的表达,进而有效缓解ARDS大鼠肺损伤。
综上所述,miR-146b过表达可通过靶向下调ICAM-1的表达抑制炎症因子的表达水平,减轻ARDS大鼠肺损伤,本研究结果初步阐明miR-146b/ICAM-1信号转导可能是ARDS肺损伤进展过程中的重要途径之一。后续将进一步研究miR-146b/ICAM-1与上下游关键因子之间的相互作用,以充分阐明miR-146b/ICAM-1在ARDS中的具体作用机制。
