mTOR磷酸化水平对成骨MC3T3E1细胞增殖、自噬和分化的作用及其机制
2021-06-04李希宁沈哲源豆晓杰闵继康
李希宁,翁 伟,沈哲源,豆晓杰,赵 宇,闵继康
(1.湖州师范学院医学院病理学教研室,浙江 湖州313000;2.湖州师范学院附属第一医院骨科,浙江 湖州313000)
骨质疏松症已经成为许多国家的主要公共卫生问题,具有潜在的发生严重骨折的风险,并且其患病率随着人口老龄化的增长而增加[1]。成骨细胞是负责骨形成过程的功能细胞,越来越多的研究[2-3]显示成骨细胞功能障碍是骨质疏松的主要原因。目前预防和治疗骨质疏松症的药物主要关注点在促进成骨细胞的增殖和分化。哺乳动物雷帕霉素靶分子(mammalian target of rapamycin,mTOR)是一个高度保守的激酶,属于磷脂酰肌醇-3激酶(phosphotylinosital-3 kinase,PI3K) 家 族 的 一员[4]。雷帕霉素(rapamycin,RAPA)是mTOR通路的抑制剂,也是自噬的激活剂,其具有细胞保护作用,与细胞的生长、增殖和分化等密切相关[5]。RAPA对mTOR的抑制作用在体外可损伤小鼠骨髓基质细胞(bone marrow mesenchymal stem cells,BMSCs)的增殖和成骨分化,并可导致小梁状骨的丢失[6]。相反,激活mTOR信号通路可以促进BMSCs向成骨细胞方向分化[7-8]。RAPA通过药理作用抑制mTOR信号明显阻止Wnt7b诱导的小鼠ST 2细胞分化,而Raptor的遗传缺失减轻了Wnt7b诱导的小鼠高骨量表型,表明Wnt7b通过激活mTOR促进骨形成[9-10],其机制可能为mTOR通过促进谷氨酰胺分解代谢和综合应激反应(integrated stress response,ISR)部分介导Wnt的成骨作用,进而诱导成骨细胞分化所必需的蛋白合成和相关基因的表达[11-13]。因此,mTOR似乎是多种骨合成信号下游的一个常见效应因子。虽然mTOR发挥其生物学功能的途径尚未完全清楚,但其激活mTOR被认为是改善细胞功能和机体健康的重要机制。本研究分别采用mTOR抑制剂和激活剂改变磷酸化mTOR(p-mTOR)水平,并采用分子生物学技术探讨p-mTOR水平的变化对成骨细胞增殖、自噬和分化功能的影响,为骨质疏松的防治策略提供新的理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠胚胎前体成骨MC3T 3-E1细胞(中国科学院细胞库)。α-MEM培养基(美国Gibco公司),二甲基亚砜(dimethyl sulfoxide,DMSO)、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、胰蛋白酶、0.2%茜素红S试剂盒、CCK-8试剂盒(北京索莱宝科技有限公司),表面活性剂聚乙二醇辛基苯基醚(TritonX-100,上海源叶生物科技有限公司),青、链霉素双抗混合液(南京凯基生物科技发展有限公司),胎牛血清(天津市灏洋生物制品科技有限责任公司),RAPA和MHY 1485(美国MCE公司),碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(南京建成生物工程研究所),细胞周期与细胞凋亡检测试剂盒(上海碧云天生物科技有限公司),电泳缓冲液、转移液、上样缓冲液、一抗稀释液和硝酸纤维素膜(NC膜)(深圳子科生物科技有限公司),mTOR、p-mTOR、ALP、Runt相关转录因子2(Runt-related transcription factor 2,Runx2)和成骨相关转录因子Osterix抗体(美国Abcam公司)。倒置显微镜和照相系统(日本Olympus公司),CO2细胞培养箱(美国Forma Scientific公司),流式细胞仪、实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)仪和酶标仪(美国ThermoFisher公司),细胞超声破碎仪(宁波新芝超声电子有限公司),凝胶电泳仪、电泳槽和转膜槽(美国Bio-Rad公司)。
1.2 细胞培养MC3T 3-E1细胞培养于α-MEM完全培养液中,并将其置于37℃、体积分数为5%CO2的培养箱里培养。每2~3 d更换1次培养液,当细胞密度铺满培养皿80%以上时,采用胰蛋白酶消化传代培养至对数生长期。将MC3T 3-E1细胞消化并按2×104个/孔的密度接种于96孔板和2×106个/孔接种于6孔板。
1.3 CCK-8法检测各组细胞增殖活性MC3T 3-E1细胞接种于96孔板2 d,RAPA浓度分别为0、10、20、40、60、80、100、120、140、160和180 nmol·L-1,MHY 1485浓 度 分 别 为0、0.5、1.0、1.5、2.0、4.0、6.0、8.0、10.0、12.0和20.0μmol·L-1,每组设5个复孔,培养结束时,每孔加入100μL CCK-8溶液,轻微振动混匀,37℃培养箱内孵育2 h,于酶标仪上检测450 nm时的吸光度(A)值,以A值代表细胞增殖活性。依据细胞增殖活性曲线的上升、峰值和下降变化趋势选取适宜浓度RAPA和MHY 1485处理成骨细胞进行后续实验。
1.4 采用细胞周期检测试剂盒评估细胞周期将MC3T 3-E1细胞接种于6孔板,分为对照组、20 nmol·L-1RAPA组、60 nmol·L-1RAPA组、160 nmol·L-1RAPA组 和2μmol·L-1MHY 1485组。作用2 d后,将MC3T 3-E1细胞经胰酶消化,收集并采用PBS洗涤。随后加入70%冷乙醇在4˚C恒温条件下固定过夜,采用PBS将固定液冲洗掉。加入0.4 mL PI染料和0.1 mL RNase A 37℃孵育30 min。再采用流式细胞术测定细胞中DNA水平,分析不同周期细胞百分率。
1.5 RT-qPCR法检测MC3T 3-E1细胞中目的基因mRNA表达水平MC3T 3-E1细胞接种于6孔板,实验分组同“1.4”步骤,培养2 d后,胰蛋白酶消化收集细胞,按照TRIzol试剂盒说明书提取总RNA,并采用Nano-Drop分光光度计测定RNA含量。按照试剂盒说明书合成cDNA和PCR扩增。采用StepOnePlus System software导出循环值(Ct)值,采用2-△△Ct法计算目的基因mRNA表达水平。引物序列见表1。
1.6 Western blotting法检测MC3T 3-E1细胞中目的蛋白表达水平将MC3T 3-E1细胞接种于6孔板,实验分组同“1.4”步骤,RIPA裂解液提取总蛋白,BCA法测定蛋白浓度,每个泳道加入15μg蛋白后进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDSPAGE),电泳后转至PVDF膜,采用5%脱脂奶粉封闭2 h后,分别加入稀释后的抗小鼠一抗4℃孵育过夜,辣根过氧化物酶标记的二抗37℃孵育1 h,增强化学发光法 (enhanced chemiluminescence,ECL)显影,采用Gel Image System-1600凝胶成像系统采集图像,分析条带灰度值。目的蛋白表达水平以目的条带灰度值/内参条带灰度值表示。

表1 引物序列Tab.1 Sequences of primers
1.7 茜素红染色观察成骨细胞矿化能力MC3T 3-E1细胞接种于6孔板,实验分组同“1.4”步骤,培养14 d后进行茜素红染色。弃去培养基,通过PBS清洗、固定后,加入0.2%茜素红S染色液,染色30 min,再将染液弃去,洗涤后放入显微镜下观察矿化结节形成情况,以了解成骨细胞矿化程度。
1.8 统计学分析采用SPSS 20.0统计软件进行统计学分析。各组MC3T 3-E1细胞增殖活性,不同周期细胞百分率,细胞中mTOR、p-mTOR、下游真核翻译起始因子4E结合蛋白(downstream signals IF4E-binding protein 1,4E-BP1)、磷 酸 化4E-BP1(p-4E-BP1)、核糖体S6激酶1(ribosome protein subunit 6 kinase1,S6K 1)、磷 酸 化S6K 1(p-S6K1)、p62、LC3、B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 related X protein,Bax)、Caspase-3、ALP、Runx2和Osterix mRNA和蛋白表达水平均以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组MC3T 3-E1成骨细胞的增殖活性不同浓度RAPA处理MC3T 3-E1细胞2 d后,与对照组比较,20~100 nmol·L-1PARA组成骨细胞的增殖活性升高(P<0.05),且浓度超过160 nmol·L-1后RAPA组成骨细胞增殖活性降低更明显(P<0.01),可见RAPA对成骨细胞的双向作用,即低中浓度促进细胞增殖而高浓度抑制细胞增殖,见图1A。根据检测结果,选择20和60 nmol·L-1RAPA作为有效刺激浓度,160 nmol·L-1RAPA作为过度抑制浓度。与对照组比较,高于0.5μmol·L-1MHY 1485作用2 d后抑制成骨细胞增殖活性降低(P<0.05或P<0.01),呈浓度依赖性,见图1B。根据实验检测结果,选定2.0μmol·L-1MHY 1485作为后续实验浓度。
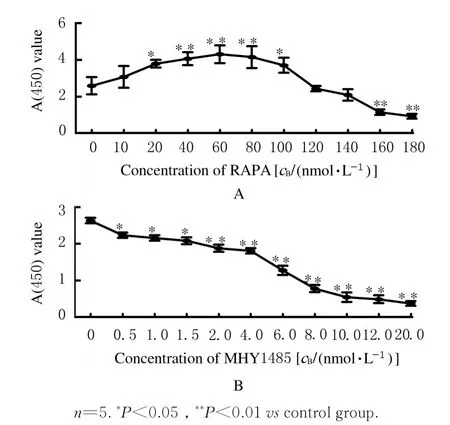
图1 不同浓度RAPA(A)MHY 1485(B)作用后AMC3T 3-E1成骨细胞的增殖活性Fig.1 Proliferation activities of MC3T 3-E1 osteoblasts after treated with different concentrations of RAPA(A)and MHY 1485(B)
2.2 各组不同细胞周期MC3T 3-E1成骨细胞百分率对照组MC3T 3-E1细胞中G1期细胞占76.12%,S期细胞占13.97%,20和60 nmol·L-1RAPA组G1期(66.40%和53.77%)细胞百分率明显降低(P<0.05或P<0.01),S期(25.65%和34.58%)细胞百分率明显升高(P<0.05或P<0.01),即20和60 nmol·L-1RAPA可促进成骨细胞增殖。与对照组比较,160 nmol·L-1RAPA和2.0μmol·L-1MHY 1485组G1期(83.48%和87.26%)细胞百分率升高(P<0.05),S期(4.44%和4.87%)细胞百分率降低(P<0.05)。见图2和3。
2.3 各组MC3T 3-E1成骨细胞中mTOR通路相关蛋白表达水平与对照组比较,20、60和160 nmol·L-1RAPA组MC3T 3-E1细 胞 中 总mTOR、4E-BP1和S6K 1蛋白表达水平无变化,但p-mTOR、p-4E-BP1和p-S6K1蛋白表达水平明显降低(P<0.05或P<0.01)。与对照组比较,2.0μmol·L-1MHY 1485组MC3T 3-E1成骨细胞中mTOR、p-4E-BP1和p-S6K1蛋白表达水平明显升高(P<0.01)。见图4和5。
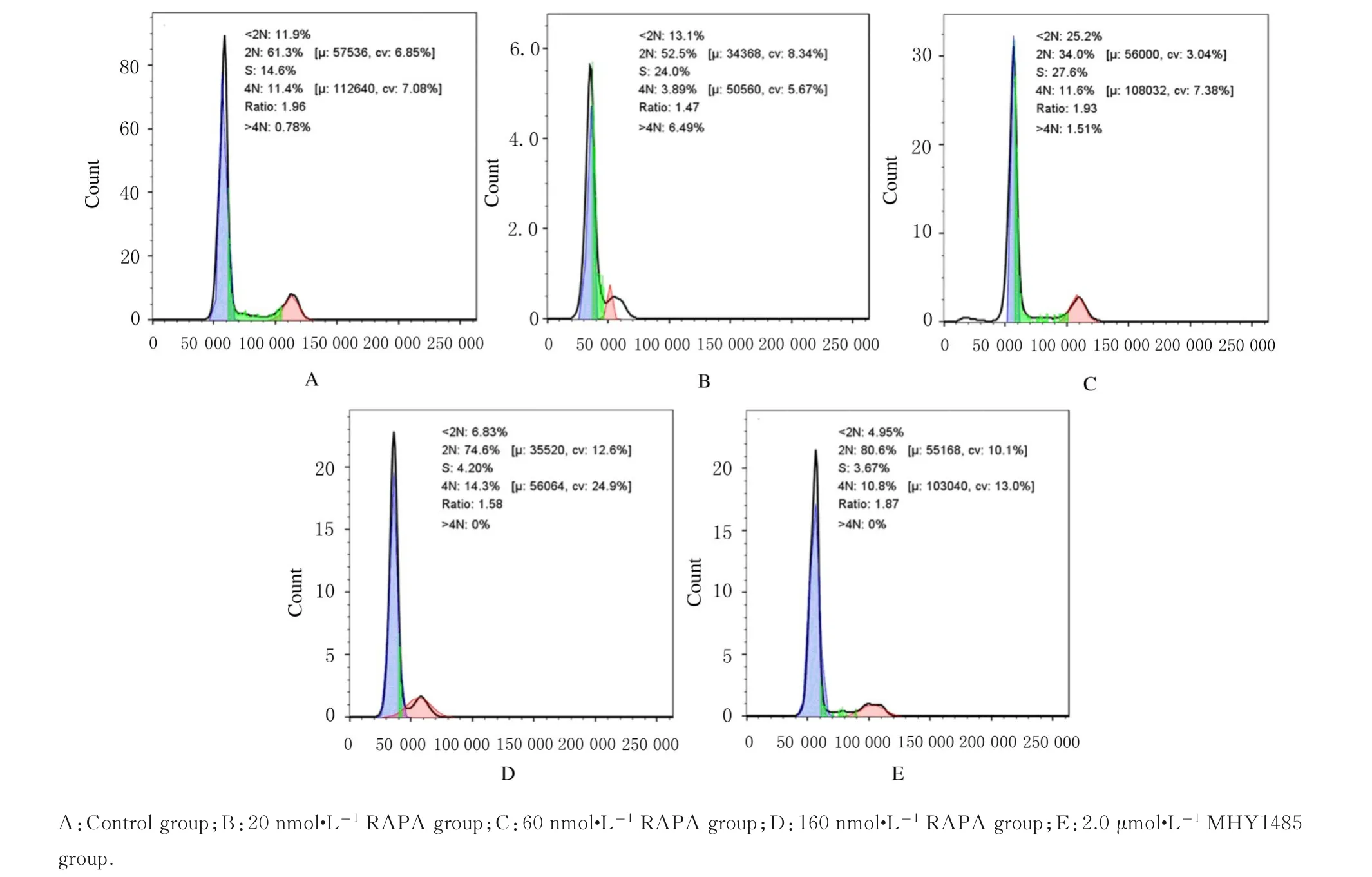
图2 细胞流式术检测各组MC3T 3-E1成骨细胞周期分布Fig.2 Distrubution of cell cycels of MC3T 3-E1 osteoblasts in various groups detected by flow cytometry
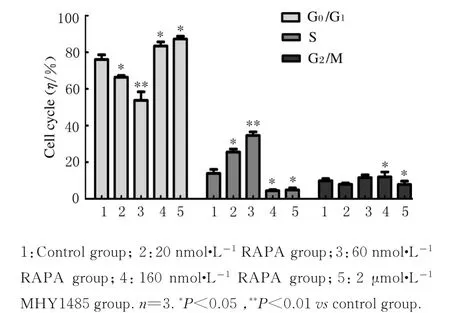
图3 各组不同细胞周期MC3T 3-E1成骨细胞百分率Fig.3 Percentages of MC3T 3-E1 osteoblasts at different cell cycles in various groups
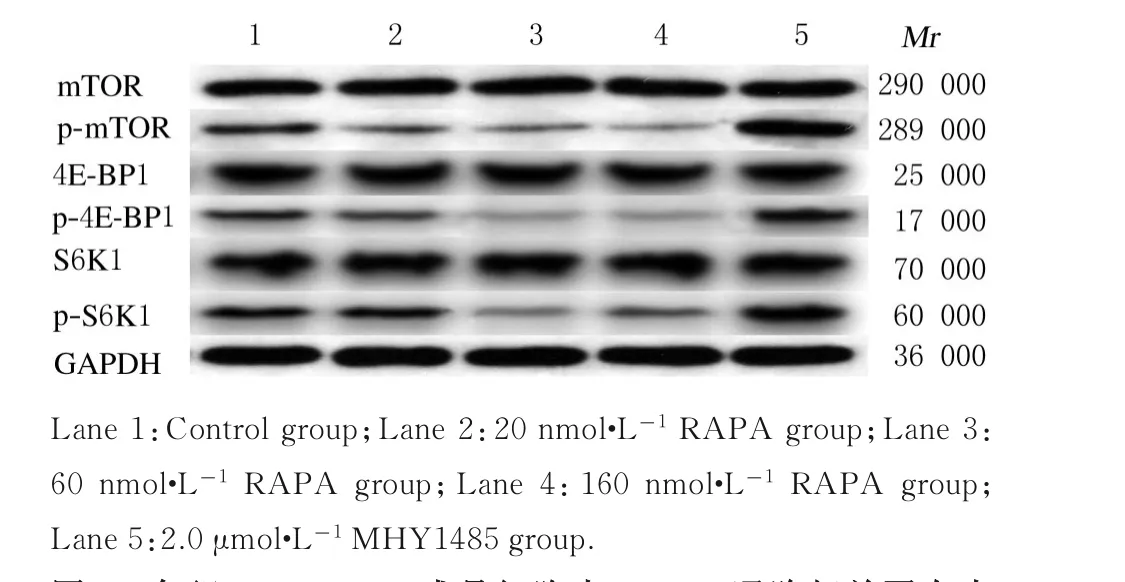
图4 各组MC3T 3-E1成骨细胞中mTOR通路相关蛋白表达电泳图Fig.4 Electrophoregram of expresssions of mTOR pathway-related proteins in MC3T 3-E1 osteoblasts in various groups
2.4 各组MC3T 3-E1成骨细胞中自噬标志物和凋亡相关因子mRNA和蛋白表达水平与对照组比较,20、60和160 nmol·L-1RAPA组成骨细胞中p62 mRNA和蛋白表达水平明显降低(P<0.01),LC3-Ⅱ表达水平升高,LC3-Ⅱ/LC3-Ⅰ比值升高(P<0.05或P<0.01),2.0μmol·L−1MHY 1485组MC3T 3-E1成骨细胞中LC3-Ⅱ和p62 mRNA和蛋白表达水平明显升高(P<0.01),免疫荧光检测结果也证实了上述结论。与对照组比较,20和60 nmol·L-1RAPA组MC3T 3-E1成骨细胞中促细胞凋亡的Bax mRNA和蛋白及Cleaved-Caspase-3蛋白表达水平降低,抗凋亡的Bcl-2 mRNA和蛋白表达水平升高(P<0.05或P<0.01),160 nmol·L-1RAPA和2.0μmol·L-1MHY 1485组MC3T 3-E1成骨细胞中Bax mRNA和蛋白及Cleaved-Caspase-3蛋白表达水平升高(P<0.01),Bcl-2 mRNA和蛋白表达水平降 低(P<0.05或P<0.01)。见 图6~9。

图5 各组MC3T 3-E1成骨细胞中mTOR通路相关蛋白的表达水平Fig.5 Expression levels of mTOR pathway-related proteins in MC3T 3-E1 osteoblasts in various groups

图6 各组MC3T 3-E1成骨细胞中自噬标志物和凋亡相关因子mRNA表达水平Fig.6 Expression levels of autophagy marker and apoptosis-related factor mRNA in MC3T 3-E1 osteoblasts in various groups

图7 各组MC3T 3E1成骨细胞中自噬标志物和凋亡相关因子蛋白表达电泳图Fig.7 Electrophoregram of expressions of autophagy marker and apoptosis-related factor proteins in MC3T 3-E1 osteoblasts in various groups
2.5 各组MC3T 3-E1成骨细胞中分化标志物ALP、Osterix和Runx2 mRNA和蛋白表达水平与对照组比较,20和60 nmol·L-1RAPA组MC3T 3-E1成骨细胞中ALP和Runx2 mRNA和蛋白表达水平升高(P<0.05或P<0.01),Osterix蛋白表达水平差异无统计学意义(P>0.05),160 nmol·L-1RAPA组MC3T 3-E1成 骨 细 胞 中Osterix蛋白表达水平降低(P<0.05),ALP和Runx2蛋白表达水平降低但差异无统计学意义(P>0.05),2.0μmol·L-1MHY 1485组MC3T 3-E1成骨细胞中ALP、Osterix和Runx2 mRNA和蛋白表达水平降低(P<0.01),见图10~12。茜素红染色结果显示:20和60 nmol·L-1RAPA作用12 d后,细胞中可以观察到明显的矿化结节,160 nmol·L-1RAPA和2.0μmol·L-1MHY 1485组镜下细胞数明显减少,只可见极少数钙盐结晶形成。见图13。
3 讨论
mTOR是细胞对抗氧化应激和细胞存活的重要调节因子之一,并且可以被MHY 1485激活以维持线粒体功能[14]。与衰老相关的骨质疏松症的特征是骨代谢的持续变化,表现为骨形成大于骨吸收。成骨细胞是骨形成的重要功能细胞,通过产生细胞外基质蛋白和基质矿化调节因子,参与早期骨形成和晚期骨重建。自噬是真核细胞的高度保守行为,其与细胞稳态和应激、损伤修复、增殖和分化等密切相关[15]。对细胞自噬的分子研究[16]表明mTOR信号通路是经典的研究通路。体外研究[17]表明:成骨样细胞自噬的药理学诱导可降低其氧化应激,抑制细胞凋亡。年龄相关的骨量丢失和骨氧化应激水平的逐渐升高,均与骨质疏松患者外周血中mTOR活性有关[18]。成骨细胞凋亡受多种信号通路的调节。在哺乳动物中Bcl-2基因及其相关蛋白在细胞凋亡调控过程中起重要作用。Bcl-2可以阻止细胞凋亡并使细胞寿命延长,而Bax与Bcl-2形成异源二聚体,通过抑制Bcl-2发挥促细胞凋亡作用[19]。Caspase-3活化为Cleaved-Caspase-3后可引起细胞凋亡,这个过程可以被Bcl-2阻断[20]。本研究结果显示:20和60 nmol·L-1RAPA组成骨细胞中mTOR及其下游通路p-4E-BP1和p-S6K 1水平明显降低,诱导成骨细胞从DNA合成前期进入DNA合成期,促进抗凋亡基因Bcl-2的表达和细胞增 殖,而160 nmol·L-1RAPA组 成 骨 细 胞 中p-mTOR水平降低、2.0μmol·L-1MHY 1485组成骨细胞中p-mTOR、p-4E-BP1和p-S6K 1水平明显升高,表现为阻止成骨细胞分裂使细胞周期停留在DNA合成期,诱导凋亡基因Bax和Cleaved-Caspase-3的表达,从而促进成骨细胞的凋亡,说明适度抑制mTOR的磷酸化有助于成骨细胞增殖,而过度抑制或激活mTOR通路则促进成骨细胞凋亡。
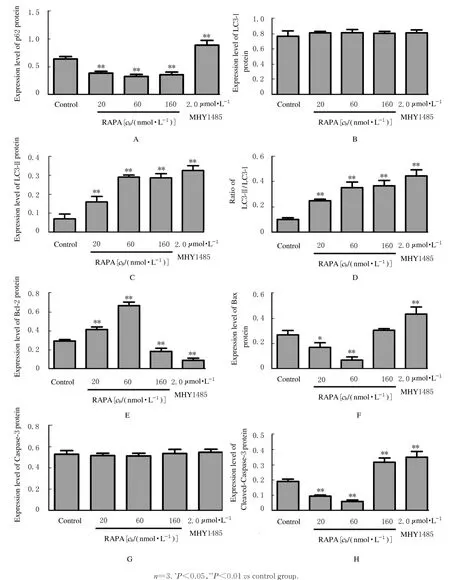
图8 各组MC3T 3-E1成骨细胞中自噬标志物和凋亡相关因子蛋白的表达水平Fig.8 Expression levels of autophagy marker and apoptosis-related factor proteins in MC3T 3-E1 osteoblasts in various groups

图9 免疫荧光法检测各组MC3T 3-E1成骨细胞中K LC3-Ⅱ蛋白的表达(Bar=50μm)Fig.9 Expressions of LC3-Ⅱprotein in MC3T 3-E1 osteoblasts in various groups detected by immunofluorescence method(Bar=50μm)
LC3-Ⅱ/LC3-Ⅰ比值可反映自噬流的产生状态。脂化后的LC3会从LC3-Ⅰ转化为LC3-Ⅱ,脂化的LC3-Ⅱ被认为是自噬小体形成的标志物[21]。p62可作为将要被自噬作用降解的小泡的受体,也可作为要被清除的泛素化蛋白聚集物的受体。p62蛋白可结合泛素,也可与LC3结合,从而靶向自噬体并促进泛素化蛋白的清除[22]。本研究结果证实:RAPA抑制p62的表达可提升LC3-Ⅱ/LC3-Ⅰ比值,免疫荧光实验结果证实在RAPA作用下LC3-Ⅱ表达明显增强,说明RAPA可激活成骨细胞内自噬,而MHY 1485通过抑制自噬体降解导致LC3-Ⅱ堆积,增强p62表达而抑制自噬。
ALP是反映骨形成的血清标志物,与成骨细胞和破骨细胞活性的变化有关。Osterix是与成骨细胞分化和骨形成有关的转录因子,只在发育的骨组织中呈特异性表达。Runx2是在诱导不成熟骨细胞向成熟的成骨细胞分化过程中起重要作用的转录因子[23]。ALP、Osterix和Runx2均可作为骨转化的标记蛋白,与骨吸收、骨形成和骨矿化密切相关[24]。本研究结果显示:20和60 nmol·L-1RAPA适度抑制mTOR的磷酸化时,ALP、Osterix和Runx2表达明显增强,同时可促进晚期矿化结节的形成,而160 nmol·L-1RAPA过度抑制mTOR的磷酸化并未明显改变成骨活性。MHY 1485增强mTOR磷酸化,并从基因和蛋白水平抑制ALP、Osterix和Runx2的表达,降低了成骨细胞晚期矿化能力;提示适度抑制mTOR的磷酸化在早期和晚期均可促进成骨细胞分化,增强成骨活性,而过度抑制和激活mTOR则可抑制成骨分化,而该结果的出现可能与不同条件下自噬的变化相关。研究[25]表明:通过调控mTOR过度抑制自噬或自噬过强均可导致细胞凋亡,但在成骨细胞中此机制尚未阐明,后续实验会将结论进行进一步验证。
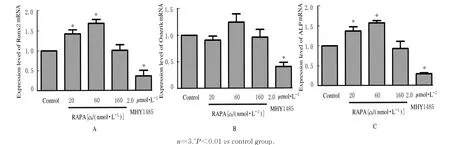
图10 各组MC3T 3-E1成骨细胞中Runx2(A)、Osterix(B)和ALP(C)表达水平Fig.10 Expression levels of Runx2(A),Osterix(B),and ALP(C)mRNA in MC3T 3-E1 osteoblasts in various groups
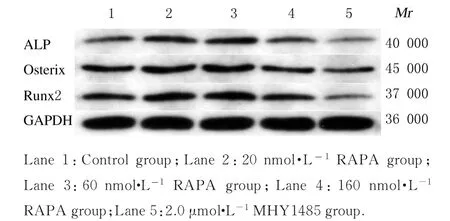
图11 各组MC3T 3-E1成骨细胞中ALP、Osterix和Runx2蛋白表达电泳图Fig.11 Electrophoregram of expressions of ALP,Osterix,and Runx2 proteins in MC3T 3-E1 osteoblasts in various groups

图12 各组MC3T 3-E1成骨细胞中Runx2(A)、Osterix(B)和ALP(C)蛋白表达水平Fig.12 Expression levels of Runx2(A),Osterix(B),and ALP(C)proteins in MC3T 3-E1 osteoblasts in various groups

图13 茜素红染色观察各组MC3T 3-E1成骨细胞矿化情况(Bar=50μm)Fig.13 Mineralization of MC3T 3-E1 osteoblasts in various groups detected by Alizarin red staining(Bar=50μm)
mTOR通过对各种骨相关细胞的活性和功能进行调控,影响骨代谢过程,其中涉及多种信号分子的调节,在骨组织代谢过程中起到重要作用。研究[23]显示:mTOR的抑制并不完全有利于骨量调节,接近极值的水平可能会影响细胞的基础功能,从而呈现相反结果,且在细胞生长和分化不同阶段的自噬水平也不一致。本研究结果显示:适宜浓度RAPA可以通过抑制mTOR活性,增强成骨细胞的增殖活性和分化能力,而过度抑制或激活mTOR则会诱导成骨细胞凋亡,减弱成骨细胞分化功能。本课题组将进行进一步的临床研究以确认mTOR与骨质疏松症之间可能存在的关系,为开发预防和治疗骨质疏松症的方法提供实验依据。
