慢性低氧对肺循环作用的研究进展
2021-06-04魏新川
黄 佳,魏新川△
(1.电子科技大学医学院,四川 成都 610054;2四川省医学科学院·四川省人民医院麻醉科,四川 成都 610072)
慢性缺氧是指患者机体细胞环境长期氧供应不足。细胞环境氧稳态反映机体产生能量的恒定需求。缺氧(0.1%~1%O2)、生理缺氧(~1%~13%)和常氧(~20%)是定义细胞环境中氧浓度的术语[1]。本文提到的慢性缺氧指人体处于细胞生理性缺氧状态。人体暴露于低氧环境引起血液中含氧不足,血氧分压降低、氧饱和度下降,表现为低氧血症。低氧血症对人体的各个系统都有不同程度的影响,以呼吸系统、心血管系统、神经系统尤甚。肺是呼吸系统和心血管系统进行气体交换的主要器官,肺循环的结构和功能状态受到低氧血症的影响。本文介绍的重点是长期处于低氧环境引起的慢性缺氧对肺循环的作用和低氧性肺动脉高压(hypoxicpulmonaryhypertension,HPHP)的发病机制。
1 慢性低氧对肺循环的病理生理学影响
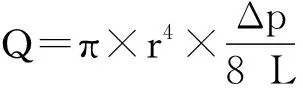
2 慢性低氧引起肺动脉高压的机制以及调控因素
目前,研究者们认为慢性低氧通过多途径综合作用导致HPHP,包括:肺动脉内皮细胞功能障碍、肺动脉平滑肌表型异常、血流动力学改变引起的血管异常重构、肺动脉平滑肌氧分子传感器异常、细胞膜离子通道异常、血管活性物质改变等。
2.1 肺动脉内皮细胞功能障碍
2.1.1血红蛋白α 参与调节肺动脉高压中的一氧化氮信号血红蛋白α是血红蛋白四聚体的重要组成部分,在全身小动脉广泛表达。血红蛋白α通过血红素亚铁复合物结合一氧化氮,将其还原成不具备舒张活性的硝酸盐。因此当血红蛋白α与内皮型一氧化氮合酶结合受抑制时,血管舒张活性物质一氧化氮信号传递增加,内皮舒张功能恢复[2]。因此,血红蛋白α可看作肺血管内皮细胞的一氧化氮清除剂。因此血红蛋白α和内皮型一氧化氮合酶结合是慢性低氧导致肺动脉高压的重要过程。
2.1.2p38 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)参与低氧损伤 肺动脉内皮细胞p38MAPK、细胞外信号调节激酶、c-junNH2末端激酶构成了MAPK家族。生长因子、细胞应激、炎症刺激诱导内源性免疫细胞内的p38激活。低氧暴露后的肺动脉p38MAPK表达和超氧化合物生成增多,抑制p38MAPK可以逆转缺氧导致的肺动脉内皮细胞功能障碍[3]。p38MAPK表达增高可能是低氧损伤肺动脉内皮细胞的重要环节。这解释了早期学界观点——炎症是导致肺动脉高压的重要因素之一。更具体的作用机制还需要进一步探索,但它仍说明p38 MAPK可能成为治疗HPHP的一个重要位点。
2.2 肺血管平滑肌表型异常肺血管和全身血管平滑肌细胞表型不同,体内体外研究表明其表型、增殖能力、基质蛋白合成能力均存在明显差异[4,5]。
2.2.1肺血管平滑肌细胞的类癌表型 肺动脉高压血管病变由平滑肌细胞改变为主,表现出类似于癌症特征的肿瘤样表型,复制潜能不受控制、生长信号能够自我维持,抵抗生长抑制因子,对炎症反应也出现改变。这种表型异常已经在mRNA水平和蛋白分子水平证实是由于细胞周期素依赖激酶(CDK)过度活化,经过CDK-RB-E2F信号通路传递信号,激活肺血管平滑肌细胞过度增殖[6]。一方面肺动脉高压与肺血管平滑肌细胞、内皮细胞和成纤维细胞的高增殖、抗凋亡能力密切相关,引起肺血管阻塞,肺动脉压力升高,右心室压力超载,右心室心肌肥厚,引起器质性改变。另一方面,缺氧会引起肺血管平滑肌细胞产生改变周围细胞分泌表型和反应特性的分化因子促进肺动脉高压[5]。
2.2.2微小RNA和缺氧诱导因子1(HIF-1) 微小RNA和HIF-1是缺氧导致肺血管平滑肌细胞异常增殖的重要调控因子HIF-1由α和β亚基组成,其中α亚基是主要的效应组分。低氧状态下,HIF-1α水平升高直接调控超过100个靶基因的转录,广泛影响代谢、生存、增殖、迁移、血管形成。低氧状态下,部分微小RNA(microRNA,miR)表达水平增高,通过降解靶基因转录体,抑制相关基因的表达。HIF-1α与miRNA在低氧反应中的作用是近年来的研究热点。
研究发现miR-1260b在缺氧诱导下表达水平增高,作用于生长分化因子(GDF11)的3’UTR,下调GDF11,达到抑制GDF11-Smad信号转导,引起血管平滑肌细胞的异常增殖[7]。此外,缺氧也可以诱导miR-629上调,促使肺动脉血管平滑肌细胞增殖、迁移,抑制细胞凋亡[8],激活rho激酶、诱导HIF-1α导致不良的肺血管重构和肺动脉高压[9]。miR-21、miR-17等miRNA均可通过不同的通路实现缺氧对肺血管重构的影响[10~12]。2019年的诺贝尔生理学医学奖将HIF的地位推向了高峰,HIF作为机体缺氧的标志性分子,研究表明它通过调节相关基因的表达,引发组织细胞的耐氧适应性反应,参与新生血管生成、红细胞生成、抗细胞凋亡等过程[13],miRNA也受到HIF的直接调控。
综上可知,缺氧对肺血管平滑肌的影响不是由单一的机制调控,而是多条信号通路、多种关键因子共同作用完成。miRNA和HIF-1α在肺血管平滑肌细胞的缺氧适应性反应中的作用以及二者之间的相互联系是目前研究的热点[14]。
2.3 肺动脉平滑肌氧分子传感器和细胞膜离子通道异常据研究报道,肺循环和体循环存在组织自身的异质性,平滑肌细胞对缺氧的反应与氧感受器有关[9]。低氧状态激动氧感受器,引起细胞钾离子通道活性下降,肺动脉平滑肌细胞膜去极化,打开细胞膜上的电压依赖L型钙离子通道,与此同时直接刺激受体依赖钙离子通道和存储依赖的钙离子通道,两种机制共同作用,使肺动脉平滑肌细胞胞浆中的钙离子水平升高,引起肺动脉收缩,发展为肺动脉高压[15,16]。由于离子通道电化学研究方法的普及,离子通道相关的研究不再吸引研究者的目光。近年来,研究者们聚焦于基因的过表达或缺失对缺氧反应的氧气传感器——线粒体氧化还原过程影响相关的研究,如线粒体功能受miRNA-210调控基因表达水平影响相关动物研究[17]。
2.4 血管活性物质改变和血流动力学改变人体的肺循环是低压循环系统,体液因素是肺循环压力的主要控制因素。正常情况下,肺循环的血管活性物质处于一种以舒张为主的稳态。一旦稳态破坏,如内皮素增多、一氧化氮减少,整个肺循环的压力升高,长期的压力升高进而导致肺血管内皮细胞增殖、新生血管生成、肺血管重构,肺动脉高压随之到来。长期低氧对人体重要的肾上腺素能系统也有一定的影响,研究证明α-肾上腺素能信号和血管功能在发育的过程中发生变化,长期处于高海拔低氧环境导致机体α肾上腺素受体基因转录上调,修饰肾上腺素能信号[18]。而内皮素作为维持血管基础张力的重要物质,同时参与肺血管平滑肌细胞的增殖和血管内皮细胞的血管生成[19]。虽然这些血管内源性活性物质维持肺循环压力有极大的贡献,但研究证明血管压力诱导的平滑肌细胞膜电位去极化并不会引起血管的肌源性收缩[20],可见肺血管结构改变才是肺动脉高压的直接致病因素。
3 低氧影响肺血管相关研究的临床作用
HIF标志着机体对于缺氧的反应,当处于缺氧状态时,机体会下调能量消耗大的酶适应环境的变化。以钠-钾ATP酶(Na-K-ATPase)为例,长期缺氧时,HIF诱导血红素氧化的IRP2泛素连接酶1L(HOIL-1L),导致PKCζ降解,从而使Na-K-ATPase稳定在常氧状态的50%水平左右,防止其过度下调和细胞死亡[21],因此通过预先的低氧适应性训练,人工的上调体内HIF水平,达到减少肺泡内皮细胞凋亡和肺保护的目的。其次,本文提到HIF-1α调控多种miRNA表达,使用药物或其他治疗方式通过改变miRNA表达水平,也可以发挥HIF-1α介导的低氧适应性反应,减少细胞损伤。最后在HIF自身结构的变化涉及关键酶以及后续信号通路的调控也是肺保护的一个很好的作用位点。
综上,慢性低氧对肺血管作用,不同的通路有不同的参与因子和不同的作用位点。它们各不相同,但又共同影响。同时HPHP是严重心血管疾病的重要过程,其重要程度不言而喻。因此深入理解作用机制,为逆转或缓解低氧作用肺血管引起的相关疾病有重要意义。
