离体肝脏双泵双氧合机械灌注设备应用于猪肝脏常温机械灌注的可行性研究
2021-06-04邝伟键谭晓宇何锡然刘华敏郭家钘陈素平
邝伟键,谭晓宇,何锡然,刘华敏,张 琳,郭家钘,陈素平,霍 枫*
(1.广东顺德工业设计研究院(广东顺德创新设计研究院)生物医学部,广东佛山528311;2.南部战区总医院肝胆外科,广州510010;3.广东丁沃生医疗器械有限公司研发部,广东佛山528311)
0 引言
肝移植是目前治疗终末期肝病的最有效方法。随着我国医疗水平的不断提升,肝移植手术成功率大幅度提高。但合格供肝数量的短缺制约了我国肝移植事业的发展[1]。同时临床上有大量的边缘性供肝因保存或其他原因达不到移植标准而被废弃[2]。因此,改善边缘性供肝质量、保持供肝活性是扩大供肝源的重要途径。
肝脏的机械灌注最早由Starzl等[3]于1968年提出,但受限于当时的机械设备性能以及细菌感染的风险,价格低廉、操作简便的静态冷保存比机械灌注表现更为优越[4],因此临床上一直沿用静态冷保存长达30 a之久。目前由于供肝需求量日益增大,临床上被迫开始使用更多的边缘性供肝,此时机械灌注再次成为肝脏保存的研究热点。相关研究表明[5-6],常温机械灌注对供肝的损伤能减少50%,供肝平均保存期增加54%,器官弃用率降低50%。目前国外已经研发了数个常温灌注设备并逐渐投入临床使用[7],而我国在相关领域的研究处于空白状态,因此发展国内的离体肝脏常温机械灌注设备已经迫在眉睫。由广东顺德工业设计研究院、南部战区总医院以及广东丁沃生医疗器械有限公司联合研发的DEVOCEAN-LIVER 2000是国内首创的双泵双氧合器的肝脏体外灌注设备,同时具备常温机械灌注与低温机械灌注功能。为验证该设备常温机械灌注的可操作性、安全性以及有效性,本研究采用该设备对猪肝脏开展肝脏离体常温机械灌注实验,验证其对肝脏体外保存的效果。
1 材料与方法
1.1 实验动物
健康雌性巴马小型猪6只,均由东莞松山湖实验动物科技有限公司提供,体质量范围45~50 kg。手术前12 h禁食、禁水。
1.2 供肝获取及修整
首先给实验猪肌肉注射混合药物(100 mg舒泰+5 mg咪达唑仑)进行基础麻醉后,采用留置针建立耳缘静脉通路,然后静脉注射2 mg/(kg·h)丙泊酚维持深度麻醉,随后进行气管插管及呼吸机供氧。麻醉稳定后,对实验猪进行腹中线开腹手术,术野上至剑突,下至最后一对乳头。充分暴露腹腔,游离腹主动脉、下腔静脉及门静脉。游离完毕后,在耳缘静脉注射25 000 U肝素。待肝素作用2 min后于下腔静脉置管,收集血液约1.5 L用于后续制作灌注液。
血液收集完毕后,打开胸腔,结扎胸主动脉。用1 L 4℃的高渗枸橼酸盐嘌呤溶液(HC-A液体,上海输血技术有限公司)经腹主动脉与门静脉进行在体灌注,此时记录为热缺血完毕,开始进入冷缺血阶段。灌注完毕后,在保留含肝固有动脉的腹主动脉情况下,快速将肝脏从机体分离。将供肝置于含生理盐水的冰盆中进行修整,置入动脉与门静脉插管。肝脏热缺血控制在11 min,冷缺血控制在80 min。
1.3 灌注液制备
手术收集的实验猪自体血液过滤白细胞后,加入羟乙基淀粉40氯化钠注射液(石家庄四药有限公司)扩容至2 L,使红细胞比容(HCT)维持在28%~35%,并加入10 g白蛋白(美国杰特贝林生物制品有限公司)、12 500 U肝素(天津生物化学制药有限公司)以及1 g头孢西丁(安徽省咸丰制药有限公司)后便可作为常温机械灌注的灌注液。
1.4 灌注方法
采用DEVOCEAN-LIVER 2000[8]进行常温机械灌注。具体方法:加入灌注液,排清管路空气,并等待灌注液充分氧合。随后将肝脏放置于储肝器之中,将门静脉插管和动脉插管分别与DEVOCEAN-LIVER 2000连接,此时记录为冷缺血完毕,进入常温机械灌注阶段。将计算机与压力传感器、流量传感器连接,实时记录灌注液的血流动力学数据。灌注模式为恒压模式,灌注温度为37℃,动脉灌注压维持在60~80 mmHg(1 mmHg=133.32 Pa),门静脉灌注压控制在6~8 mmHg,共灌注6 h。
1.5 样本收集及指标检测
机械灌注开始10 min后(记为灌注0 h),使用雅培iSTAT-300G血气分析仪对每小时的灌注液进行分析,同时利用微纳芯Pointcare V2对灌注液进行生化检测。分别取灌注前以及灌注终末时的肝脏组织用10%福尔马林固定,进行HE染色后在显微镜下观察。
1.6 统计学方法
所有数据采用SPSS 23.0统计学软件进行统计学分析,并采用两独立样本均数t检验进行比较,P<0.05为差异具有统计学意义。
2 结果
2.1 血流动力学
动脉流量及门静脉流量变化如图1所示。由图1可见,灌注液的流量随着灌注时间平稳增长。灌注1 h时动脉流量为(0.10±0.06)mL/[min·g(肝重)],门静脉流量为(0.61±0.36)mL/[min·g(肝重)];灌注6 h时动脉流量为(0.19±0.11)mL/[min·g(肝重)],门静脉流量为(0.81±0.39)mL/[min·g(肝重)]。灌注1 h与灌注6 h的动脉流量比较差异无统计学意义(P=0.15),灌注1 h与灌注6 h的门静脉流量比较差异无统计学意义(P=0.32)。动脉血液pH值一直维持在7.2~7.5,灌注0 h与灌注6 h的pH值比较差异无统计学意义(P=0.263),如图2所示。

图1 灌注液流量变化
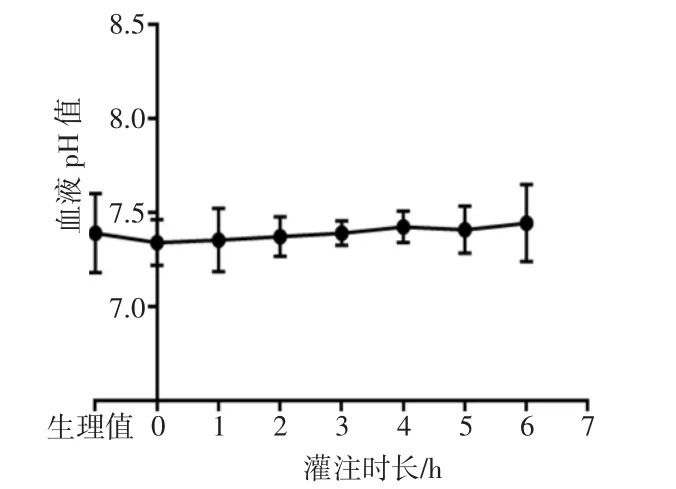
图2 动脉血液p H值变化
2.2 肝功能
2.2.1 胆汁生成量
肝脏连接灌注设备以后,不同肝脏产生胆汁的起始时间不同,但均在前1 h内开始形成,随后每小时都有胆汁生成,最高峰时可达0.008 5 mL/[h·g(肝重)]。但由于缺乏胆盐,胆汁生成曲线会呈现倒“V”形,如图3所示。
2.2.2 转氨酶水平
如图4、5所示,在灌注初期谷丙转氨酶(ALT)与谷草转氨酶(AST)均有较大涨幅[ALT达(48.11±35.05)U/L,AST达(315.67±275.97)U/L],随后的灌注过程中,ALT、AST虽有涨幅,但整体趋于平稳。灌注前ALT为(25.29±9.25)U/L,灌注6 h后为(63.14±43.69)U/L(P=0.05)。灌注前AST为(30.85±9.17)U/L,灌注6 h后为(740.00±281.98)U/L(P=0.00<0.05)。
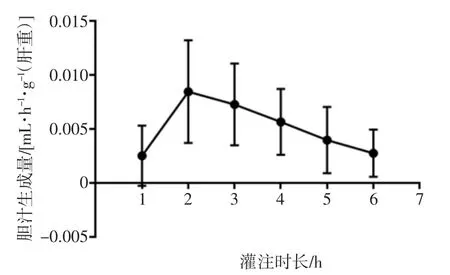
图3 灌注期间胆汁生成量变化
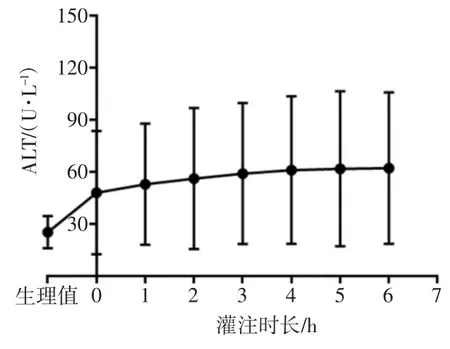
图4 灌注液ALT变化
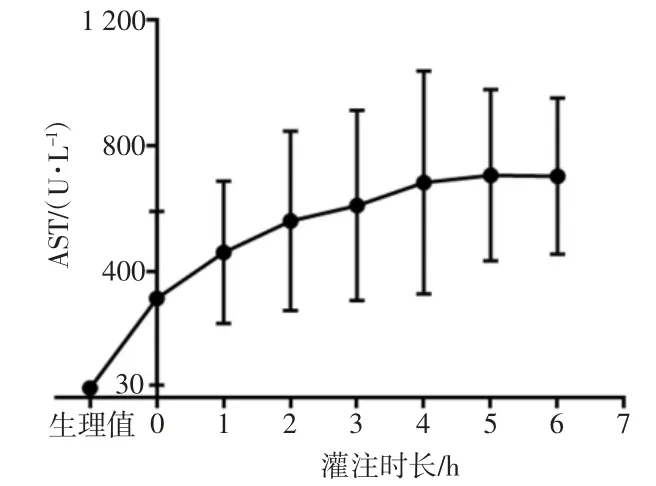
图5 灌注液AST变化
2.2.3 血糖及乳酸浓度
灌注期间血糖变化如图6所示,灌注前血糖为(16.62±4.97)mmol/L,灌注6 h后为(11.55±3.26)mmol/L(P=0.09),总体呈现平稳下降趋势。血液中乳酸的变化如图7所示,灌注前为(3.23±0.43)mmol/L,灌注6 h后下降至(0.96±0.38)mmol/L,灌注前与灌注6 h的乳酸水平比较差异有统计学意义(P<0.05)。
2.2.4 总胆红素
灌注期间血液中总胆红素的变化如图8所示。灌注前总胆红素为(4.04±0.40)μmol/L,灌注结束时为(5.39±4.88)μmol/L。灌注前后胆红素变化不明显(P=0.50)。
2.3 组织形态学
如图9所示,肝脏经历一段时间的缺血后,大部分区域呈深红色,颜色并不均一,可见明显的瘀斑,边缘无增厚,表面光滑。经DEVOCEAN-LIVER 2000灌注6 h后肝脏外观如图10所示,肝脏体积无增大或缩小,外形无明显改变,瘀斑消失,肝门区域轻微肿胀。肝脏病理切片如图11所示,灌注前肝小叶结构清晰,无淤血;灌注结束后小叶结构仍然保持完整,肝窦轻微扩张伴有轻微淤血,肝实质细胞轻微水肿,可见少量灶状坏死。肝脏灌注前后细胞结构变化不明显。
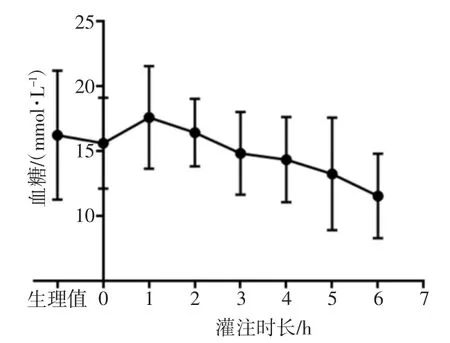
图6 灌注液血糖变化
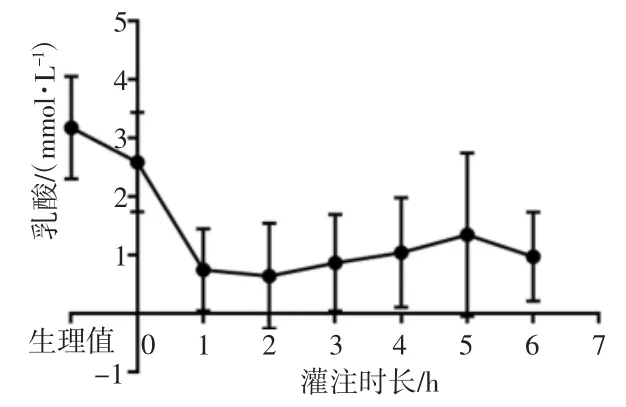
图7 灌注液乳酸变化

图8 灌注液总胆红素变化
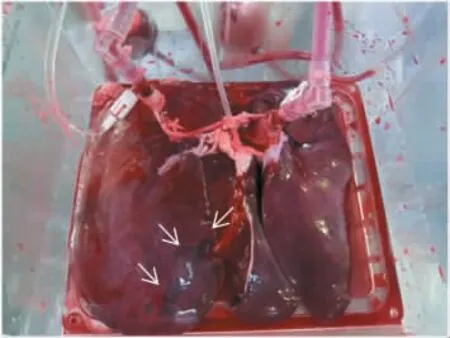
图9 猪肝脏常温机械灌注前外观
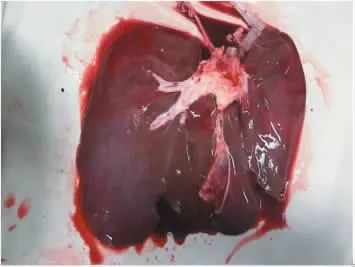
图10 猪肝脏常温机械灌注后外观
3 讨论
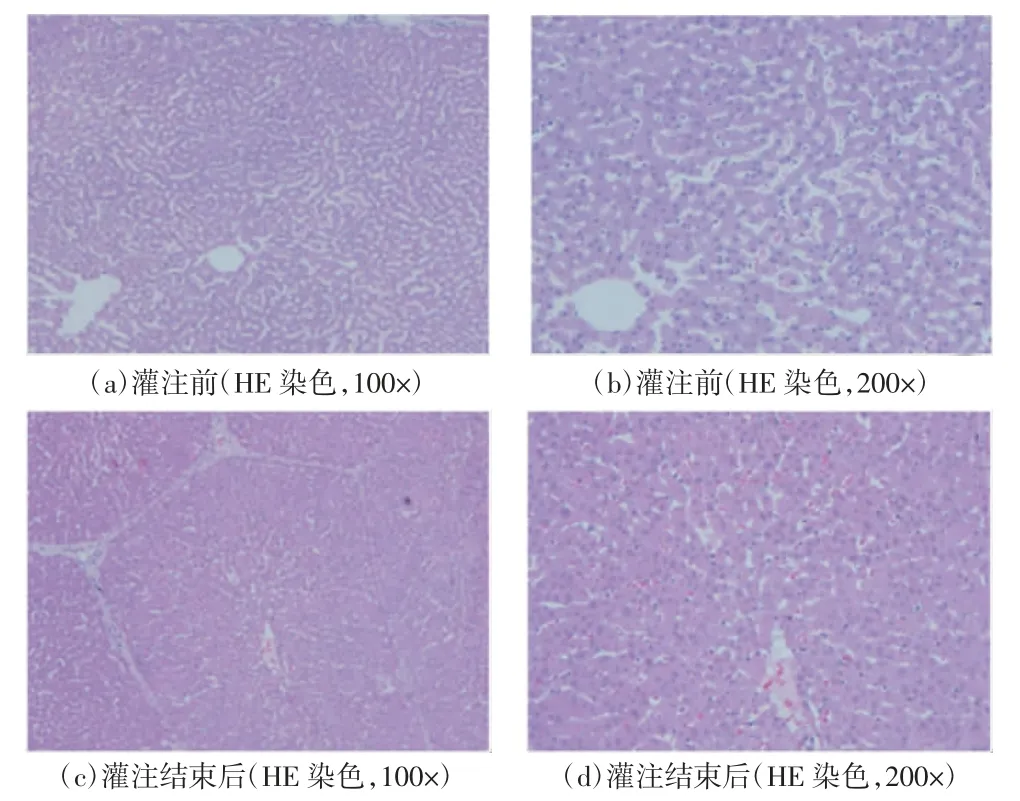
图11 猪肝脏常温机械灌注前后的HE染色结果
常温机械灌注能为供肝在体外提供营养物质、氧气等,使供肝在体外仍然能维持正常的代谢水平。常温机械灌注与常规的静态冷保存相比,可延长保存、修复损伤的肝脏以及评价供肝质量[9]。Butler等[10]对无缺血的猪肝脏进行长达72 h的常温机械灌注,灌注结束时肝脏依然保持活性,转氨酶仍处于正常水平,光镜下肝脏小叶以及胆管组织结构完整。Brockmann等[11]利用常温机械灌注对无缺血的猪肝脏进行了20 h的保存,移植后5 d生存率明显高于同时长的冷保存组,同时发现灌注保存期的转氨酶水平与生存率具有相关性。Fondevila等[12]对热缺血90 min的猪肝脏进行体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)联合常温机械灌注后进行移植,5 d生存率明显高于冷保存组(100%与0)。
目前,离体肝脏常温机械灌注设备研发最成熟的分别为英国牛津大学的Organ OX metra与荷兰Organ Assist公司的Liver Assist,两者都已经开展了相关临床实验[13-16]。临床上的数据再结合大量的动物移植实验数据,使常温机械灌注后供肝的移植前标准也逐步形成。Ravikumar等[17]使用Organ OX metra对20人的肝脏(其中4个为心脏死亡供体,16个为脑死亡供体)进行体外的恒压常温灌注并成功移植,移植后6个月的生存率为100%,作为对照组的静态冷保存法在移植后6个月生存率则为97.5%,且术后常温灌注组的受体AST最高峰远低于静态冷保存组。上述临床实验中,对于供肝的评价指标并不多,灌注过程中灌注液的pH值维持在7.2~7.4,同时肝脏平均保持着5 mL/h以上的胆汁生成量(被认为反映肝功能的最有价值指标[9]),而门静脉流量平均保持在0.75~0.85 mL/min,肝动脉流量平均保持在0.15~0.3 mL/min。Watson等[18]从2014—2017年使用Liver Asisst对47个肝脏进行离体灌注,除了胆汁生成量、血液pH值、血液流量以外,还分别对灌注时期血液的ALT、乳酸以及血糖进行了监测。其中选择了ALT<5 000 U/L、乳酸<2.5 mmol/L的22个肝脏进行了移植,仅有1例因发生移植肝原发性无功能而死亡。
本研究采用DEVOCEAN-LIVER 2000进行常温机械灌注。灌注初期,灌注液中的AST与ALT比生理值有较大的涨幅[ALT为(48.11±35.05)U/L,AST为(315.67±275.97)U/L],这是由于实验中需要对动物实施放血以及获取肝脏后对血管修补等原因。肝脏共经历了11 min热缺血与80 min冷缺血,再与DEVOCEAN-LIVER 2000连接恢复灌注后便形成了缺血再灌注损伤(ischemia-reperfusion injury,IRI),IRI能引发肝脏大量氧自由基的产生,损伤细胞膜,释放出胞浆中的转氨酶[19]。但随后的灌注过程中,ALT与AST再未出现大幅度增长,灌注6 h后ALT为(63.14±43.69)U/L、AST为(740.00±281.98)U/L,动脉血的pH值维持在7.2~7.5,乳酸保持在(0.96±0.38)mmol/L,证明肝脏在DEVOCEAN-LIVER 2000常温机械灌注的保护下能维持正常的代谢水平,保持活性,并有效抑制IRI的发生。以上生化与血气指标均符合Watson等[18]移植前的供肝标准。在灌注后期会出现胆汁生成量明显下降的现象,推测是由于胆汁的重要组分胆盐缺乏而造成的。胆盐在体内经过肠肝循环不断重复利用生成胆汁[20],而体外灌注的肝脏因缺少肠肝循环使胆盐无法重新利用,最终导致胆汁生成量减少。Vogel等[21]在灌注液中以140 mg/h的量加入胆盐,有效解决了胆汁生成量减少的问题。由于国内缺乏无菌处理的胆盐,因此本实验并未加入胆盐,导致灌注后期的胆汁生成量下降。但即便如此,DEVOCEAN-LIVER 2000灌注的肝脏在后期仍然持续生成胆汁。由于肝脏经历热缺血后微循环堵塞,肝脏表面出现明显的瘀斑,经DEVOCEAN-LIVER 2000灌注6 h后瘀斑消失,灌注流量也逐步提高,证明肝脏内血液循环有所改善。体外常温机械灌注除了能直接改善供肝的质量以外,还可以为药物治疗、基因干预等提供一个良好的科研平台[22]。而这些优势都是使用传统的静态冷保存法无法实现的。
Organ OX metra采用的是单泵单氧合器的设计,该设备对血液氧合后由1个离心泵提供动力,分别进入动脉与门静脉。其中动脉直接进入肝脏,而门静脉到达设备顶端的血袋后,再经重力作用进入肝脏,通过血袋的压力阀对门静脉灌注压进行调节[18]。这种设计难以控制门静脉的流速以及灌注压[23],而双泵双氧合设备能对动脉与门静脉进行快速且独立的调节,也可分开进行不同条件的氧合,更接近体内肝脏门静脉与动脉的情况。Liver Assist也采用了双泵双氧合设计,该设计主要将设备分为3个单元,1个离心泵和1个氧合器为一组,安装至2个独立的单元中,氧合后分2路进入第三部分储肝器中,最后分别经动脉以及门静脉进入肝脏[13]。该设备是通过管路将3个独立的单元连接在一起,管路较长,灌注液需求增加;安装过程复杂,管路安装不当容易导致管路混入空气、血液污染等问题的发生。与Liver Assist不同,DEVOCEAN-LIVER 2000将储肝器、离心泵、氧合器以及管路整合至同一个套包中,仅需一步即可完成安装,既方便消毒灭菌,又加快了临床使用时的安装速度。
综上所述,DEVOCEAN-LIVER 2000能为肝脏在体外提供6 h稳定的常温机械灌注,使肝脏保持良好的状态,符合移植的标准,同时操作性明显优于国外的设备,且价格更优惠,对于提高我国的肝移植手术数量与质量具有重要的意义。后续将开展灌注时间更长的实验,以及不同类型的边缘供肝的灌注实验和大型动物的肝移植实验,以进一步确定DEVOCEAN-LIVER 2000的安全性、稳定性与有效性。
