旋光度法测蔗糖水解反应速率常数实验的热力学探究
2021-06-03于少芬赵倩何有清刘刚宋其圣苑世领
于少芬,赵倩,何有清,刘刚,*,宋其圣,苑世领
1山东大学化学与化工学院,济南 250100
2山东师范大学附属中学,济南 250014
1 引言
“旋光度法测蔗糖水解反应速率常数”是化学动力学研究的第一个定量化结果,由Wilhelmy在1850年首次报道,在化学动力学的发展历史上具有里程碑意义。目前,“旋光度法测蔗糖水解反应速率常数”仍然是《大学物理化学实验》中一个非常经典的化学动力学教学实验。实验利用溶液旋光度的变化对蔗糖水解进程进行跟踪,进而计算出速率常数、半衰期和蔗糖转化的活化能。实验方法简单直观,易于操作,重复性好,是大部分高校必开的物理化学教学实验之一。
蔗糖在酸做催化剂的条件下水解成为葡萄糖和果糖,水解反应速率跟蔗糖浓度、反应温度、酸的种类和浓度等因素有关。近20年来,人们不断对实验原理、实验方法、数据处理等内容进行完善和改进。梁敏等[1,2]最早尝试了给旋光仪增加恒温装置以避免温度波动对实验结果的影响,同时探讨了不同温度和盐酸浓度下的蔗糖水解反应速率常数。周华峰、金玉洁等[3,4]充分验证了蔗糖水解反应为一级反应的实验条件,认为较低的蔗糖浓度和较低的酸浓度是进行一级反应近似处理的关键。周从山等[5]采用误差分析的方法对蔗糖水解实验的不同数据处理方法进行比较,提出了利用外推法计算反应终点的旋光度(α∞)和二次曲线拟合计算反应速率常数的方法。艾佑宏等[6–8]探讨了不直接测量α∞从而避免终点旋光度测不准造成较大误差的实验改进方法。赵金和等[9]探讨了盐酸、硫酸、磷酸等不同催化剂对蔗糖水解速率的影响。
蔗糖水解反应实际上是可逆反应,人们在实际教学和教研探索中的教学思路大多局限在动力学知识的讨论,往往将蔗糖水解近似处理为完全反应,很少涉及蔗糖水解反应在热力学方面的问题[10]。为了进一步拓展蔗糖水解实验的教学内容,加深学生对旋光度加和性、化学反应级数、热力学动态平衡等知识的理解,该文详细分析了蔗糖水解体系旋光度的加和性、蔗糖水解反应的可逆性,探讨了温度对蔗糖转化、蔗糖水解平衡的影响,拓展了学生的学习思路,增强了学生对蔗糖水解反应的理解。
2 实验原理
蔗糖水解成葡萄糖和果糖的反应:

蔗糖水解反应一般采用酸作为催化剂,在蔗糖和酸浓度不太大时反应近似为一级反应[11]。其反应速率与蔗糖浓度呈正比:

积分得:

c0为反应物初始浓度,k为反应速率常数。
蔗糖、葡萄糖、果糖都是旋光性物质,他们的旋光能力不同,因此可以利用体系在反应过程中旋光度的变化来判断反应的进程。溶液的旋光度与溶液中所含旋光物质的种类、浓度、溶剂的性质、液层厚度、光源波长、温度等因素有关。不同物质的旋光度可由如下公式计算得到:


式中α0为反应体系初始旋光度,αt为t时刻体系的旋光度,α∞为反应平衡时体系的旋光度。通过ln(αt−α∞)对t作图,即可通过直线斜率求出反应速率常数k,进而求出半衰期和反应活化能。
在实际教学过程中,我们可以尝试利用溶液中蔗糖、葡萄糖、果糖三种组分旋光性的加和性,得到溶液体系中不同组分的浓度变化,进而引导学生学习化学反应级数等动力学知识,同时利用平衡体系中各组分的浓度变化探讨蔗糖水解反应的可逆性,加深学生对热力学动态平衡、化学动力学与热力学的联系等知识的理解。
旋光度具有加和性是目前公认的结论,但在教材或文献中很少见到蔗糖、葡萄糖、果糖三组分之间浓度和旋光度对应关系的应用实例,本文根据式(4)以及混合物中旋光度具有加和性的原理,推导并验证了溶液旋光度与不同组分的关系式:

式中tα为t时刻体系的旋光度,为t时刻体系中各组分的质量浓度,l为旋光管的长度(本实验中为 20 cm),为不同温度下蔗糖、葡萄糖、果糖的比旋光度(此数据可在实验中利用单组分溶液预先测得)。蔗糖水解过程中,蔗糖、葡萄糖和果糖的浓度还具有如下关系:

式中c0蔗糖为蔗糖的初始质量浓度,单位为g·mL−1,为t时刻时体系中的蔗糖浓度,M葡萄糖为葡萄糖摩尔质量,M蔗糖为蔗糖的摩尔质量。
联立式(6)和式(7)即可利用溶液的旋光度得到体系中不同组分的浓度。同时也可以利用体系平衡时的旋光度进一步讨论蔗糖的转化率和蔗糖水解反应的平衡常数。
3 实验过程
3.1 不用温度下蔗糖、葡萄糖、果糖比旋光度的测定
(1) 分别称取10.0008 g蔗糖、10.0001 g葡萄糖和10.0003 g果糖,用去离子水在250 mL容量瓶中配置成储备溶液。
(2) 利用旋光仪分别测定25.0、30.0、35.0、40.0、45.0 °C下蔗糖、葡萄糖、果糖溶液的旋光度,并利用公式(4)计算不同温度下蔗糖、葡萄糖、果糖溶液的比旋光度。
3.2 验证“溶液的总旋光度等于各组分旋光度的代数和”
配置葡萄糖:果糖:蔗糖浓度比分别为1 : 1 : 2、1 : 1 : 1、1.5 : 1.5 : 1、4 : 4 : 1的混合溶液,分别测量25.0、30.0、35.0、40.0、45.0 °C温度下溶液的旋光度,验证理论计算值的准确性。
3.3 测定蔗糖水解反应不同时刻的旋光度
(1) 分别在 25.0、30.0、35.0、40.0、45.0 °C 温度下,移取 25 mL 0.0400 g·mL−1蔗糖溶液和 25 mL 2 mol·L−1的盐酸溶液进行蔗糖水解反应实验,测量溶液旋光度随时间的变化情况。
(2) 根据旋光度的加和性,计算出体系中各组分浓度的变化,同时判断不同温度下蔗糖的转化程度。
3.4 测定蔗糖水解平衡时不同温度下的蔗糖转化率
用移液管分别移取 25 mL蔗糖溶液和 25 mL 2 mol·L−1的盐酸溶液于一个具塞三角瓶中,在60.0 °C恒温槽中反应0.5–4.5 h,取出后静置至室温,分别测量25.0、30.0、35.0、40.0、45.0 °C温度下的溶液旋光度。
4 数据处理
4.1 葡萄糖、果糖、蔗糖的比旋光度的测定
利用配置的蔗糖、葡萄糖、果糖储备溶液,在已知溶液浓度的情况下,测定其在不同温度下的旋光度,利用公式(4)可得到不同温度下蔗糖、葡萄糖、果糖的比旋光度。表1为得到的比旋光度结果,温度对蔗糖、葡萄糖、果糖的比旋光度具有明显的影响,温度升高,比旋光度减少。为了进一步验证表1中实验数据的准确性,我们参考《物理学常用数表》中的计算公式,分别得到了0.0400 g·mL−1蔗糖溶液在 25.0 和 30.0 °C 的比旋光度为 66.34°和 66.21°,0.0400 g·mL−1果糖溶液在 25.0 °C 的比旋光度为−89.08°[12]。与《物理学常用数表》中的数据进行比较,表1中蔗糖溶液的比旋光度偏差小于0.5%,果糖溶液的比旋光度偏差小于2.5%。

表1 蔗糖、葡萄糖、果糖溶液在不同温度下的比旋光度
4.2 验证“溶液的总旋光度等于各组分旋光度的代数和”
蔗糖水解过程中,葡萄糖和果糖的浓度始终是相等的,因此我们在验证溶液旋光度加和性时,利用蔗糖、葡萄糖和果糖的储备溶液分别配置了葡萄糖和果糖浓度相同的不同溶液,表2为配置的葡萄糖(或果糖) : 蔗糖浓度分别为1 : 2、1 : 1、1.5 : 1和4.04 : 1混合溶液中各组分的具体浓度。
将表1中计算得到的蔗糖、葡萄糖和果糖的比旋光度以及表2中各组分的浓度代入式(6)即可得到溶液的理论旋光度。同时,利用实验测得的实际旋光度对计算值进行验证。表3和图1为四种混合溶液在25.0、30.0、35.0、40.0、45.0 °C温度下利用公式(4)计算的旋光度值与溶液实验测定值之间的比较,利用公式(4)得到的理论值与实验值非常接近,这充分验证了公式(4)旋光度加和性的合理性。

图1 蔗糖水解过程中蔗糖浓度(a)、转化率(b)随时间的变化

表2 葡萄糖(或果糖) : 蔗糖浓度比为1 : 2、1 : 1、1.5 : 1和4.04 : 1混合溶液的组成

表3 不同温度下混合溶液旋光度加和性的验证
4.3 蔗糖水解过程中的蔗糖转化率
分别在 25.0、30.0、35.0、40.0、45.0 °C 温度下,移取 25 mL 0.0400 g·mL−1蔗糖溶液和 25 mL 2 mol·L−1的盐酸溶液进行蔗糖水解反应实验,测量溶液旋光度随时间的变化情况(表4)。

表4 不同温度下蔗糖水解反应过程中的旋光度
利用蔗糖水解过程中各组分浓度的变化情况,可以直接验证蔗糖水解反应级数:

式(8)中忽略了水及酸的变化对反应速率的影响,n为反应级数。在蔗糖水解反应中,蔗糖转化率较低时,更能体现蔗糖水解反应的本质,因此,我们取蔗糖转化率低于 50%时的数据分析蔗糖浓度c与反应时间t的相互关系。如图2所示,25.0、30.0、35.0、40.0、45.0 °C条件下lnc与t都成正比关系,即符合n= 1一级反应速率方程lnc= −kt+ lnc0的关系式。因此蔗糖水解反应对于蔗糖来说是一级反应,蔗糖水解反应速率与蔗糖的浓度成正比。
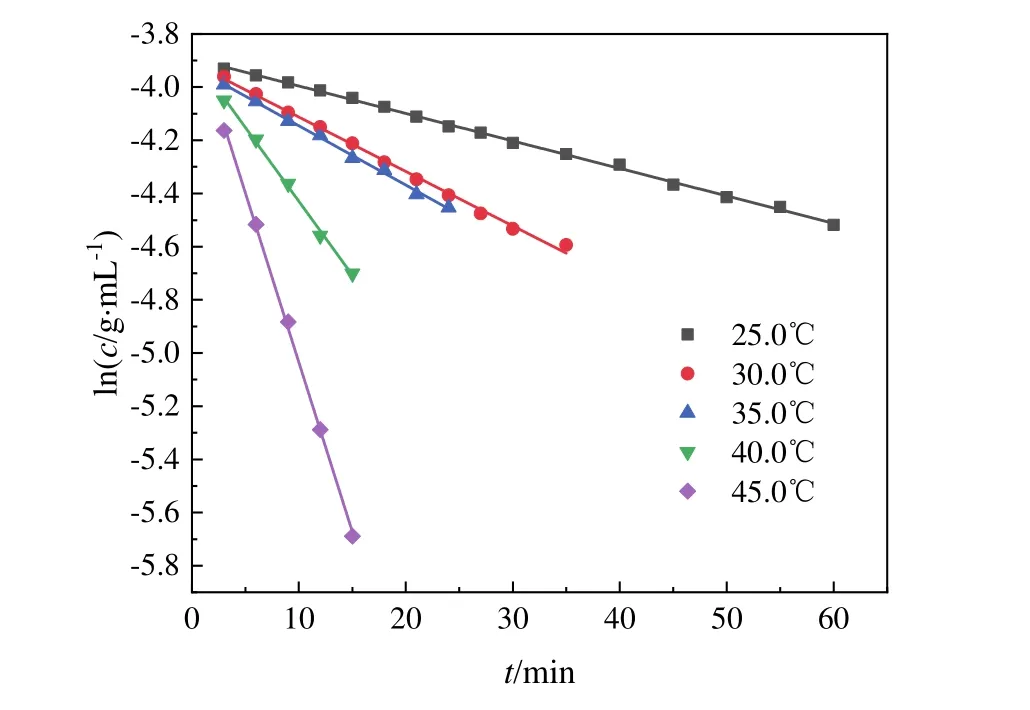
图2 蔗糖水解过程中lnc蔗糖与t成正比
图2中拟合直线的斜率,即为不同温度下蔗糖水解反应的速率常数k(表5)。随着温度的升高,蔗糖水解反应速率常数不断增大。如图3所示,蔗糖水解反应速率常数随温度的变化符合阿伦尼乌斯公式,lnk与1/T呈线性关系。
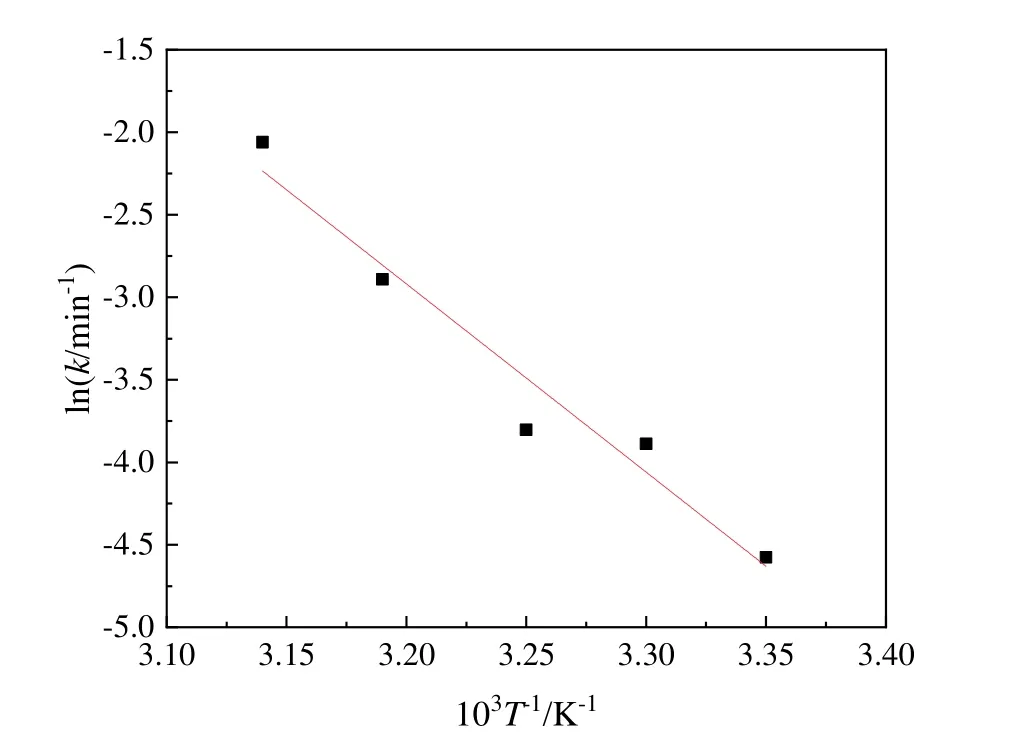
图3 蔗糖水解过程中lnk与1/T成正比

表5 不同温度下蔗糖水解反应的速率常数
4.4 反应平衡时蔗糖的转化率和反应平衡常数
在“旋光度法测蔗糖水解反应速率常数”的教学中,大部分教材都认为蔗糖能完全转化为葡萄糖和果糖,但蔗糖水解反应实际上是可逆反应,为什么可逆反应可以近似处理为完全反应,蔗糖水解终点时蔗糖的转化率是多少,温度变化对蔗糖水解反应平衡的影响如何,一直困扰着本实验的教学工作,也未见相关文献报道。利用表1中的比旋光度数据结合水解反应终点时的旋光度,可以对蔗糖水解反应的平衡终点进行分析,探讨蔗糖水解的可逆性、温度对平衡终点的影响等问题。
在当前的实验教学中,反应终点的旋光度α∞是由蔗糖水解溶液在60.0 °C条件下反应0.5 h后得到的。为了保证蔗糖反应达到最终的水解平衡,我们采用相同的方法探讨了蔗糖水解溶液在不同水解时间(60.0 °C下水解0.5、1.5和4.5 h)的平衡状态,将不同反应时间的蔗糖反应溶液冷却至室温,再在不同温度下测定相应的α∞。将蔗糖、葡萄糖和果糖的比旋光度蔗糖初始浓度0.0200 g·mL−1和测得的α∞代入式(6),同时联立式(7)获得反应平衡时的蔗糖浓度。利用水解平衡时蔗糖、葡萄糖和果糖的摩尔浓度可计算蔗糖水解反应的经验平衡常数:

为了避免室温及较高温度对实验结果的影响,我们只比较了蔗糖在30.0、35.0和40.0 °C温度下的水解平衡状态。表6、表7和表8分别显示了60.0 °C下蔗糖水解0.5、1.5和4.5 h后体系冷却至不同温度下的平衡状态。以表6为例进行分析,反应终点时蔗糖并没有完全转化为葡萄糖和果糖,仍有2%左右的蔗糖存在。温度对蔗糖水解终点具有较大的影响,随着温度升高,体系中蔗糖浓度不断增加,蔗糖转化率降低,水解平衡向逆反应方向移动,蔗糖水解的经验平衡常数不断降低,这与Goldberg等[13]证明的蔗糖水解属于放热反应相一致。虽然蔗糖水解反应为可逆反应,但蔗糖水解反应程度比较高,蔗糖水解平衡时,蔗糖的转化率β在98%左右,因此在实验教学中可以直接将蔗糖水解反应近似为完全反应。另外,对比表6、表7和表8,我们发现60.0 °C条件下反应0.5 h和反应4.5 h所得到的蔗糖转化率基本相同,这表明实际教学中用60.0 °C条件下反应0.5 h的蔗糖水解溶液进行蔗糖平衡终点的分析检测是完全合理的。

表6 蔗糖溶液60.0 °C下反应0.5 h的蔗糖浓度及蔗糖转化率

表7 蔗糖溶液60.0 °C下反应1.5 h的蔗糖浓度及蔗糖转化率

表8 蔗糖溶液60.0 °C下反应4.5 h的蔗糖浓度及蔗糖转化率
为了进一步验证蔗糖水解反应为可逆反应,我们将10 mL 0.02 g·mL−1果糖、10 mL 0.02 g·mL−1葡糖糖与20 mL 2 mol·mL−1盐酸溶液混合,在40.0 °C条件下对体系旋光度进行分析。结果发现,体系旋光度在8 min内迅速由−0.618°增大为−0.584°并保持稳定。利用表1中40.0 °C时各组分的比旋光度果糖和葡糖糖初始浓度0.0100 g·mL−1及体系稳定时的溶液旋光度−0.584°可求得体系平衡时生成的蔗糖为3.80 × 10−4g·mL−1。这充分表明蔗糖水解反应为可逆反应。
5 结语
本文对《旋光度法测蔗糖水解反应速率常数》实验进行了深入讨论,测定了葡萄糖、果糖和蔗糖在25.0、30.0、35.0和45.0 °C时的比旋光度,验证了溶液总旋光度等于各组分旋光度的代数和。同时利用溶液旋光度的加和性原理分析了蔗糖水解反应中溶液各组分的浓度变化,证明了教学实验中将蔗糖水解反应近似为一级反应的正确性。另外,对蔗糖水解反应终点进行分析,确定了溶液中蔗糖的剩余浓度,同时分析了温度对蔗糖转化率、反应平衡常数的影响,验证了蔗糖水解反应的可逆性,分析了当前实验教学中将蔗糖水解反应近似处理为完全反应的原因,拓展了蔗糖水解实验的教学内容,加深了学生对旋光度、化学反应级数、热力学动态平衡等知识的理解。
