2型猪链球菌二元信号系统孤儿调控因子CovR磷酸化位点鉴定
2021-06-03王悄悄李超龙张会芳刘旭苗汪春晖潘秀珍曹祥荣
王悄悄,李超龙,张会芳,刘旭苗,郑 峰,汪春晖,潘秀珍,曹祥荣
猪链球菌(Streptococcussuis,S.suis)是一种重要的人兽共患病病原菌,不仅可以通过上呼吸道感染猪,也可以通过皮肤伤口或经口途径感染人[1]。人感染该菌的临床症状表现为脑膜炎、败血症、关节炎、心内膜炎等,病死率高达12.8%,常见后遗症包括听力损失和前庭功能障碍[2]。S.suis血清型众多,目前较为公认的有29种[3-4],全世界已经报道了1 600余例人类感染病例,其中75%的病例是由2型猪链球菌(S.suis2)引起的[5]。S.suis2对公共健康造成了严重威胁,因此,对于S.suis2致病机制的研究具有重要意义。
CovR最早发现于化脓链球菌,通常与CovS(CsrS)共同组成二元信号转导系统(two-component signal transduction system,TCS),主要参与透明质酸荚膜合成基因hasAB的调控[5]。课题组前期对CovR的研究发现,CovR是全面调节基因表达的负调控因子,其调控的下游靶基因可能涉及多个已知毒力因子及潜在的毒力因子[6],然而,在S.suis2 05ZYH33基因组中未发现covS的同源基因,表明CovR是一个孤儿调控因子。近期,有研究发现丝/苏氨酸激酶可以对多种TCS发挥磷酸化调控,在无乳链球菌中STK1可以在体外对CovR/S的生物反应调节因子组分CovR进行磷酸化[7]。在S.suis2中也存在丝/苏氨酸激酶STK,研究表明STK通过磷酸化底物蛋白的丝氨酸/苏氨酸残基以达到调控靶蛋白的目的,从而在转录与翻译、细胞壁合成、细胞分裂、应激反应以及毒力因子的表达[8-11]等过程中发挥着重要作用。然而S.suis2编码的STK是否能对全局性毒力负调控因子CovR进行磷酸化作用尚不清楚。本研究参照Molle等[12]的实验方法,在E.coliBL21原核表达系统中共表达STK与CovR蛋白,旨在探讨STK对CovR的磷酸化作用以及寻找CovR关键磷酸化位点,为进一步探索CovR磷酸化机制及S.suis2的致病作用提供理论指导。
1 材料与方法
1.1菌株、质粒及引物S.suis2中国强毒株05ZYH33分离自2005年四川资阳中毒性休克症病人,实验室保存;E.coliDH5α、E.coliBL21(DE3)菌株购自北京全式金公司;pMD-19T购自日本TaKaRa公司;pCDFDuet-1购自美国Novagen公司;引物由上海赛百盛公司合成,碱基序列见表1。

表1 实验所用引物
1.2主要试剂与仪器 限制性内切酶BamH I、Hind III、XhoI、SalI、T4 DNA连接酶购自日本TaKaRa公司;DNA胶回收试剂盒购自美国Promega公司;Ni-NTA亲和层析柱购自南京金斯瑞公司;抗CovR蛋白单克隆抗体实验室保存[13];抗苏/丝/酪氨酸磷酸化抗体、羊抗兔(鼠)IgG(HRP标记)购自北京Bioss公司;ECL化学发光试剂盒购自美国Thermo Scientific公司。
1.3重组表达质粒的构建及鉴定 以S.suis2 05ZYH33基因组DNA为模板,分别以covR-F/covR-R、stk-F/stk-R为引物,PCR扩增目的基因covR和stk,随后使用DNA胶回收试剂盒对PCR产物进行回收。回收的covR片段和pCDFDuet-1质粒经BamH I、Hind III双酶切、T4 DNA连接酶连接并转化至E.coliDH5α后,获得pCDFDuet-1::covR重组质粒(其表达产物命名为CovR1)。将上述pCDFDuet-1::covR重组质粒和stk片段经NdeI、XhoI双酶切连接转化后获得pCDFDuet-1::covR/stk重组质粒(其表达产物命名为CovR2)。pCDFDuet-1::covR、pCDFDuet-1::covR/stk质粒经酶切验证正确后送苏州金唯智公司测序。共表达质粒pCDFDuet-1::covR/stk构建示意图见图1。
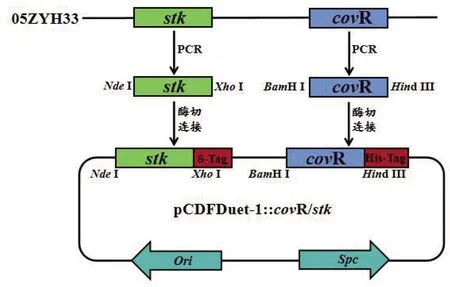
图1 共表达质粒pCDFDuet-1::covR/stk构建示意图
1.4重组蛋白的表达纯化 将构建好的重组质粒pCDFDuet-1::covR和pCDFDuet-1::covR/stk分别转化至E.coliBL21(DE3)感受态细胞,得到BL21-pCDFDuet-1::covR及BL21-pCDFDuet-1::covR/stk重组蛋白表达菌株。将上述重组表达菌转接于新鲜LB液体培养基(Spc抗性)中振荡培养至OD600≈0.6,添加IPTG(终浓度为1 mmol/L)进行诱导。诱导结束后,进行超声破碎(300 W,超5 s,停5 s),离心收集蛋白上清液,并使用Ni-NTA亲和层析柱进行蛋白纯化,对纯化后的CovR1、CovR2重组蛋白进行12% SDS-PAGE电泳鉴定。
1.5重组蛋白的Western blot鉴定及磷酸化检测 将CovR1、CovR2蛋白进行12% SDS-PAGE电泳,使用电转印(湿转恒流300 mA,60 min)将蛋白转移至PVDF膜上,以本实验室保存的抗CovR蛋白单克隆抗体为一抗,羊抗鼠IgG(HRP标记)为二抗,对上述CovR1、CovR2蛋白进行特异性检测。另外,以抗苏氨酸磷酸化抗体为一抗,以羊抗兔IgG(HRP标记)为二抗,对CovR1、CovR2蛋白进行磷酸化检测。
1.6CovR蛋白磷酸化位点质谱检测 将纯化后的CovR2蛋白进行12% SDS-PAGE电泳,用考马斯亮蓝R-250染色液染色10 min,脱色液脱色2 h,割取目的条带送北京华大蛋白质研发中心有限公司进行磷酸化质谱鉴定。
1.7定点突变质粒构建 根据质谱检测结果,利用全基因合成技术合成covR基因点突变序列使CovR蛋白的潜在磷酸化位点突变为丙氨酸。covR基因点突变序列有以下4种:covRT(CovR中Thr磷酸化位点突变为Ala)、covRS(CovR中Ser磷酸化位点突变为Ala)、covRY(CovR中Tyr磷酸化位点突变为Ala)、covRA(CovR中所有磷酸化位点突变为Ala)。将4种covR基因点突变序列与pCDFDuet-1::stk质粒连接后转化至E.coliDH5α中,涂布到含Spc抗性(100 μg/mL)的LB固体琼脂培养基上,PCR验证阳性克隆后,提取质粒送至苏州金唯智公司测序,将测序正确的质粒分别命名为pCDFDuet-1::stk/covRT、pCDFDuet-1::stk/covRS、pCDFDuet-1::stk/covRY、pCDFDuet-1::stk/covRA。
1.8定点突变蛋白的诱导表达及纯化 将上述4种突变重组质粒转化至表达菌株E.coliBL21(DE3)中,并分别接种于新鲜LB液体培养基进行培养,按上述1.4步骤中蛋白纯化方案进行定点突变蛋白的诱导表达及纯化。纯化后的重组突变蛋白分别命名为CovRT、CovRS、CovRY及CovRA。
1.9定点突变蛋白的Western blot鉴定及磷酸化检测 参照步骤1.5,使用抗CovR蛋白单克隆抗体对CovRT、CovRS、CovRY及CovRA 4种突变蛋白进行Western blot鉴定,检测纯化后突变蛋白的特异性。另外,分别用抗苏/丝/酪氨酸磷酸化抗体对4种突变蛋白进行磷酸化检测,以鉴定突变蛋白的磷酸化特性。
2 结 果
2.1CovR重组表达质粒的酶切验证 对pCDFDuet-1::covR重组质粒进行BamH I/Hind III双酶切及BamH I单酶切验证,单酶切条带大小在4 500 bp左右,双酶切条带大小在500~750 bp、3 000~4 500 bp之间,与预期大小4 468 bp、687 bp、3 781 bp相符(图2A)。对pCDFDuet-1::covR/stk进行NdeI单酶切鉴定,单酶切条带大小在4 500 bp之上,与预期大小6 460 bp相符(图2B)。结果表明上述两个重组表达质粒构建成功。

A: M.DNA maker; 1.Plasmid pCDFDuet-1::covR; 2.BamH I digestion; 3.BamH I/Hind III digestion;B: M.DNA maker; 1.Plasmid pCDFDuet-1::covR/stk; 2.Nde I digestion
2.2CovR1、CovR2蛋白纯化 对纯化后的CovR1、CovR2重组蛋白进行12% SDS-PAGE电泳,蛋白条带在25 kDa附近,与预期大小26 kDa相符,且蛋白条带单一,说明纯化后的重组蛋白纯度较高(图3A)。
2.3CovR1、CovR2蛋白Western blot鉴定与磷酸化检测 使用抗CovR蛋白单克隆抗体和特异抗苏氨酸磷酸化抗体分别对CovR1、CovR2重组蛋白进行Western blot鉴定。在25 kDa附近有明显的蛋白印记条带,与目的蛋白大小(26 kDa)相符,说明CovR1、CovR2重组蛋白均可以与抗CovR蛋白单克隆抗体发生特异性反应,表明CovR1、CovR2蛋白纯化成功(图3 B)。CovR1蛋白与抗苏氨酸磷酸化抗体孵育后没有目的条带,而CovR2蛋白在相应位置处有目的条带,说明单独表达的CovR1蛋白未发生苏氨酸磷酸化,而与STK蛋白共同表达的CovR2蛋白可以被磷酸化(图3C)。结果表明CovR与STK在E.coliBL21(DE3)中共表达后,CovR发生了磷酸化修饰。
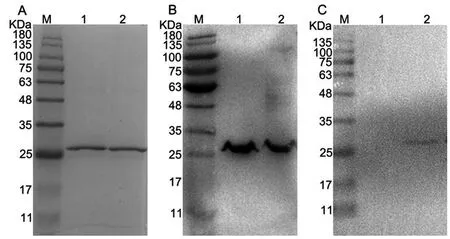
A: M.Protein marker; 1.CovR1; 2.CovR2;B: Anti-CovR monoclonal antibody; 1.CovR1; 2.CovR2;C: Anti-phosphothreonine antibody; 1.CovR1; 2.CovR2
2.4CovR2蛋白磷酸化位点的质谱检测 将纯化的CovR2进行蛋白磷酸化质谱检测,发现CovR2蛋白的第45、148、150、159、168、194、219位苏氨酸,第40、172、215位丝氨酸以及第225位酪氨酸发生了磷酸化修饰。
2.5CovR定点突变蛋白表达与纯化 构建pCDFDuet-1::stk/covRT、pCDFDuet-1::stk/covRS、pCDFDuet-1::stk/covRY、pCDFDuet-1::stk/covRA重组质粒,经IPTG对诱导表达后纯化CovRT(第45、148、150、159、168、194、219位Thr替换为Ala)、CovRS(第40、172、215位Ser替换为Ala)、CovRY(第225位Tyr替换为Ala)、CovRA(所有磷酸化位点替换为Ala),对其进行12% SDS-PAGE鉴定,4种突变蛋白电泳条带单一,说明纯化的突变蛋白纯度较高,条带均在25 kDa上方,与预期大小26 kDa相符(图4A)。使用抗CovR单克隆抗体对4种突变蛋白进行Western blot鉴定,均出现单一条带,且条带大小与预期相符(图4B)。结果表明CovRT、CovRS、CovRY、CovRA定点突变蛋白纯化成功。
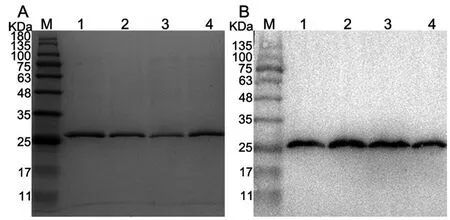
A: M.Protein marker; 1.CovRT; 2.CovRS; 3.CovRY; 4.CovRA;B: Anti-CovR monoclonal antibody; 1.CovRT; 2.CovRS; 3.CovRY; 4.CovRA
2.6CovR关键磷酸化位点鉴定 使用特异抗苏氨酸磷酸化抗体对纯化的CovRT、CovRS、CovRY、CovRA定点突变蛋白进行苏氨酸磷酸化检测,结果显示只有CovRS和CovRY可以被磷酸化,而CovRT和CovRA未检测到磷酸化信号,说明45、148、150、159、168、194、219位苏氨酸为CovR磷酸化位点。使用特异抗丝氨酸磷酸化抗体对4种突变蛋白检测,结果显示只有CovRT和CovRY可以被磷酸化,而CovRS和CovRA未检测到磷酸化信号,说明40、172、215位丝氨酸为CovR磷酸化位点。使用特异抗酪氨酸磷酸化抗体对4种突变蛋白检测,结果显示只有CovRT、CovRS可以被磷酸化,而CovRY、CovRA未检测到磷酸化信号,说明225酪氨酸是CovR磷酸化位点。以上结果表明CovR的丝/苏/酪氨酸均可发生磷酸化修饰(图5)。

A: Anti-phosphothreonine antibody; B: Anti-phosphoserine antibody; C: Anti-phosphotyrosine antibody;M: Protein marker; 1: CovR1; 2: CovR2; 3: CovRT; 4: CovRS; 5: CovRY; 6: CovRA
3 讨 论
实验室前期研究发现S.suis2 05ZYH33株基因组中存在反应调节因子CovR。构建covR敲除突变株,发现突变株的毒力和致病性明显增强;比较野毒株和突变株的转录谱,发现突变株中有195个基因(占全基因组的8.9%)的转录水平发生了变化,其中193个基因呈上调表达,而2个基因呈下调表达。研究结果表明,在猪链球菌中CovR是全面调节基因表达的负调控因子[6]。除此之外,还通过基因克隆、杂交瘤技术制备了CovR重组蛋白和CovR单克隆抗体[13];采用多种技术筛选到两个CovR直接调控的靶基因[14],并对多个受CovR调控的靶基因的生物学功能进行了研究[15-18]。
CovR通常与CovS(CsrS)共同组成二元信号系统,CovS/CovR最初是作为透明质酸荚膜合成基因hasAB的负调控子而被发现的[5],随后发现它不仅对透明质酸荚膜的产生起着负调控作用,还对外毒素、溶血素、链激酶、链道酶等其它毒力因子的转录表达起负调控作用[19]。课题组前期对S.suis2 05ZYH33株基因组进行分析,并未发现编码CovS的同源基因,表明CovR在S.suis2中是一个孤儿调控因子。近期研究表明,在化脓链球菌中CovR作为负反应调节因子参与毒力因子的调控,通过质谱以及定点突变证实丝氨酸/苏氨酸激酶STK可以使CovR蛋白的第65位苏氨酸磷酸化[20]。在无乳链球菌中,STK1使CovR蛋白的第65位苏氨酸磷酸化,磷酸化后的CovR不能与其靶基因的启动子结合[21]。以上研究证实了在细菌中丝/苏氨酸激酶系统与TCS系统之间存在交互作用,提示我们在S.suis2中丝/苏氨酸激酶STK也有可能使CovR磷酸化,从而调节CovR蛋白的活性。
本研究将CovR与STK蛋白在E.coliBL21原核表达系统中共表达,通过对CovR2蛋白进行磷酸化质谱检测,发现第45、148、150、159、168、194、219位苏氨酸,第40、172、215位丝氨酸以及第225位酪氨酸为CovR蛋白的磷酸化位点。利用全基因合成技术合成covR基因点突变序列,使CovR蛋白的潜在磷酸化位点突变为丙氨酸,并对定点突变蛋白进行苏氨酸、丝氨酸以及酪氨酸磷酸化检测。苏氨酸磷酸化检测结果显示CovRS、CovRY磷酸化信号仍然存在,CovRT、CovRA的磷酸化信号消失;丝氨酸磷酸化检测结果显示CovRT、CovRY磷酸化信号仍然存在,CovRS、CovRA的磷酸化信号消失;酪氨酸磷酸化检测结果显示,CovRS、CovRT磷酸化信号仍然存在,CovRY、CovRA的磷酸化信号消失。CovR定点突变蛋白的磷酸化检测结果证实了CovR蛋白的丝/苏/酪氨酸残基均可发生磷酸化。除此之外,由于结果显示CovR2蛋白酪氨酸残基也发生了磷酸化,提示STK蛋白可能具有酪氨酸激酶的特性,但CovR是否作为STK直接磷酸化修饰作用底物,仍需要进一步深入研究。
本研究利用共表达载体在E.coliBL21原核表达系统中初步探究了丝/苏氨酸激酶STK与CovR的磷酸化关系,通过蛋白磷酸化质谱技术以及对定点突变蛋白磷酸化检测确定了孤儿调控因子CovR的关键磷酸化位点,为在2型猪链球菌中进一步探索CovR的磷酸化机制奠定了基础。
利益冲突:无
