原花青素B2诱导乳腺癌MCF-7细胞凋亡 及其作用机制
2021-06-03薛宏坤谭佳琪唐劲天
薛宏坤,谭佳琪,李 倩,*,唐劲天,*
(1.清华大学工程物理系,粒子与辐射成像教育部重点实验室,北京 100084;2.北京大学前沿交叉学科研究院,北京 100080)
正常细胞的生长、代谢及增殖分化都受机体严格而有序的调控,而癌变细胞则不受机体控制,会恶性增殖分化,破坏机体正常的生理功能,进而诱发机体死亡。其中,乳腺癌是恶性肿瘤之一,其严重危害女性身体健康,发病率位居女性恶性肿瘤的首位[1]。尽管乳腺癌的综合治疗水平在不断提高,但其致死率仍然位居女性肿瘤的第2位。目前主要有6 种常见的乳腺癌类型,由于乳腺癌的种类不同,治疗手段也不尽相同,但手术、化疗、放疗及药物治疗仍作为治疗乳腺癌的主要手段。超过90%的乳腺癌都是非转移的,对于非转移的乳腺癌,治疗方法一般是手术切除。手术虽可以局部切除肿瘤,但不能根除肿瘤组织,患者术后有可能复发,复发会导致患者的死亡率显著提升。因此,仅仅通过手术的手段已经不能满足康复需要;为降低术后乳腺癌的复发率,一般采用放疗方法对局部组织进行治疗;而对于转移性病灶主要采用抗肿瘤药物的治疗,其中阿帕替尼、紫杉醇、紫杉烷加曲妥珠单抗和帕妥珠单抗是目前治疗转移性乳腺癌的一线药物[2]。但由于上述的临床药物毒副作用较大,患者长期服用产生诸多的不良反应,并且肿瘤细胞会对之产生很强的耐药性,由于药物的局限性,使其应用受到限制。因此,寻找一种毒副作用小、抗肿瘤活性强的天然抗肿瘤药物来预防或治疗乳腺癌已成为当前研究热点。
原花青素属于天然黄酮类化合物,广泛存在于蔬菜、水果和绿色植物茎叶中。原花青素是由单体、低聚和高聚合原花青素组成的化合物[3],其中原花青素B2(procyanidin B2,PCB2)是原花青素二聚体中活性最强和来源最广泛的一类化合物,其结构如图1所示。其独特的结构使PCB2具有强烈的清除体内过量自由基、抗氧化、抗炎及抗肿瘤等功效[4-5],对人体健康十分有益。例如,Kim等[6]研究发现苹果中PCB2能够有效清除自由基,同时具有较强的还原性;Tanaka等[7]研究发现PCB2通过下调T细胞表达T盒和视黄酸相关孤儿受体γt蛋白表达,从而抑制T细胞产生干扰素γ和白细胞介素17, 达到较好的抗炎效果;Gopalakrishnan等[8]的研究结果 表明,PCB2能抑制癌细胞中纯化蛋白酶体和蛋白酶体的催化活性,但对正常细胞没有抑制作用,同时减少前列腺癌细胞的增殖及降低前列腺癌细胞裂解物中抗凋亡和血管生成标记物的表达;Feng Jiao等[9]研究发现PCB2可调节人肝星状细胞体内外血管内生长因子A、低氧诱导因子1α、α-平滑肌肌动蛋白、人I型胶原蛋白和转化生长因子β1蛋白的表达,从而达到抑制人肝星状细胞的增殖,诱导其凋亡。孙思明等[10]研究结果表明,山楂中PCB2可通过降低SMMC-7721细胞中抗氧化酶活力和抑制凋亡相关蛋白表达,达到抑制细胞增殖和促进细胞凋亡的功效。通过以上研究发现,PCB2具有较好的抗炎和抗肿瘤活性,但目前关于PCB2对人乳腺癌MCF-7细胞的抗肿瘤活性及其分子机制尚不明确。
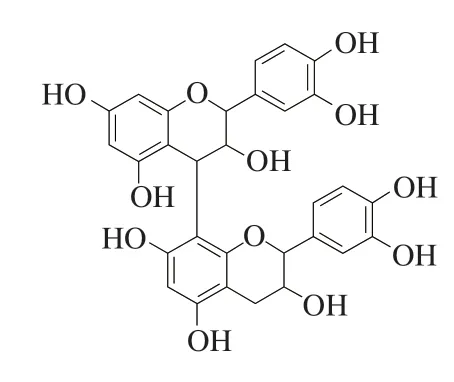
图 1 PCB2化学结构式Fig. 1 Chemical formula of PCB2
鉴于此,本研究采用PCB2处理人乳腺癌MCF-7细胞,探究PCB2抗肿瘤活性及其机制。首先通过噻唑蓝(methyl thiazolyl tetrazolium,MTT)法测定不同浓度PCB2和不同处理时间对MCF-7细胞存活率的影响;然后通过激光共聚焦显微镜检测细胞内Ca2+浓度变化并观察Hoechst 33342染色后的细胞凋亡形态,同时利用流式细胞分析仪检测PCB2对MCF-7细胞凋亡率、周期、胞内活性氧(reactive oxygen species,ROS)水平及线粒体膜电位变化的影响;最后通过Western blot检测不同浓度PCB2对MCF-7细胞凋亡相关蛋白表达量的影响。以期为乳腺癌的治疗提供植物源的天然抗肿瘤候选药物,同时为功能性食品的开发提供研究参考。
1 材料与方法
1.1 材料与试剂
PCB2(纯度≥99.8%) 鼎瑞化工(上海)有限公司;人乳腺癌MCF-7细胞 北京协和细胞资源中心;二甲基亚砜(dimethyl sulfoxide,DMSO) 山东西亚化学工业有限公司;双抗(青霉素/链霉素) 上海源叶生物科技有限公司;DMEM高糖培养基、胎牛血清(fetal bovine serum,FBS) 美国Sigma公司;胰蛋白酶消化液 北京百华百汇生物科技有限公司;BCA蛋白浓度测定试剂盒、RIPA细胞裂解液 深圳市瑞吉特生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS) 上海盛思生化科技有限公司;JC-1线粒体膜电位检测试剂盒、ROS检测试剂盒 南京建成生物工程研究所;Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡和周期检测试剂盒 西格玛奥德里奇(上海)贸易有限公司;Bcl-2、Bax、细胞色素c、Caspase-3/12和β-actin抗体 美国CST公司;其余试剂均为分析纯。
1.2 仪器与设备
LSM 800激光共聚焦扫描显微镜 北京普瑞赛司仪器有限公司;JC-1086C Pro全自动酶标分析仪 青岛聚创环保仪器有限公司;CO2恒温培养箱 赛默飞世尔科技(中国)有限公司;ZE5流式细胞分析仪 美国 Bio-Rad公司;SW-CJ-2D超净工作台 杭州艾普仪器设备有限公司。
1.3 方法
1.3.1 细胞培养
将MCF-7细胞接种于含10% FBS和1%双抗的DMEM培养基中,然后于37 ℃、5% CO2恒温培养箱中培养。当MCF-7细胞铺满培养皿底70%~80%时进行传代,采用对数期细胞进行后续实验。
1.3.2 MTT法测定细胞活力
将对数期MCF-7细胞(1×104个/孔)接种于96 孔板中,每孔200 µL。在37 ℃、5% CO2条件下培养24 h,待细胞完全贴壁时,弃上清液,换为含PCB2终浓度分别为10、20、40、80 μmol/L的完全培养液(PCB2实验组);同时将不含PCB2、与实验组等体积的完全培养基设为对照组。每个浓度设置6 个复孔。在37 ℃、5% CO2条件下分别培养24、48、72 h后,每孔加入20 µL 5 mg/mL MTT培养4 h,弃上清液,然后每孔再加入150 µL DMSO,振荡15 min,用酶标仪测定490 nm波长处吸光度,并计算药物的半数抑制浓度(half maximal inhibitory concentration,IC50)。按式(1)计算细胞存活率[11]。
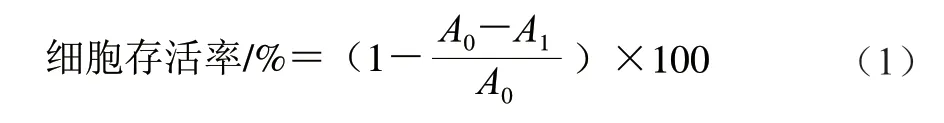
式中:A0为对照组吸光度;A1为不同浓度PCB2实验组吸光度。
1.3.3 不同浓度PCB2处理MCF-7细胞内Ca2+浓度的检测
按照细胞密度为2×105个/孔将对数期MCF-7细胞接种于6 孔板,每孔2 mL,在37 ℃、5% CO2条件下培养24 h,待细胞贴壁后,按照1.3.2节给药方式加入PCB2,同时设置对照,培养48 h,收集细胞,然后用PBS重悬细胞,以 1000 r/min离心5 min,弃去上清液,加入200 μL 4 μg/mL钙离子荧光探针Fluo-3/AM,在37 ℃下避光孵育1 h,用预冷的PBS洗涤3 次,然后再加400 μL PBS重悬细胞,用尼龙网过滤后,采用激光共聚焦扫描显微镜检测样品绿色荧光强度。Ca2+浓度以绿色荧光强度表示。
1.3.4 不同浓度PCB2处理MCF-7细胞内ROS水平的测定
利用2,7-二氯二氢荧光素二乙酸酯(2’,7’-dichlorodihydro fluorescein diacetate,DCFH-DA)荧光探针检测不同浓度PCB2对MCF-7细胞内ROS水平的影响。按照细胞密度为2×105个/孔将对数期MCF-7细胞接种于6 孔板中,每孔2 mL,培养24 h,待细胞贴壁后,按照1.3.2节给药方式加入PCB2,同时设置对照,每个浓度设3 个复孔,培养48 h后,每孔加入终浓度5 µmol/L DCFH-DA荧光探针,避光反应20 min,吸取探针,细胞用PBS洗涤2 次,随后利用胰蛋白酶消化,离心去除上清液,PBS重悬,并采用流式细胞分析仪测定每孔样品的荧光强度。ROS水平以绿色荧光强度表示。
1.3.5 Hoechst 33342染色法观察细胞凋亡形态
将对数期MCF-7细胞(2×105个/孔)接种在盖玻片6 孔板中,每孔2 mL,在37 ℃、5% CO2条件下培养24 h,待细胞贴壁后,按照1.3.2节给药方式加入PCB2,同时设置对照,培养48 h后,吸去培养基,用预冷PBS洗涤3 次,然后每孔加入1 mL 4%多聚甲醛溶液固定1 h,弃去固定液,用预冷PBS洗涤3 次,然后加入终质量浓度为5 mg/L Hoechst 33342染液,37 ℃避光染色15 min,取出盖玻片,用滤纸吸干盖玻片底部,将其置于激光共聚焦显微镜下观察并拍照。
1.3.6 不同浓度PCB2处理MCF-7细胞凋亡率、周期分布和线粒体膜电位的测定
将对数期MCF-7细胞以2×105个/孔接种于6 孔板,每孔2 mL,在37 ℃、5% CO2条件下培养24 h,待细胞贴壁后,按照1.3.2节给药方式加入PCB2,同时设置对照,培养48 h,收集细胞,然后用PBS洗涤2 次。分别取2×105个MCF-7细胞,每份样本加入5 μL Annexin V染液和10 μL PI染液,4 ℃避光染色30 min,通过流式细胞分析仪检测MCF-7细胞凋亡率。
用上述相同方法收集细胞,分别取1×105个MCF-7细胞,在4 ℃条件下采用1 mL体积分数70%乙醇溶液固定,静置过夜后,1000 r/min离心5 min,除去固定液,用预冷的PBS洗涤3 次后,加入100 μL 100 μg/mL RNA酶,在37 ℃下消化30 min,然后加入100 μL 50 μg/mL PI染色液,在4 ℃下避光染色30 min,通过流式细胞分析仪检测MCF-7细胞周期分布。
用上述相同方法收集细胞,然后加入终质量浓度为10 μg/mL JC-1染色液,避光孵育30 min,随后用预冷的PBS洗涤3 次,再加入PBS重悬细胞,将其置于流式细胞分析仪检测每个样品线粒体膜电位。线粒体膜电位以JC-1单体与聚合体荧光强度比值表示。
1.3.7 Western bolt测定不同浓度PCB2处理MCF-7细胞凋亡相关蛋白表达量
将对数期MCF-7细胞接种于60 mm细胞培养皿,在37 ℃、5% CO2条件下培养24 h,按照1.3.2节给药方式加入PCB2,同时设置对照,培养48 h,随后加入100 µL RIPA细胞裂解液提取细胞总蛋白,利用BCA试剂盒测定总蛋白质量浓度。测定后取20 µL蛋白样品上样于质量分数5%~10%的十二烷基硫酸钠-聚丙烯酰胺电泳凝胶中进行分离,冰浴下将其转移至聚偏氟乙烯膜上,采用5%脱脂奶粉在25 ℃下摇床封闭1 h,加入对应的一抗4 ℃孵育过夜,次日换为辣根过氧化物酶标记的二抗孵育1 h。采用电化学发光显影,然后通过凝胶成像检测Bcl-2、Bax、细胞色素c、Caspase-3/12和β-actin的蛋白表达水平。结果采用Image Lab软件对相应蛋白表达水平进行定量分析。
1.4 数据处理与分析
每组实验重复3 次,结果均用平均值±标准差表示;采用Statistix8.0软件对每组实验数据进行方差分析,并分析差异显著性(P<0.05表示差异显著);采用Origin 9.0软件绘图。
2 结果与分析
2.1 不同处理时间下不同浓度PCB2对MCF-7细胞存活率的影响
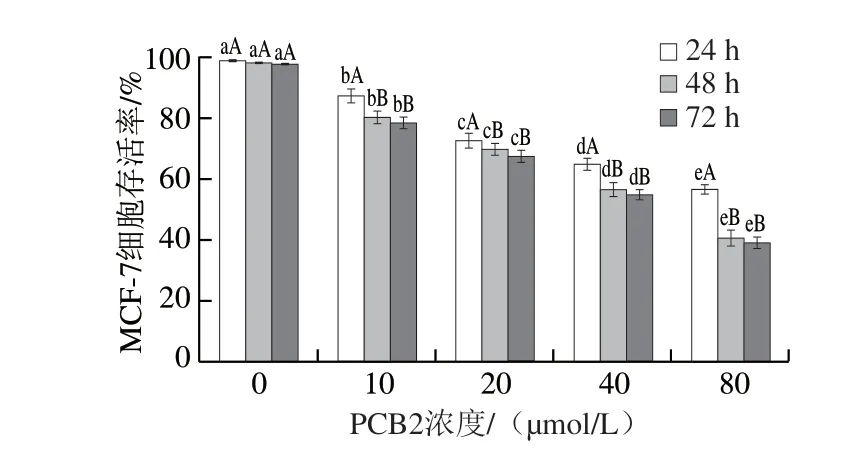
图 2 不同浓度PCB2和处理时间对MCF-7细胞存活率的影响Fig. 2 Effect of PCB2 at different concentrations and treatment times on the survival rate of MCF-7 cells
由图2可知,当处理时间分别为24、48 h和72 h时,MCF-7细胞存活率均随PCB2浓度增加呈显著降低趋势(P<0.05),并呈浓度依赖性。当PCB2浓度在10~80 μmol/L范围时,用相同浓度的PCB2处理MCF-7细胞,处理24 h后MCF-7细胞存活率显著低于处理48 h和72 h(P<0.05),而处理48 h和处理72 h相比,MCF-7细胞存活率无显著差异(P>0.05)。因此,对PCB2处理MCF-7细胞48 h组作进一步分析。通过计算得到PCB2处理24、48 h和72 h对MCF-7细胞存活率的IC50分别为114.82、57.15 μmol/L和55.64 μmol/L,表明处理时间越长,IC50越小,对MCF-7细胞的杀伤能力越强。MTT实验结果表明PCB2能有效抑制人乳腺癌MCF-7细胞的生长,且呈现浓度依赖性。
2.2 不同浓度PCB2处理对MCF-7细胞内Ca2+浓度变化的影响
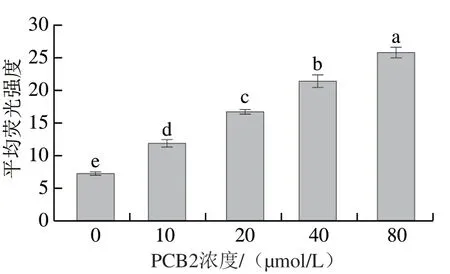
图 3 不同浓度PCB2处理对MCF-7细胞内Ca2+浓度变化的影响Fig. 3 Effect of different concentrations of PCB2 on the change of Ca2+ concentration in MCF-7 cells
机体在正常情况下,Ca2+具有维持线粒体膜通透性的作用。Ca2+失衡会造成内质网正常转运被破坏,大量未折叠或错误折叠蛋白聚集,从而引发内质网应激,导致胞内过量ROS的产生,进而释放细胞色素c,最终诱导细胞发生凋亡[12-13]。由图3可知,与对照组相比,不同浓度PCB2处理MCF-7细胞48 h后,MCF-7细胞内Ca2+浓度显著上升(P<0.05),呈浓度依赖性。结果表明,PCB2处理会造成MCF-7细胞内Ca2+失衡,破坏内质网功能,诱发细胞凋亡,从而起到抗肿瘤效果。
2.3 不同浓度PCB2处理对MCF-7细胞内ROS水平的影响
线粒体是ROS产生的主要细胞器,机体在正常状态下,ROS产生和清除处于动态平衡过程,适量ROS不仅能提高巨噬细胞的吞噬能力,而且能显著提高机体的免疫能力[14-15]。但细胞受到外界应激刺激时,线粒体膜电位发生变化,使细胞内Ca2+失衡,进而诱发大量ROS产生,细胞内过量的ROS会对细胞膜、蛋白质和核酸造成氧化损伤,最终导致细胞凋亡[16-17]。由图4可知,与对照组相比,不同浓度PCB2处理48 h后,MCF-7细胞内ROS水平显著升高(P<0.05),且PCB2浓度越大,MCF-7细胞内ROS水平越高。结果表明,PCB2能显著提高MCF-7细胞内ROS水平,过量ROS释放到胞质中破坏MCF-7细胞,从而抑制MCF-7细胞增殖,诱发细胞凋亡。
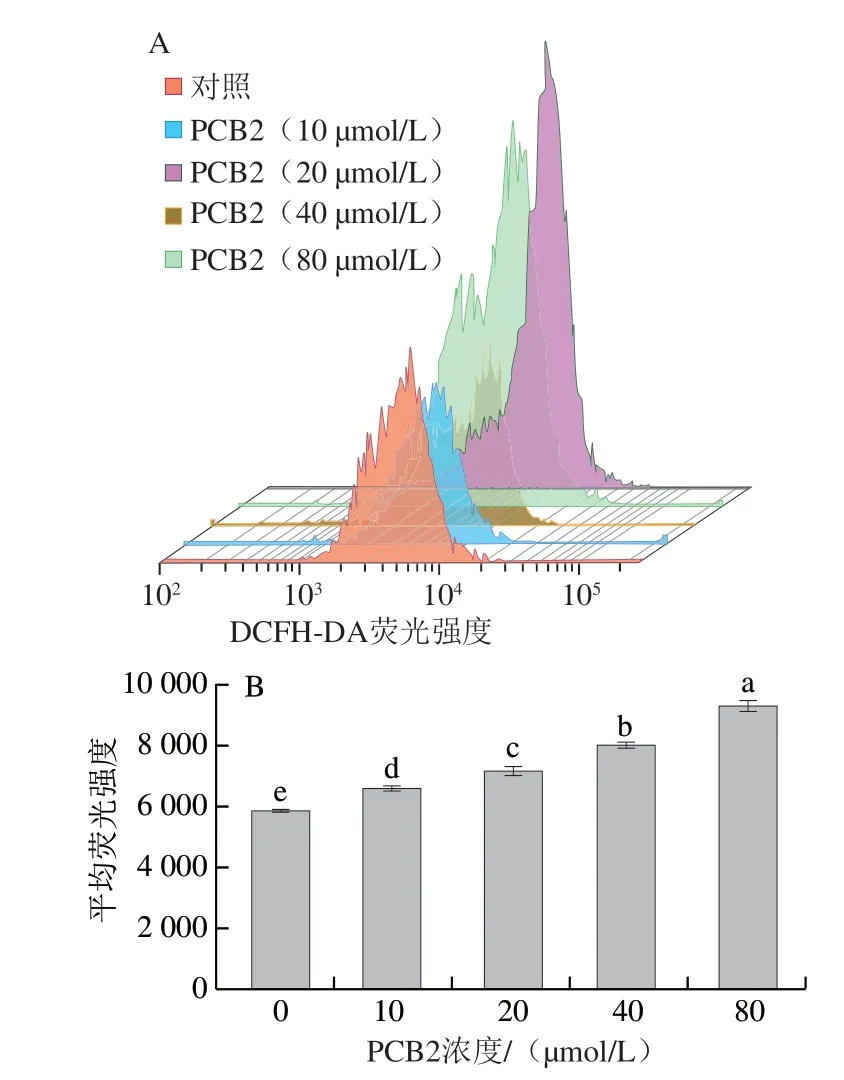
图 4 不同浓度PCB2处理对MCF-7细胞内ROS水平的影响Fig. 4 Effect of different concentrations of PCB2 on ROS levels in MCF-7 cells
2.4 不同浓度PCB2处理对MCF-7细胞凋亡形态的影响

图 5 共聚焦显微镜观察不同浓度PCB2作用下MCF-7细胞 凋亡形态的变化(×100)Fig. 5 Changes in apoptosis morphology of MCF-7 cells treated with different concentrations of PCB2 under confocal microscope (× 100)
PCB2能使MCF-7细胞内Ca2+浓度显著上升,同时显著提高胞内ROS水平。大量研究表明Ca2+失衡和过量的ROS均会诱导细胞发生凋亡[18-19]。为从另一方面进一步验证PCB2是否能够诱导MCF-7细胞发生凋亡,本实验通过Hoechst 33342染色法观察MCF-7细胞凋亡形态。由图5可知,随PCB2浓度(10~80 μmol/L)的增加,细胞数量相较于对照组明显减少,不规则细胞数量增多,细胞核蓝色荧光强度明显增强,并伴有凋亡小体的产生,且具有浓度依赖效应。通过上述实验结果可知,PCB2可通过诱导MCF-7细胞凋亡进而抑制其生长。
2.5 不同浓度处理PCB2对MCF-7细胞凋亡率的影响

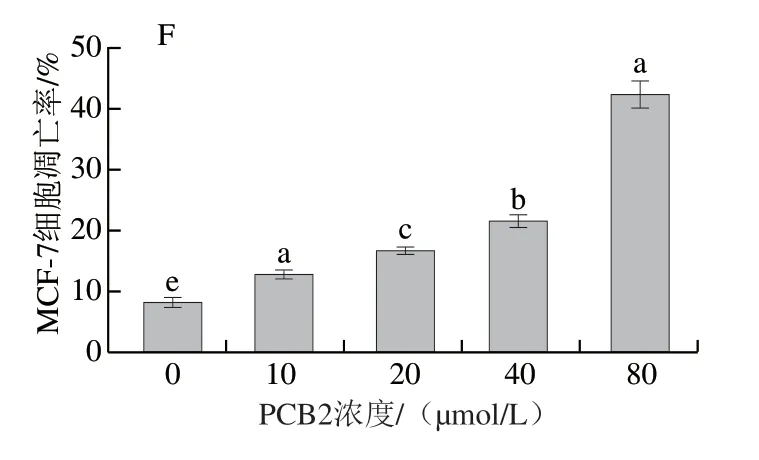
图 6 不同浓度PCB2处理对MCF-7细胞凋亡的影响Fig. 6 Effect of different concentrations of PCB2 on apoptosis of MCF-7 cells
大量研究已表明PCB2具有较强的抗氧化和清除自由基的能力[20-21],对癌细胞的增殖同样具有显著的抑制作用,可加速癌细胞的凋亡[22-23]。因此,本实验在MTT和Hoechst 33342染色法观察MCF-7细胞凋亡形态的基础上,采用流式分析仪进一步探究不同浓度PCB2对MCF-7细胞凋亡率的影响。由图6可知,随PCB2浓度的增加,MCF-7细胞凋亡率显著增加(P<0.05),且呈浓度依赖效应。当PCB2浓度为10、20、40、80 μmol/L 时,MCF-7细胞凋亡率分别为(12.85±0.65)%、(16.71±0.57)%、(21.43±1.12)%和(42.29±2.15)%;与对照组相比,细胞凋亡率分别提高了4.69%、8.55%、13.27%和34.13%。结果表明PCB2可通过抑制MCF-7细胞增殖加速细胞凋亡,且浓度越大效果越显著。Miura[24]和Yin Wenbin[25]等的研究同样发现PCB2能显著提高癌细胞凋亡率,其作用机制可能是通过上调促凋亡相关蛋白表达水平和下调凋亡抑制因子,从而加速癌细胞凋亡。
2.6 不同浓度PCB2处理对MCF-7细胞周期分布的影响

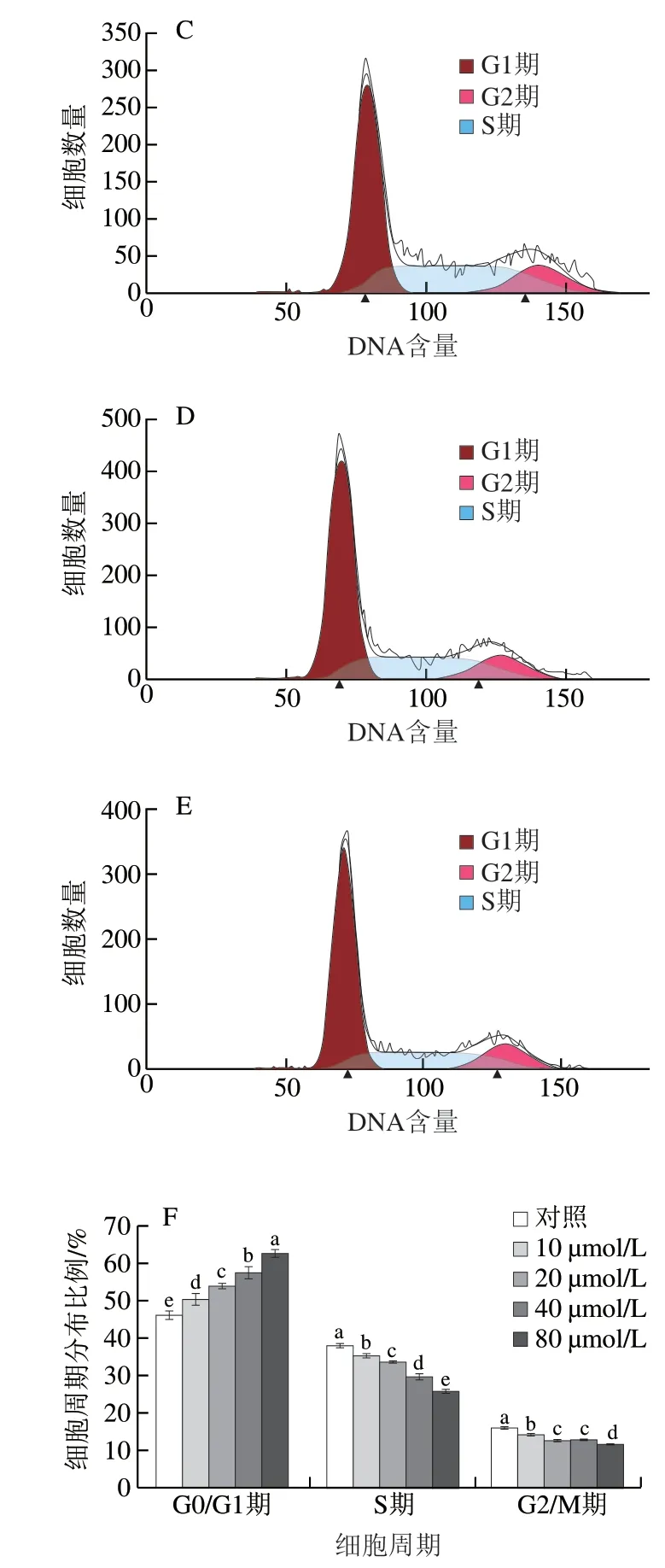
图 7 不同浓度PCB2处理对MCF-7细胞周期分布的影响Fig. 7 Effect of different concentrations of PCB2 on cell cycle distribution of MCF-7 cells
为阐明PCB2对MCF-7细胞生长的抑制作用是否与细胞周期阻滞有关,本研究分析不同浓度PCB2对细胞周期分布规律的影响,采用细胞同期检测试剂盒并通过流式细胞分析仪进行检测。由图7可知,当PCB2浓度在10~80 μmol/L范围内,处理MCF-7细胞48 h后,与对照组相比,G0/G1期细胞数量随PCB2浓度的增加呈显著增加的趋势(P<0.05),且具有浓度依赖性;而S期和G2/M 期的细胞数量均随PCB2浓度的增加呈显著降低的趋势(P<0.05)。实验结果表明PCB2对MCF-7细胞周期有阻滞作用,并将周期阻滞在G0/G1期,从而达到抑制MCF-7细胞生长的效果。
2.7 不同浓度PCB2处理对MCF-7细胞线粒体膜电位的影响

图 8 不同浓度PCB2对MCF-7细胞线粒体膜电位的影响Fig. 8 Effect of different concentrations of PCB2 on mitochondrial membrane potential in MCF-7 cells
线粒体对细胞的生长、增殖、分化起着至关重要的作用,作为细胞能量工厂,一些抗肿瘤药物在发挥其抗肿瘤作用时,通常会激活线粒体凋亡通路[26-27]。由图8可知,与对照组相比,采用不同浓度PCB2处理48 h后,MCF-7细胞线粒体膜电位显著降低(P<0.05),且呈浓度依赖性。结果表明PCB2可能通过线粒体途径诱导MCF-7细胞凋亡。
2.8 不同浓度PCB2处理对MCF-7细胞凋亡相关蛋白的影响
在真核生物中,线粒体作为能量和代谢的中心,为细胞的生命活动提供必要的基础能量[28],同时也作为细胞凋亡的控制中心,当细胞受到外界抗癌药物刺激时会造成线粒体功能损失,引起Bax/Bak形成低聚物复合体,复合体插入到线粒体外膜孔隙,导致Ca2+浓度和渗透压发生变化[29],引起内质网转运功能丧失以及线粒体膜电位崩溃,促使细胞色素c释放到细胞质[30], 细胞色素c与细胞凋亡激活因子结合形成凋亡复合体从而激活Caspase-9,进而激活Caspase-3,诱导凋亡的活化片段进入细胞核激活磷酸内切酶,进而使DNA裂解导致细胞发生凋亡[26-27]。为进一步探究PCB2对MCF-7细胞抗肿瘤作用的分子机制,本研究采用Western Bolt测定不同浓度PCB2对MCF-7细胞凋亡相关蛋白表达量的影响。
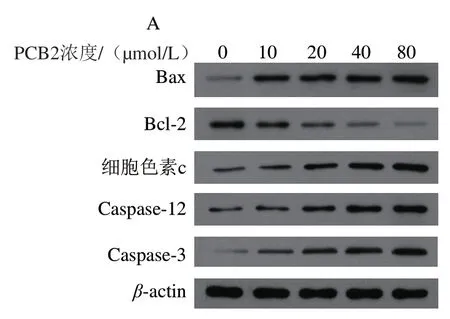
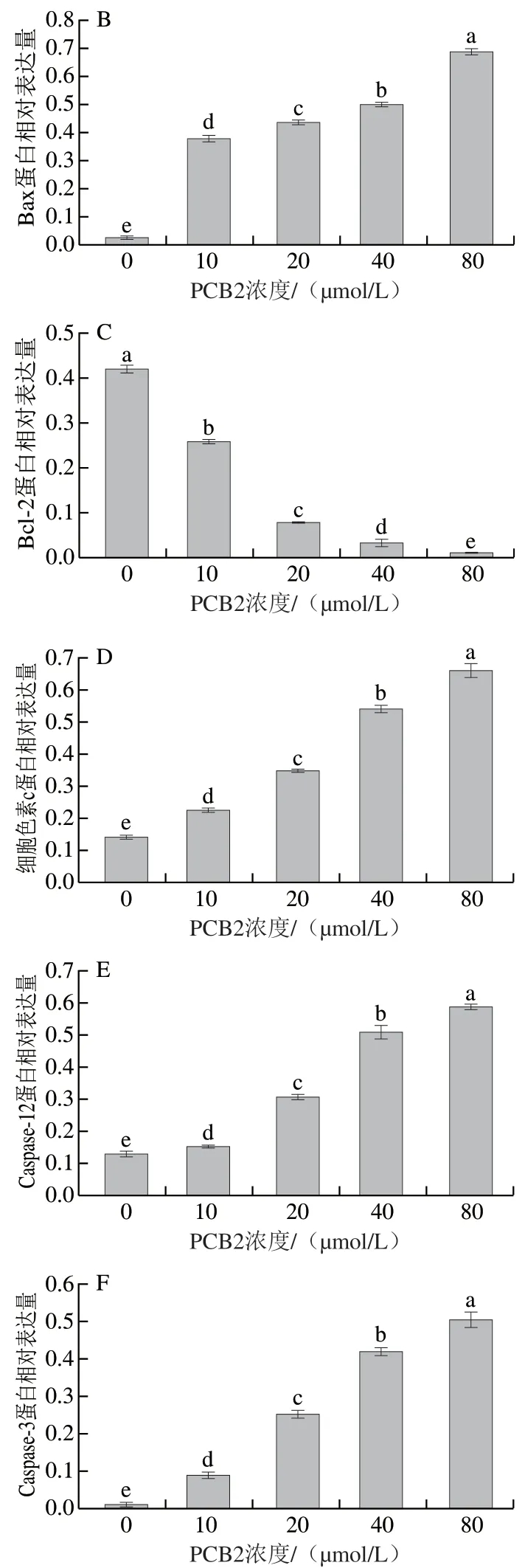
图 9 不同浓度PCB2对MCF-7细胞蛋白条带(A)及蛋白Bax(B)、 Bcl-2(C)、细胞色素c(D)、Caspase-12(E)和Caspase-3(F) 相对表达量的影响Fig. 9 Effect of PCB2 at different concentrations on protein bands (A) and the protein relative expression levels of Bax (B), Bcl-2 (C), cytochrome c (D), caspase-12 (E) and caspase-3 (F) in MCF-7 cells
由图9可知,与对照组相比,不同浓度PCB2处理48 h后,MCF-7细胞中Bax、细胞色素c、Caspase-12和Caspase-3蛋白相对表达量均显著上调(P<0.05),而Bcl-2蛋白相对表达量显著下调(P<0.05),且呈浓度依赖性。实验结果表明PCB2能激活线粒体介导的凋亡通路和内质网通路,上调促凋亡相关蛋白表达水平,下调凋亡抑制相关蛋白表达水平,进而抑制MCF-7细胞增殖,加速细胞凋亡,从分子机制方面进一步证明PCB2具有抗肿瘤的作用。
综合以上研究结果可知,当MCF-7细胞受到PCB2干预后,首先打破Ca2+平衡,使内质网转运功能被破坏,引起细胞内ROS水平显著升高,过量的ROS诱导MCF-7细胞凋亡形态发生变化,在Hoechst 33342染色下可观察到经PCB2处理后MCF-7细胞核呈现较强的蓝色荧光,并且PCB2浓度越大,细胞核荧光强度越强,同时伴有凋亡小体的产生;通过细胞流式分析仪进一步分析可知,与对照组相比,不同浓度的PCB2处理均显著增加MCF-7细胞凋亡率,同时PCB2对MCF-7细胞周期有阻滞作用,并将其细胞周期阻滞在G0/G1期,达到抑制MCF-7细胞生长的效果;另外,Ca2+浓度呈上升趋势,造成线粒体渗透压发生改变,线粒体膜电位随PCB2浓度的增加呈显著增加趋势,结果说明PCB2能改变线粒体膜电位,进一步验证PCB2可能通过线粒体途径诱导MCF-7细胞凋亡。为进一步探究PCB2的抗肿瘤作用机制,Western blot实验结果表明PCB2能上调Bax、细胞色素c、Caspase-12和Caspase-3蛋白相对表达水平,下调Bcl-2蛋白相对表达量。通过上述实验结果可知PCB2具有抗肿瘤作用,其机制与激活线粒体和内质网介导的凋亡通路、周期阻滞和细胞内ROS水平升高有关,其凋亡途径如图10所示。
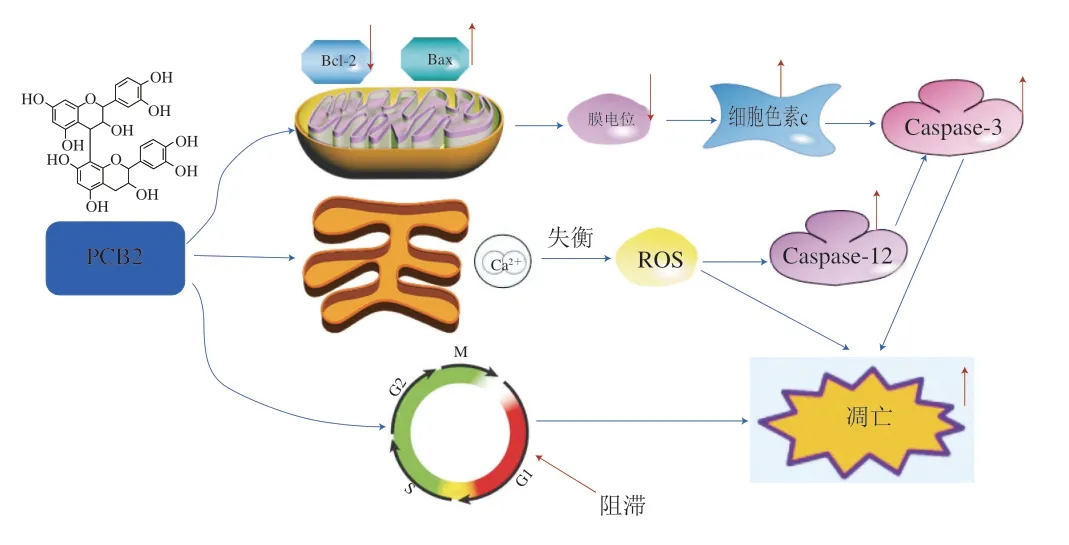
图 10 PCB2诱导MCF-7细胞凋亡相关途径Fig. 10 PCB2 induces apoptosis-related pathways of MCF-7 cells
3 结 论
通过上述研究结果可知,PCB2可通过破坏Ca2+平衡,增加胞内ROS水平和MCF-7细胞凋亡率,改变MCF-7细胞凋亡形态,并将细胞阻滞在G0/G1期,其内在机制为通过上调Bax、细胞色素c、Caspase-12和Caspase-3蛋白相对表达水平,下调Bcl-2蛋白相对表达水平来达到抗肿瘤效果。该研究结果为天然抗乳腺癌药物的开发提供重要的物质资源和理论参考。
