紫穗槐蜂蜜对小鼠急性酒精性胃溃疡的预防作用
2021-06-03赵浩安张锦锦杨二林
祝 敏,靳 林,赵浩安,,王 倩,张锦锦,杨二林,曹 炜,4,*
(1.西北大学化工学院,陕西 西安 710069;2.陕西省国营林场管理站(陕西省林业产业发展中心),陕西 西安 710082; 3.西北大学食品科学与工程学院,陕西 西安 710069;4.陕西省蜂产品工程技术研究中心,陕西 西安 710065)
胃溃疡是因胃黏膜破坏导致的一种常见消化性溃疡疾病,具有易感染、病程长、难治愈、易复发的特点[1]。胃溃疡发病机制复杂尚未完全明晰,已有研究表明其主要是由于胃黏膜的攻击因子与防御机制失衡引起的[2],酒精是典型的胃黏膜攻击因子之一。酒精经进入人体后会首先由包括胃肠在内的消化系统消化吸收进入血液[3],因此高浓度的酒精摄入会首先侵蚀胃黏膜,通过对胃黏液和碳酸氢盐的消解,破坏胃黏膜保护层,造成胃黏膜不可逆的损伤,继而诱发急性胃溃疡[4]。病理研究表明,急性酒精性胃溃疡的发病主要与中性粒细胞的浸润、促炎因子的释放及其所引起的氧化应激紧密相关[3-4]。如不能有效治愈,胃溃疡会发展成为胃出血、胃炎甚至是胃癌,危及患者生命。胃溃疡的防治一直都是研究人员关注的重点,目前胃溃疡的治疗是依靠一些化学合成药物,包括质子泵抑制剂在内的抗生素和胃酸中和剂[3],但是这些药物大多数会引起过敏症、心律不齐、造血功能障碍等不良副作用。因此,应用无毒副作用且具有良好生物活性的天然食品防治胃溃疡逐渐成为研究人员的重点。
蜂蜜是由蜜蜂收集植物花蜜并通过自身分泌物对其进行转化、发酵最终成熟的天然食品,因其突出的抑菌、抗氧化、抗炎等生物活性,一直是备受消费者和研究人员青睐的天然功能食品。蜂蜜的高渗透压[5-6]、抗氧化和抗溃疡能力[7]都与其解酒[8]及护胃作用[9-10]存在潜在联系。我国是蜂蜜生产大国,蜂蜜品种和产量均居世界前列。民间常有用蜂蜜预防酒精性胃溃疡的传统,但对于其作用机理鲜见详细报道。本课题组在基层蜂场走访调研中发现了一种我国西北地区特色单花种蜂蜜——紫穗槐蜂蜜。紫穗槐是一种大量种植于我国西北地区的沙地造林灌木树种。本课题组前期研究发现,紫穗槐蜂蜜的理化指标符合GB 14963—2011《食品安全国家标准 蜂蜜》及国际标准Council Directive 2001/110/EC中对蜂蜜质量的要求,且具有良好的抗氧化活性。
本研究以连续摄入10 d紫穗槐蜂蜜的急性酒精胃溃疡小鼠为对象,通过分析基本生化指标、组织病理学、相关炎症因子和基因及蛋白表达,拟探明紫穗槐蜂蜜对酒精引起的急性胃溃疡的预防作用及其潜在机理。本研究详细报道了我国特色单花种蜂蜜对酒精诱导的小鼠胃损伤的防治作用及其潜在的保护机制,可为蜂蜜功能食品发展开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
昆明小鼠(体质量18~22 g)由西安交通大学医学部实验动物中心提供,动物生产许可证号:SCXK(陕)2017-001。实验开始前,动物在恒温((25±2)℃)、恒湿(相对湿度(50±10)%)、自然照明10~14 h的环境下进行适应性饲养,自由进食、进水。
紫穗槐蜂蜜采自陕西榆林佳县,4 ℃下保存。通过实验室测定得到紫穗槐蜂蜜基本成分为:紫穗槐花粉孢子质量分数68%、水分质量分数(18.0±0.2)%、游离酸含量(15.42±0.29)meq/kg、内酯酸含量(4.50±0.73)meq/kg、总酸含量(19.93± 0.47)meq/kg、果糖含量(46.77±1.33)g/100 g、葡萄糖含量(27.42±0.64)g/100 g、蔗糖含量(0.81± 0.22)g/100 g及脯氨酸含量(332.22±21.99)mg/kg, 5-羟甲基糠醛未检出,理化特性为电导率(0.20± 0.01)mS/cm、pH 3.94。
过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)、前列腺素E2(prostaglandin E2,PGE2)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和动物组织蛋白质含量测定试剂盒 南京建成生物工程研究所;MiniBEST通用RNA提取试剂盒、PrimeSciptTMRT预混合液 日本TaKaRa 公司;核因子κB(nuclear factor κB,NF-κB)p65、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体 武汉赛维尔生物科技有限公司;没食子酸、丁香酸、木犀草素、柚皮素、短叶松素三乙酸酯、白杨素等标准品(纯度>98%) 美国Sigma公司;无水乙醇及其他试剂均为国产分析纯。
1.2 仪器与设备
6510高效液相色谱/电喷雾-四极杆-飞行时间质谱(high performance liquid chromatography/electron spray ionization-quadrupole time of flight-mass spectrometer,HPLC/ESI-Q-TOF-MS) 美国安捷伦科技公司;Infinite M200 Pro酶标仪 帝肯(上海)贸易有限公司;Gentier 96E实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,qPCR)仪 西安天隆科技有限公司;数字切片扫描显微镜 德国Leica Microsystems公司。
1.3 方法
1.3.1 紫穗槐蜂蜜酚类化合物的测定
参考本实验室建立的测定蜂产品酚类化合物的HPLC/ESI-Q-TOF-MS方法[11],具体条件如下:流动相A:超纯水;流动相B:甲醇;梯度洗脱程序:0~2 min、85% A,2~10 min、85%~70% A,10~25 min、70%~10% A,25~30 min、10% A,30~31 min、10%~85% A,31~45 min、85% A;流速0.2 mL/min;进样量2 µL。通过比对标准品保留时间、质荷比对紫穗槐蜂蜜酚类化合物进行定性分析,通过离子流色谱图峰面积带入化合物标准曲线进行定量分析。
1.3.2 动物分组与给药
小鼠适应性饲养7 d后,随机分为正常对照组、模型组、紫穗槐蜂蜜低剂量组(5 g/kgmb)、紫穗槐蜂蜜高剂量组(20 g/kgmb),每组10 只,紫穗槐蜂蜜组每天灌胃给药1 次,正常对照组和模型组给予等量蒸馏水。连续灌胃10 d。末次给药2 h后,除正常对照组外,所有处理组小鼠以10 mL/kgmb灌胃体积分数65%的乙醇溶液,建立酒精性胃溃疡小鼠模型,灌胃乙醇前需对各处理组小鼠禁食不禁水24 h。乙醇灌胃后1 h,颈椎脱臼处死小鼠。
1.3.3 小鼠胃组织采集、处理及病理学观察
小鼠颈椎脱臼处死后解剖取出胃,用4 ℃生理盐水冲洗表面污血,拭干。从胃底向幽门,沿胃小弯最长径将胃组织平行剖开,将胃体内外翻转,用4 ℃生理盐水将内部残余物洗净,平铺观察胃内壁出血性溃疡病变,胃组织溃疡情况通过溃疡指数评价。溃疡指数评分标准如下:微小溃疡(1~2 mm)1 分;中等溃疡(3~4 mm)2 分;大型溃疡(5~6 mm)4 分;超大溃疡(>6 mm)8 分。每个处理组溃疡指数以组内每只小鼠的溃疡总评分与小鼠数量的比值表示。
为更好比较不同剂量紫穗槐蜂蜜处理对小鼠胃组织的保护效果,按式(1)计算胃组织保护率。

溃疡指数评价结束后,将胃组织剖分为两部分,一部分浸入体积分数10%福尔马林试剂中,脱水,石蜡包埋。组织蜡块进行苏木精-伊红(hematoxylin-eosin,HE)染色和过碘酸-席夫(periodic acid-Schiff,PAS)染色后在光学显微镜下观察组织病理情况。另一部分胃组织用4 ℃生理盐水制备成质量分数10%的胃匀浆,用于生化指标检测。
1.3.4 NF-κB p65和iNOS免疫组织化学分析及评分
组织蜡块脱蜡水合后,将组织浸入柠檬酸缓冲溶液(pH 6.0),置于微波炉中进行抗原热修复。随后用体积分数3% H2O2预处理后,与相应抗体进行孵化后进行免疫染色,染色后的切片在数字切片扫描显微镜下获取断面图像进行免疫组化评分。评分规则如下:图像中细胞质呈黄色或棕黄色的细胞即为阳性细胞,按阳性细胞着色程度由弱至强分别记分,无黄色为0 分,淡黄色为1 分,棕黄色为2 分,深棕黄色3 分。记录视野下完整细胞总数及阳性细胞数,免疫组化评分按式(2)计算。

1.3.5 生化指标的检测
取1.3.3节制备的胃匀浆,2500 r/min下低温离心10 min,取上清液备用。根据相应试剂盒说明书测定胃匀浆中CAT、SOD活力及GSH、MDA、NO、TNF-α、PGE2和组织蛋白的含量,结果以每克(或毫克)蛋白所含各指标水平表示。
通过qPCR测定胃组织中iNOS、白细胞介素6(interleukin-6,IL-6)、IL-1β基因表达水平。采用RNA提取试剂盒提取样品总RNA。取RNA样本采用试剂盒反转录合成cDNA。取反转录合成的cDNA样本,根据基因序列特异性设计引物,通过qPCR并采用SYBR GREEN染料法,以β-actin为内参基因,用2-ΔΔCt法计算目的基因的相对表达量。PCR扩增程序:95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,循环40 次。
1.4 数据处理与分析
实验结果均以平均值±标准差表示,使用SPSS 23.0软件进行方差分析,P<0.05表示差异显著。采用Origin 8.5软件作图。
2 结果与分析
2.1 紫穗槐蜂蜜酚类化合物分析结果
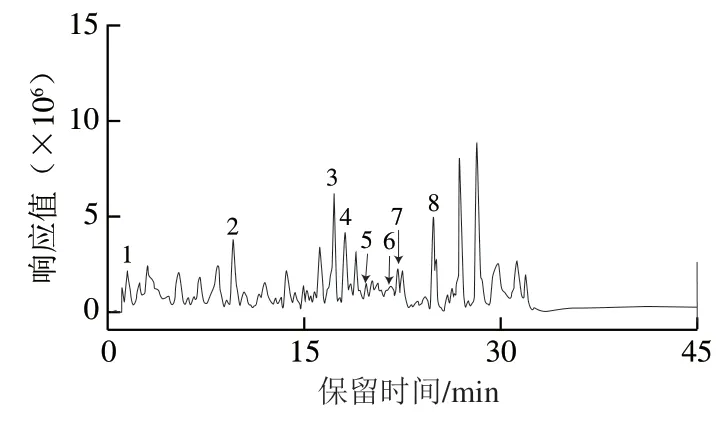
图 1 紫穗槐蜂蜜HPLC/ESI-Q-TOF-MS总离子流图Fig. 1 High performance liquid chromatography/electron spray ionization-quadrupole time of flight-mass spectrometer total ion chromatogram showing the phenolic composition of AFH
蜂蜜中酚类化合物与其生物活性一直是蜂蜜活性研究的重点。HPLC/ESI-Q-TOF-MS总离子流图如图1所示,通过与标准品进行比对分析,在供试紫穗槐蜂蜜样品中定性、定量检测出6 种已知酚类物质,其化学式及含量 如表1所示。紫穗槐蜂蜜中酚酸类化合物主要包括没食子酸和丁香酸,黄酮类化合物主要包括木樨草素、柚皮素、白杨素和短叶松素三乙酸酯。已有研究证实,蜂蜜的抗氧化和抗溃疡等活性与其酚类化合物种类和含量紧密相关[12],因此推测酚类化合物也是紫穗槐蜂蜜防治酒精性胃溃疡的主要活性成分之一。

表 1 紫穗槐蜂蜜中主要酚类化合物含量Table 1 Contents of phenolic compounds in AFH
2.2 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠溃疡指数的影响

图 2 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织病变 和胃溃疡指数的影响Fig. 2 Effect of AFH on gastric pathological change and gastric ulcer index in mice with acute alcoholic gastric ulcer
对预先灌胃紫穗槐蜂蜜的小鼠用乙醇诱导胃溃疡后,观察小鼠胃部溃疡程度,通过溃疡指数评价紫穗槐蜂蜜对酒精性胃溃疡的预防性保护作用。图2显示不同处理组小鼠胃组织病变形态及通过观察计算得到的溃疡指数。正常组小鼠胃组织宏观形态正常,未出现明显出血性 病变,而溃疡模型组小鼠胃组织出血性病变明显,溃疡最为严重,溃疡指数达到11.11±2.26,紫穗槐蜂蜜处理组小鼠胃组织形态相较模型组溃疡病变明显缓解,胃溃疡指数显著下降(P<0.05)。通过计算胃组织保护率比较不同剂量紫穗槐蜂蜜处理对小鼠胃组织的保护效果,高剂量紫穗槐蜂蜜处理对小鼠胃组织保护率达到89.83%,胃部溃疡程度与正常组小鼠无明显差异。
2.3 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织病理 变化的影响
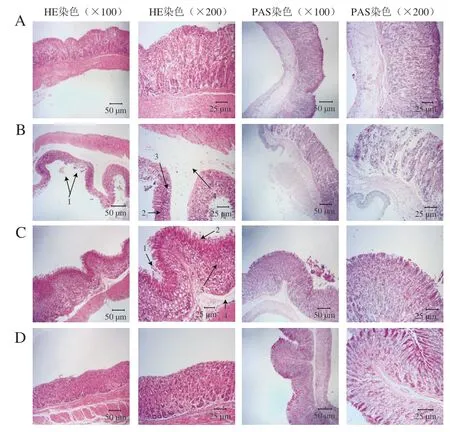
图 3 各组小鼠胃组织HE染色和PAS染色病理观察Fig. 3 Observation of gastric tissues by HE and PAS staining
如图3所示,小鼠胃部组织结构HE染色切片中,正常组小鼠胃部组织腺体排列整齐,黏膜层、黏膜下层和肌肉层结构完整、层次清晰,未见明显水肿及炎症细胞浸润。模型组小鼠胃组织正常结构消失,顶端腺细胞结构大量片状脱落,并出现部分凝固性坏死。黏膜层受损严重,出现明显的炎症细胞浸润和散在出血点。过量乙醇的摄入还会造成小鼠胃黏膜下层出现增宽现象,即水肿,损伤未累及黏膜肌层。与模型组小鼠相比,紫穗槐蜂蜜低剂量组小鼠胃组织腺体细胞排列较为整齐,局部腺体脱落,黏膜下层水肿有所缓解,但仍有局部出血和炎症细胞浸润等异常组织结构。紫穗槐蜂蜜高剂量组小鼠胃组织结构接近正常胃组织,表明紫穗槐蜂蜜的提前摄入对乙醇摄入后的小鼠胃组织具有一定保护作用。
胃黏膜上层分泌的黏液与胃组织细胞连接可以形成胃黏膜保护屏障,是胃上皮组织抵抗外来损伤(如乙醇、酸等)的重要防御因子。本实验对小鼠胃组织进行PAS染色,检测胃黏膜表层糖原、糖蛋白和其他多糖的含量,以切片中蓝紫色点的数量评价各处理组小鼠胃黏膜表层糖蛋白数量。如图3所示,过量乙醇的摄入会引起小鼠胃黏膜表层糖蛋白的损耗,造成模型组小鼠胃组织PAS染色损失明显,整体PAS染色很淡甚至缺失。紫穗槐蜂蜜预处理的小鼠胃组织PAS染色强度较模型组明显增加,其中紫穗槐蜂蜜高剂量组小鼠胃黏液保护屏障的完整性和连续性与正常组小鼠相似。
2.4 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织氧化 应激的影响
CAT、SOD和GSH作为与机体氧化应激水平相关物质,是其抵抗氧化损伤的重要防线[13]。MDA是机体内脂质过氧化作用产物,其含量能够反映脂质过氧化的程度。本实验中选择CAT活力、GSH含量、SOD活力和MDA含量作为指标评价紫穗槐蜂蜜对急性酒精性胃溃疡小鼠氧化应激的影响。
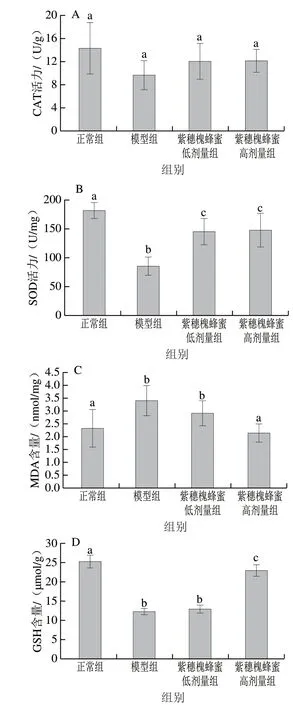
图 4 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织氧化应激水平的影响Fig. 4 Effect of AFH on oxidative stress levels in gastric tissues from mice with acute alcoholic gastric ulcer
如图4所示,小鼠在灌胃乙醇后,除CAT活力在各处理组间无显著差异外,模型组小鼠胃组织的SOD活力和GSH含量均显著降低(P<0.05),MDA含量显著升高(P<0.05)。提前灌胃的紫穗槐蜂蜜对小鼠胃组织氧化应激水平有所改善。紫穗槐蜂蜜处理组小鼠胃组织SOD活力和GSH含量均有所升高,MDA含量降低。其中高剂量紫穗槐蜂蜜处理能够使小鼠胃组织的SOD活力和GSH含量分别提高73.22%和87.15%,显著高于模型组小鼠 (P<0.05),而MDA含量降低了37.06%,与正常组小鼠相比无显著差异。
2.5 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织抗炎 标记物和炎症因子水平的影响
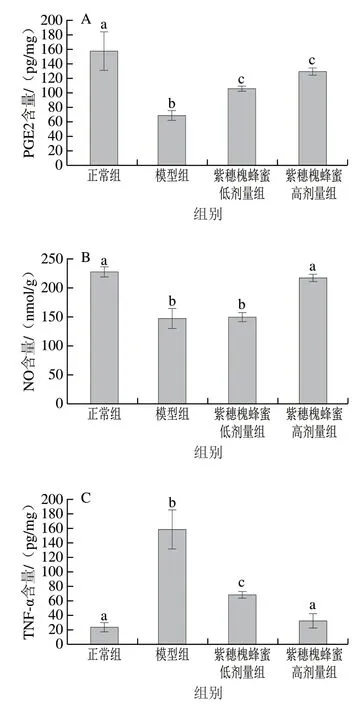
图 5 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织抗炎标记物 和炎症因子水平的影响Fig. 5 Effect of AFH on the levels of anti-inflammatory markers and inflammatory factors in gastric tissues from mice with acute alcoholic gastric ulcer
PGE2和NO是胃组织重要的抗炎标记物,其含量能够间接反映机体抗炎作用水平。如图5所示,过量乙醇的摄入造成模型组小鼠胃组织中PGE2含量显著低于正常组 小鼠(P<0.05),较正常组降低57.88%。连续10 d的紫穗槐蜂蜜灌胃可以显著提高小鼠胃组织中PGE2含量 (P<0.05),且不同剂量组之间无显著差异(P>0.05)。 胃溃疡模型组小鼠胃组织NO含量较正常组小鼠显著降低;与模型组相比,紫穗槐蜂蜜高剂量组NO含量显著提高了47.35%(P<0.05),且与正常组小鼠无显著差异(P>0.05)。
TNF-α是机体内常见的炎症因子,在机体炎症反应中发挥重要作用。乙醇灌胃会导致小鼠胃组织中TNF-α含量显著升高(图5),预先灌胃紫穗槐蜂蜜能够显著缓解乙醇摄入造成的TNF-α含量剧增,与模型组相比,紫穗槐蜂蜜低剂量组和高剂量组分别降低了56.90%和79.39%,其中紫穗槐蜂蜜高剂量组TNF-α含量与正常组相比无显著差异(P>0.05)。
2.6 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织炎症因子基因表达的影响

图 6 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织炎症因子 基因表达的影响Fig. 6 Effect of AFH on the gene expression of inflammatory factors in gastric tissues from mice with acute alcoholic gastric ulcer
如图6所示,与正常组相比,乙醇的摄入诱导小鼠胃组织中炎症因子iNOS、IL-6和IL-1βmRNA相对表达水平显著升高,分别较正常组提高了75.85%、65.67%和43.37%。紫穗槐蜂蜜高剂量组小鼠IL-6mRNA相对表达水平与正常组无显著差异(P>0.05);而对于炎症因子iNOS和IL-1βmRNA相对表达水平,紫穗槐蜂蜜低、高剂量组均与正常组无显著差异(P>0.05),表明紫穗槐蜂蜜处理对iNOS和IL-1β表达均具有显著调控作用。
2.7 紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织免疫组化评分的影响
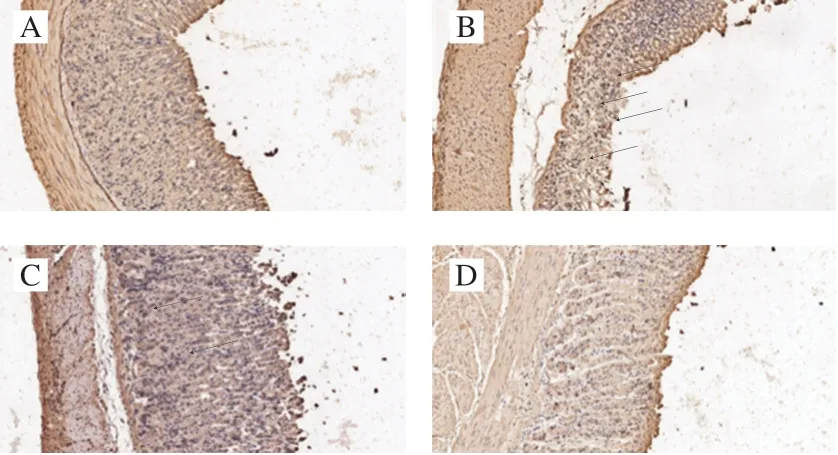

图 7 各组小鼠胃组织中NF-κB p65免疫组化切片及评分Fig. 7 NF-κB p65 immunohistochemical sections and immunohistochemical scores of gastric tissues from mice in four groups

图 8 各组小鼠胃组织中iNOS免疫组化切片及评分Fig. 8 iNOS Immunohistochemical sections and immunohistochemical scores of gastric tissues from mice in four groups
如图7、8所示,正常组小鼠胃组织中NF-κB p65和iNOS阳性细胞很少,而乙醇诱导的急性胃溃疡导致模型组小鼠胃组织中NF-κB p65和iNOS阳性细胞数明显增加,免疫组化评分显著升高(P<0.05),约为正常组免疫组化评分的4 倍。与模型组小鼠相比,紫穗槐蜂蜜处理组小鼠胃组织中NF-κB p65和iNOS阳性细胞数明显降低,且高剂量紫穗槐蜂蜜对细胞的保护效果明显优于低剂量。此外,紫穗槐蜂蜜对急性酒精性胃溃疡小鼠胃组织NF-κB p65和iNOS免疫组化结果也与促炎因子基因表达结果相印证,即紫穗槐蜂蜜能够显著抑制胃溃疡相关炎症因子基因和蛋白的表达。
3 讨 论
胃溃疡是最常见的胃肠道疾病,感染人群约占全球人数的4%~5%,而过量饮酒是胃溃疡的主要病因之一[14]。 现有研究显示,酒精性胃溃疡主要与胃黏膜保护层 损伤、胃组织氧化应激水平紊乱、炎症因子浸润等有关[15]。 完整的胃黏膜是保护胃组织免受乙醇直接损伤的首要屏障,有学者提出预防胃溃疡最重要的步骤是在胃内壁上形成一层保护层,保护底层黏膜免受外界刺激物的 侵害[16]。本实验中,紫穗槐蜂蜜预先处理后,小鼠胃组织得到有效保护,溃疡病理表现和指数显著降低,表明当机体摄入过量乙醇时,紫穗槐蜂蜜可以通过保护胃黏膜完整性从而达到预防急性酒精性胃溃疡的效果。这与新西兰麦卢卡蜂蜜、土耳其杜鹃花蜂蜜、板栗蜂蜜和橡树蜜在防治胃溃疡方面的表现相似[9-10]。
胃黏膜受到刺激后也会诱发活性氧的过度表达造成生物大分子氧化损伤和过氧化作用,其产生的超氧阴离子、过氧化氢、羟自由基等会导致胃组织抗氧化防御系统的紊乱[17-18]。因此,合理地改善胃组织中过度应激的氧化状态也是防治胃溃疡的重要途径之一。然而大部分治疗胃溃疡的药物,例如质子泵抑制剂类的奥美拉唑,仅单纯地抑制或中和过度分泌的胃酸,不能介入受损胃组织的氧化应激,这也是药物不能根治胃溃疡致使其反复发作的重要原因[1]。本实验通过HPLC/ESI-Q-TOF-MS对紫穗槐蜂蜜所含的主要酚酸和黄酮进行了定性和定量分析,其中丁香酸、木樨草素和柚皮素等都被研究证实具有良好的抗氧化活性[19-20]。实验结果证明,紫穗槐蜂蜜能够通过促进机体胃组织抗氧化酶(SOD)活力、提高非酶类抗氧化物(GSH)含量、抑制脂质过氧化程度(MDA含量)来改善机体氧化应激状态,从而实现对酒精性胃溃疡的预防性保护作用。相较而言,低剂量紫穗槐蜂蜜处理对小鼠胃组织的MDA抑制作用和SOD活力提高作用分别优于土耳其橡树蜜和新西兰麦卢卡蜂蜜[9-10]。
酒精性胃溃疡损害与炎症反应也存在关联性,过量乙醇的摄入会刺激胃黏膜上的微循环血管,产生 大量炎症介质和细胞因子,破坏胃组织正常结构及生理功能[21]。PGE2是胃黏膜完整性、胃组织pH值环境及胃黏液分泌水平的重要调节因子,对胃溃疡的防治有重要意义[22-24]。本实验中,紫穗槐蜂蜜处理能够有效缓解乙醇摄入对PGE2生成的抑制。NO是胃肠道中非胆碱能和非肾上腺能神经释放的神经递质和信使分子,乙醇诱发的胃溃疡通常与NO途径的调节失常有关[9,25]。高剂量紫穗槐蜂蜜的预处理可以显著改善小鼠机体内的NO调节失常,使其维持在正常水平。NF-κB是调节机体免疫和急性炎症表达的重要转录因子,能够激发促炎因子(如TNF-α、IL-6和IL-1β)转录表达的上调[26]。TNF-α、IL-6和IL-1β是机体中最常见的促炎因子,可以调节细胞凋亡相关基因的表达[27-29]。本实验中,qPCR及免疫组化染色结果均表明,紫穗槐蜂蜜的预先灌胃可以有效抑制乙醇引起的TNF-α因子的激增、NF-κB p65免疫组化的阳性表达和IL-6及IL-1β因子基因的正向表达。另外,iNOS是机体内NO水平调节的重要介质,过度的iNOS表达会造成机体内有害NO的累积,这部分NO与胃溃疡和慢性溃疡性结肠炎的病发有关[30]。同样地,紫穗槐蜂蜜能够有效抑制胃溃疡小鼠胃组织中iNOS的正向(阳性)表达,避免有害NO的过渡积累以此达到预防酒精性胃溃疡的效果。已有研究证明,紫穗槐果实和叶子富含异黄酮、查耳酮等黄酮类化合物,具有良好的抗炎作用,能够明显抑制二甲苯导致的小鼠耳廓肿胀及醋酸导致的毛细血管通透性的增加[31-32],蜜源植物作为蜂蜜植物化学成分主要来源,影响着蜂蜜的生化成分和药用特性,由此推断,紫穗槐蜂蜜中黄酮类物质也是其对急性酒精性胃溃疡炎症因子抑制作用的重要生物活性成分。
综上,紫穗槐蜂蜜对急性酒精性胃溃疡具有良好的预防作用。可能的作用机制包括保护机体胃黏膜完整性、改善组织氧化应激状态和抑制炎症因子的表达,提示紫穗槐蜂蜜具备开发为预防胃溃疡天然食品的潜能。
