聚氨酯泡沫固定化Alcaligenes sp.DN25去除苯酚的研究
2021-06-03黄文媛孙士杰唐宏震苏智芳钟秦迪刘幽燕李青云
黄文媛,孙士杰,唐宏震,苏智芳,钟秦迪,刘幽燕,李青云
(广西大学化学化工学院,广西南宁530004)
引 言
苯酚作为一种重要的有机化工基础原料在石油精炼、皮革制造、树脂合成、香料生产等行业广泛应用,由此产生大量含酚工业废水,严重污染生态环境,并且苯酚是一种难降解的有毒污染物,即便是低浓度也危害水生生物与人类身体健康[1-2]。因此,世界各国对含酚工业废水的排放制定了非常严格的限制标准,例如,美国环境保护署将苯酚列入优先污染物名单,规定处理后的废水苯酚浓度最大不超过0.1 mg·L-1,而世界卫生组织(WHO)规定饮用水中的苯酚含量小于1μg·L-1[3-4]。采用物理、化学方法去除含酚工业废水通常费用较高,且容易造成环境二次污染。相对而言,生物法清洁、高效,环境效益突出,愈来愈受到重视[5-6]。但是,生物法在运行过程中存在生物量流失、系统运行不稳定等现实问题,因此,采用固定化细胞技术解决生物系统的上述问题是目前常用的有效策略[7-12]。
可用于细胞固定化的载体多为机械强度高、生物相容性好、来源广泛、制作简单的材料物质,文献报道用于苯酚降解菌的固定化载体有聚氨酯泡沫(PUF)[13]、藻酸钙珠[14]、竹炭[15]等材料。聚氨酯泡沫具有孔隙率高、理化性质稳定、经济价廉等优点[16],研究发现其大孔结构有利于物质的交换与传质,易于菌株挂膜生长,因此大孔聚氨酯泡沫常被选用为固定化的载体。Ueno等[17]采用网状PUF材料对菌株Prototheca zopfii进行固定化,结果表明菌株在30℃条件下能快速挂膜,并且成膜稳定,基本无细胞泄漏。但另一方面,小孔径的材料比表面积大,吸附位点多,有利于富集营养物,因此也有利于菌株的固着生长[18]。Xiong等[19]研究发现,当生物炭材料的孔径尺寸为细菌大小的1~5倍时,固定化的生物量接近最大值。由此可见,载体的孔径大小是影响细胞固定化及其降解效果的重要因素,开展载体孔结构大小的研究对进一步理解材料特性与菌株固定化、生物降解的关系,进而构建高效的固定化细胞体系非常必要。
本研究主要以孔结构大小可调的聚氨酯泡沫材料为研究对象,通过改变泡沫组分的含量,制备获得不同孔径大小的泡沫用于苯酚降解菌的固定化,并比较其生物量和苯酚的降解率。在此基础上,进一步开展PUF-固定化细胞在不同初始pH、NaCl浓度条件下的生物降解过程研究,掌握聚氨酯泡沫固定化细胞体系降解苯酚的基本规律,为进一步开展实际工业废水的研究奠定基础。
1 实验材料与方法
1.1 主要材料与菌株
苯酚、4-氨基安替比林、铁氰化钾、25%~28%氨水,AR,上海阿拉丁试剂有限公司;戊二醛、无水乙醇,AR,国药集团化学试剂有限公司。
实验菌株为产碱杆菌Alcaligenessp.DN25(CGMCC 5734),为本实验室从受污土壤中筛选、分离所得。
1.2 主要设备
可见分光光度计,723N,上海光谱仪器有限公司:新型高分辨场发射扫描电镜,SU8220,日本日立高新科技有限公司。
1.3 不同孔径聚氨酯泡沫的制备
本实验采用一步自由发泡工艺制备聚氨酯泡沫。首先在塑料烧杯中分别称取100 g聚醚4110G、10 g 1618A、0.6 g C-8、3 g硅油L-580、10 g 1006-2、6 g KF-28、0.4 g催化剂A-33、20 g CFC-141B等原料,5000 r·min-1转速下充分搅拌1.5 min,静置,得到混合聚醚(白料),总质量为150 g,然后放置于恒温水浴预热至设定温度35℃。按照白料与黑料(异氰酸酯)质量比为1.5∶1的关系,称取黑料MDI-5005于塑料烧杯中,同样放置于恒温水浴预热至设定温度35℃。最后将黑料与白料混合,以5000 r·min-1的转速搅拌8 s后迅速倒入模具中进行发泡,将泡沫体置于80℃烘箱中熟化4 h,制备得到聚氨酯泡沫。
泡沫孔径的大小通过改变物理发泡剂CFC-141B的用量,或者添加不同用量的化学发泡剂——水来调控,其他组分不变。
1.4 固定化细胞的制备
1.4.1 泡沫载体的预处理 将PUF材料切成约5 mm×5 mm×5 mm的小块,过筛去除碎屑,然后用95%乙醇浸泡30 min,再用超纯水浸洗3次,最后在60℃烘箱中烘干,待用。1.4.2 种子液的制备 基础培养基(g·L-1):(NH4)2SO42 g,NaCl 0.5 g,K2HPO42 g,蛋白胨5 g,葡萄糖10 g,酵母粉5 g,用0.1 mol·L-1的NaOH溶液调整pH为8.0。移液器量取1 ml保藏的菌液接种至灭菌后的基础培养基中,每瓶装液20 ml,然后置于30℃、120 r·min-1的摇床中培养18 h,作为种子液。
1.4.3 菌株的固定化 称量预处理后的聚氨酯泡沫10块(0.08 g)为一份加入基础培养基中,121℃高压蒸汽灭菌20 min,冷却后以10%的接种量接种,30℃、120 r·min-1的摇床中培养48 h。取出摇瓶,用镊子夹出固定化细胞,用20 ml的PBS溶液(pH=8、200 mmol·L-1)清洗固定化细胞3次,制备得到1份固定化细胞,待用于扫描电镜观测以及苯酚降解实验。游离细胞(即无载体)体系的培养条件同固定化细胞体系,将培养48 h的游离细胞倒入离心管,9500 r·min-1、4℃离心15 min,再用PBS溶液清洗3次后重悬,配制得到菌悬液(OD600≈1.25),待用。
1.5 苯酚去除实验
为比较固定化细胞体系与游离细胞体系的苯酚去除效果,两个体系的苯酚降解条件一致:生物量均为0.015 g(以细胞干重记),量取一定体积、经过0.22μm膜过滤的苯酚储备液加入到PBS溶液中以达到设定的苯酚浓度,然后将样品瓶置于30℃、120 r·min-1的摇床中进行降解反应,定期收集样品,并测量残留的苯酚浓度。所有样品瓶用盖子密封以防止苯酚氧化。
考察pH、NaCl浓度对菌株降解苯酚的影响时,设置实验的pH为6.0、7.0、8.0、9.0,NaCl浓度的值为0、0.5%、1.0%、2.0%、4.0%。
上述苯酚去除实验每个样品皆做3个平行,同时分别做无降解菌、无菌且仅有载体的空白对照。
1.6 固定化细胞的重用性研究
固定化细胞重复使用降解苯酚的实验体系同1.5节,每批次降解反应结束,取样测定剩余苯酚含量。取出固定化细胞并用无菌水洗涤3次,然后转移到新鲜配制的降解体系中,用于下一批次降解实验。
1.7 分析方法
参照Oh等[20]的孔径测定方法,对聚氨酯泡沫材料的扫描电镜进行孔径大小的统计学计算,结果用平均值表示。
固定化细胞的扫描电镜分析:将清洗后的固定化细胞用2.5%戊二醛溶液浸泡,放置于4℃冰箱12 h后取出,用超纯水清洗3次,然后按照10%-30%-50%-70%-80%-90%-100%的乙醇梯度逐级脱水,每次15 min,脱水2次后自然晾干。分别切割载体样品的表面、中间部分为薄片,喷金,上机测试。
苯酚的浓度根据国标方法4-氨基安替比林法进行分光光度测定,所有测试均重复三次。生物量测定采用细胞干重法,将样品置于60℃的烘箱中干燥至恒重。固定化细胞样品根据载体PUF材料固定前和固定后的质量差计算得到固定的生物量。
2 结果与讨论
2.1 固定化细胞的扫描电镜图
图1分别为制备所得聚氨酯泡沫材料以及聚氨酯泡沫固定化细胞的扫描电镜图。图1(a)所示,聚氨酯泡沫为多孔隙结构,结实的骨架使得聚氨酯泡沫具有良好的机械强度和稳定性,为微生物的附着生长提供了有利条件。图1(b)反映了菌株在载体上的生长情况,图中可见,在泡沫的孔壁上分布有大片密集的、呈杆状的降解菌细胞,表明制备的聚氨酯泡沫材料对微生物具有良好的固定化效果。
2.2 固定化细胞对不同浓度苯酚的去除
苯酚是一种杀菌剂,目前文献报道的菌株最大耐受水平为24 mmol·L-1(2250 mg·L-1)[21],大多数菌株的降解浓度大致为1000 mg·L-1[22-24],图2比较了游离细胞与固定化细胞对不同浓度苯酚的降解结果。图中所示,随着苯酚浓度增大,抑菌作用明显增强,游离细胞降解200、500、900 mg·L-1苯酚所用的时间分别为22、46、96 h。当苯酚浓度增大至1160 mg·L-1时,游离细胞完全受到抑制,经过96 h苯酚浓度基本没有改变。Su等[25]报道的菌株Rhodotorulasp.的最大耐受苯酚浓度为1500 mg·L-1。与游离细胞体系相对比,PUF-固定化细胞降解200、500、900、1160 mg·L-1苯酚所用时间分别为15、32、48、66 h,固定化细胞体系显著缩短了降解时间。Jiang等[26]采用藻酸钙珠固定化菌株Debaryomycessp.可在56 h内完全降解500 mg·L-1苯酚,而游离细胞仅降解了38.9%。因此,固定化体系的局部高细胞密度,以及载体对微生物的保护作用是固定化细胞比游离细胞降解快速的主要原因。而值得关注的是,本研究中PUF-固定化细胞在降解初期的速率明显加快,测定发现聚氨酯泡沫能吸附苯酚,使其浓度从1160 mg·L-1降低至673.5 mg·L-1(图2),因此初步分析认为,载体PUF对苯酚的吸附在一定程度上降低了液相浓度对细胞的抑制作用,从而有利于生物降解过程的启动,缩短苯酚的降解时间,同时相对提高了固定化细胞体系对苯酚的处理浓度。Wang等[27]研究者也有类似的结论,通过采用树脂材料作为“酚收集剂”吸附苯酚,使得液相主体苯酚浓度快速从6000 mg·L-1降低至1000 mg·L-1,生物降解过程得以顺利进行。Stenholm等[28]构建PUF-固定化菌株Trametes versicolor反应器去除壬基酚(NPEO)能连续运行18 d,去除率保持在90%以上。研究结果表明,PUF对NPEO的良好吸附作用(最大动态吸附容量达到106 mg·g-1)有效促进了壬基酚的生物降解。

图1 载体材料固定化前、后的扫描电镜图Fig.1 Scanning electron microscopy of the carrier material before and after immobilization

图2 游离细胞与PUF-固定化细胞对不同浓度苯酚的降解Fig.2 Degradation of phenol at different concentrations by the freely suspended cells and PUF-immobilized cells
2.3 泡沫孔径大小的影响

图3 聚氨酯泡沫材料的孔径分布Fig.3 Pore size distribution of the polyurethane foammaterials
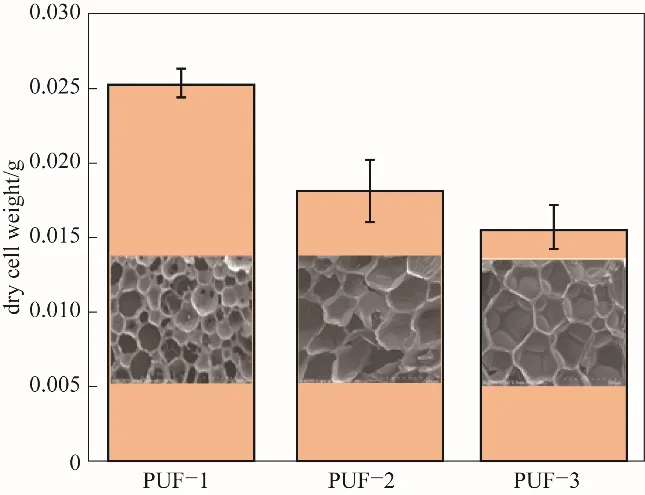
图4 不同孔径泡沫固定化细胞量的结果Fig.4 The biomass immobilized on the foam at different pore sizes
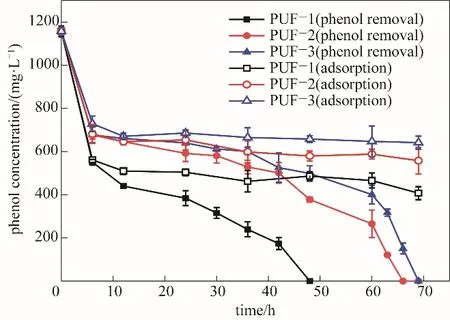
图5 不同孔径PUF-固定化细胞去除苯酚的时间进程Fig.5 Time curve of phenol removal by the PUF-immobilized cells at different pore sizes
材料孔径的大小将影响固定化的生物量以及苯酚的去除结果,图3、图4分别为聚氨酯泡沫材料孔径尺寸的统计学计算以及固定化细胞量的结果。当每百份多元醇物理发泡剂用量为15 g时,制备得到的泡沫PUF-1肉眼可见孔径较小,平均孔径约为150μm[图3(a)],采用PUF-1泡沫制备固定化细胞的生物量为(0.0253±0.0010)g(图4)。增加物理发泡剂用量为20 g时,泡沫PUF-2的平均孔径增大为约300μm[图3(b)],固定所得的生物量为(0.0182±0.0020)g。当以2 g的水作为化学发泡剂时,泡沫PUF-3的平均孔径约为400μm[图3(c)],对应的固定化细胞生物量为(0.0156±0.0016)g。大孔的材料有利于物质交换,菌株生长不会堵孔,小孔的材料能为细胞的附着生长提供更多的比表面,但可能会产生堵孔问题,因此,孔径的大小存在一个合适值,本实验载体材料孔径为150μm时固定化的结果较好。不同孔径载体PUF-1、PUF-2、PUF-3的固定化细胞降解苯酚的结果如图5所示,孔径为150、300、400μm泡沫固定化细胞完全去除1160 mg·L-1苯酚的时间分别为48、66和69 h。实验发现,在降解开始前的6 h,苯酚的去除以泡沫吸附为主,不同孔径泡沫的苯酚吸附率分别为51.2%、41.1%和37.5%,这符合孔径越小、比表面积越大,越有利于吸附的常规规律。经过12 h后吸附达到平衡,最终吸附率分别为56.1%、44.2%和42.1%,由此可见,PUF材料对苯酚的吸附在降低苯酚的浓度抑制、快速启动降解发挥了重要作用,使得固定化细胞体系比游离细胞体系具有更快的降解速率和更高的苯酚处理能力。Ma等[29]制备的活性炭纤维固定化菌株Pseudomonas putida甚至可以处理浓度高达10000 mg·L-1的苯酚,载体活性炭纤维可以在短时间内通过吸附使苯酚的浓度降低至2000 mg·L-1以下,此时生物降解过程得以启动,而随着苯酚的降解,载体上吸附的苯酚被不断解吸并且降解,最终10000 mg·L-1的高浓度苯酚在吸附-降解-解吸-降解的协同作用下被固定化细胞120 h内降解完全。本研究对无菌且仅有载体的对照样品进行解吸实验,结果能检测到解吸出来的苯酚,而对PUF-固定化细胞进行多次解吸却检测不到苯酚。因此认为,本实验也存在吸附-降解-解吸-降解的类似过程,吸附在载体PUF上的苯酚最终也被菌株降解完全。
2.4 初始p H的影响
pH是影响生物降解效率的重要环境因素之一,同时也会影响物质的存在形态,并且还会与污染物质竞争吸附位点。不同初始pH条件对PUF-固定化细胞降解苯酚的影响如图6所示,初始pH为6.0、7.0、8.0、9.0时,PUF-固定化细胞完全降解900 mg·L-1苯酚所需时间分别为52、46、46、52 h,其中降解至40 h时,对应的苯酚去除率分别为66.7%、86.5%、75.5%、65.6%。Gomes等[30]采用甘蔗渣固定Candida tropicalis的研究表明,当pH为7.0时会降低苯酚的毒性水平,从而加快苯酚的降解。Wang等[27]采用大孔树脂固定菌株Alcaligenesfaecalis去除苯酚发现,pH为6.0时,苯酚的去除率仅为44.9%;当pH为7.0时,苯酚去除率达到最大值为99.34%,该菌株适宜在中性或弱碱性条件下降解苯酚。本研究固定化体系的最佳初始pH也为7.0,并且在不同pH条件下的苯酚降解率结果差距不显著,说明PUF-固定化细胞具有较宽广的pH适用范围,有利于实际工业废水的处理。此外,pH的变化对载体吸附行为的影响也不显著,图中所示的吸附曲线具有相似的趋势,苯酚的吸附主要发生在前12 h,达到平衡的吸附率约为55.1%,体系中的高浓度苯酚仍然是载体吸附的主要对象,由此也反映菌株在载体上的“微环境”很可能与液相主体不同,因此受到pH的影响较小。
2.5 NaCl盐浓度的影响
苯酚工业废水通常还包含有无机盐和多种有机化合物,盐浓度对微生物的活性影响不容忽视。高盐条件(主要以NaCl计,NaCl浓度>3%)会导致微生物失活、死亡,因此,常规的微生物一般只能处理含盐量不超过3%的废水[31-32]。不同NaCl浓度下的苯酚去除结果如图7所示,苯酚的去除率随着NaCl浓度的增加而降低,NaCl浓度为0、0.5%、1.0%、2.0%、4.0%时,PUF-固定化细胞对900 mg·L-1苯酚48 h内的去除率分别为100%、77.8%、74.3%、70.1%、65.7%,完全去除的时间分别为48、72、72、78、84 h。与不同pH条件下的吸附结果相类似,苯酚在降解初期被快速吸附,12 h时达到吸附平衡,吸附率约为53.8%,在实验考察的NaCl浓度范围内也未观察到竞争吸附的现象,载体对苯酚的吸附率变化不大。上述结果表明,PUF-固定化细胞在NaCl浓度达到4.0%的条件下仍然具有较好的苯酚降解效果,展示了固定化细胞在耐受环境条件变化方面的突出优势。Jiang等[26]采用Fe3O4-藻酸钙珠固定菌株Debaryomycessp.在1%的NaCl浓度下,40 h内可完全降解500 mg·L-1苯酚。当NaCl浓度增大至9%时,固定化细胞72 h的降解率超过99.9%,而此时游离细胞的降解率仅为30.6%,因此,细胞固定化技术有效提高了含盐工业废水的生物处理效能。

图6 初始pH对PUF-固定化细胞去除苯酚的影响Fig.6 Effect of initial pH on phenol removal by the PUF-immobilized cells
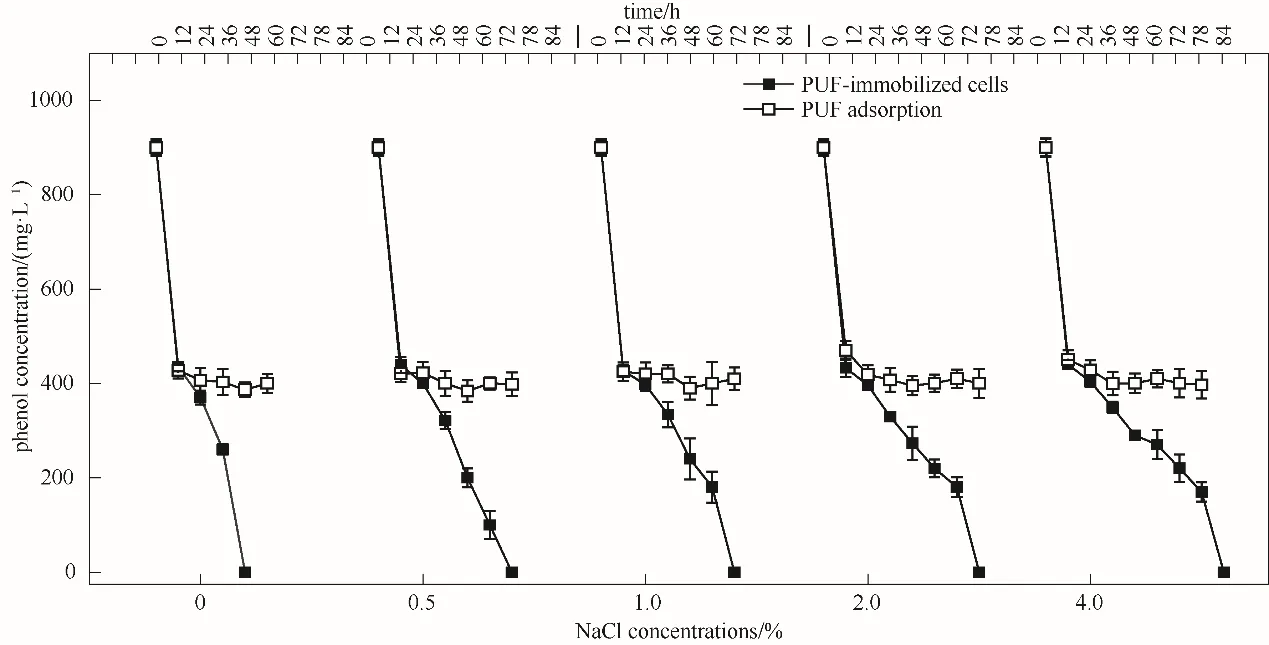
图7 NaCl浓度对PUF-固定化细胞去除苯酚的影响Fig.7 Effect of salt concentrations on phenol removal by the PUF-immobilized cells
2.6 重复批次降解
固定化细胞的重用性可以反映生物处理系统的稳定性情况。图8结果所示,PUF-固定化细胞重复使用11个批次(合计264 h),苯酚的去除率依然能达到100%,在第12个循环时,苯酚去除率降低为84.0%,比第11个批次时减少了16%,开始呈缓慢下降的趋势。司伟磊等[33]采用聚氨酯泡沫固定蒽醌脱色偶氮染料苋菜红,结果表明固定化蒽醌循环使用10次后,苋菜红的脱色率仍高达90%。由此可见,PUF材料具有良好的机械强度和稳定性,以此为载体的固定化细胞可以重复使用多次,说明该载体能有效固定菌株,使其不易脱落,为生物处理系统的长效、稳定运行提供了有利条件,这也是固定化体系在实际污染废水中的应用价值。
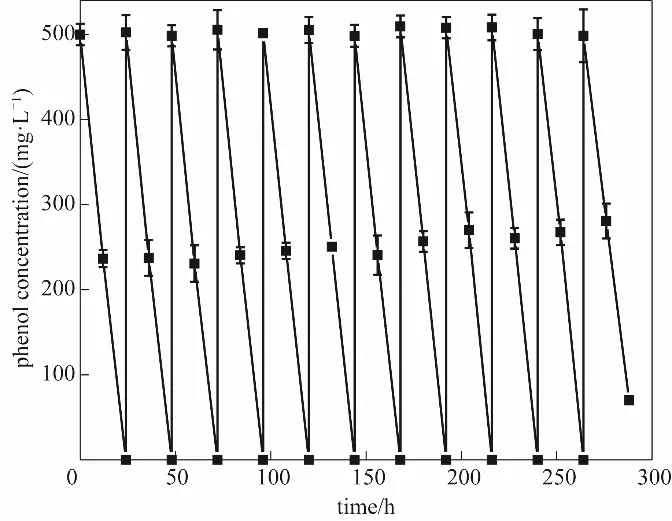
图8 PUF-固定化细胞的重复使用Fig.8 Reuse of the PUF-immobilized cells for phenol removal
3结 论
(1)本研究合成的聚氨酯泡沫机械强度好、孔结构稳定,能有效固定苯酚降解菌株,为构建固定化细胞体系提供了良好的载体材料。
(2)当PUF载体材料的孔径尺寸均值为150μm时,固定化细胞的生物量干重最大值为(0.0253±0.0010)g,PUF-固定化细胞能在48 h内完全降解1160 mg·L-1的苯酚,而游离细胞在此浓度下则完全受到抑制。PUF材料对1160 mg·L-1苯酚的平衡吸附率为56.1%,载体对苯酚的吸附被认为有效降低了液相主体苯酚对菌株的抑制作用。
(3)在初始pH为6.0~9.0、NaCl浓度为0~4.0%的范围内,PUF-固定化细胞能保持较好的降解活性,pH为9.0、NaCl浓度为4.0%的固定化细胞体系分别在52 h、84 h内完全降解900 mg·L-1苯酚,反映了PUF-固定化细胞具有较宽广的适用范围。
(4)PUF-固定化细胞在重复使用11个批次的循环后,苯酚的去除率仍能保持100%,第12个循环批次的去除率开始缓慢下降,表明该PUF-固定化细胞体系具有良好的稳定性,为进一步发展实际应用奠定了基础。
