IDH1 R132H 突变对不同级别胶质瘤的影响及相关因素分析
2021-06-03王新军曾凡涛
杜 宁 王新军 杨 卓 曾凡涛
郑州大学第五附属医院,河南 郑州450052
胶质瘤是来源于神经胶质细胞的肿瘤,是中枢神经系统最常见的恶性肿瘤之一[1-2]。目前胶质瘤的治疗是以手术为主辅以术后放化疗的综合治疗方式,但因其具有高侵袭性、易复发、易升级等特点,其治疗效果一直差强人意[3]。近年来随着分子生物学的发展,与胶质瘤相关的基因异常被人们揭示,基于分子水平的靶向治疗、免疫治疗等成为胶质瘤治疗新的思路和方向。异柠檬酸脱氢酶-1(isocitrate dehydrogenase,IDH1)在胶质瘤的发生发展中扮演者举足轻重的角色。2008 年,PARSONS 等[4]在胶质母细胞瘤(glioblastoma,GBM)的基因组测序研究中首次发现IDH1突变。随后进一步研究[5-6]显示,80%~90%的Ⅱ级、Ⅲ级胶质瘤中存在IDH1突变,而原发胶质母细胞瘤中这一突变则少见。此外,IDH有IDH1、IDH2 和IDH3 三种同工酶,在神经胶质瘤中IDH1 突变最为常见,其突变频率远高于其他两种同工酶[7]。IDH1在神经胶质瘤中最常见突变位点是第132位精氨酸残基,80%~90%的突变类型是R132H[8]。IDH1在胶质瘤中起着重要作用,但其影响胶质瘤发生发展的机制尚不清楚,以此为靶点的靶向治疗的疗效尚不明确,均有待进一步研究。
本文旨在进一步研究IDH1 在胶质瘤组织及细胞系中的表达,探索IDH1在胶质瘤发生发展中的作用,为胶质瘤的靶向治疗提供一定的理论依据。
1 资料与方法
1.1 一般资料购买U87、U251、LN-229、HS683、U118 胶质瘤细胞系,传代培养后用备用。回顾性收集2014-06—2019-06 于郑州大学第五附属医院行手术治疗并经病理证实为胶质瘤的76例患者。纳入标准:①影像学检查+术后病理证实明确为Ⅱ级及以上胶质瘤;②原发肿瘤并首次接受手术治疗;③既往无其他颅内疾病史,如脑炎、颅内感染等。排除标准:①患者临床信息不完整;②患者及家属拒绝提供标本及临床信息用于本研究;③经病理证实为WHOⅠ级胶质瘤。76例患者中,5例因临床信息及随访信息不完整排除,1 例因患者及家属拒绝参与研究排除,剩余70 例患者,男39 例,女31 例;年龄(49.47±13.3)岁;WHO 分级:Ⅱ级29 例,Ⅲ级24 例,Ⅳ级17例;病理证实星形胶质细胞瘤30例,少突胶质细胞瘤21 例,星形少突胶质细胞瘤4 例,胶质母细胞瘤15例。本研究获得患者家属及伦理委员会同意。
1.2 主要试剂与仪器mIDH1 R132H 单克隆抗体型号1L-226购自日本株式会社免疫生物研究所;二抗反应增强液型号PV-9000、二抗增强酶标山羊抗小鼠/兔IgG 聚合物及DAB 显色液型号ZLI-9019 购自北京中杉金桥生物技术有限公司;DYY-6C型双稳定时电泳仪购自北京六一仪器厂,荧光显微镜购自日 本Nikon 公 司;RNA 提 取 液 型 号G3013,购 自Servicebio 公司;台式高速冷冻型微量离心机型号D3024R,产自DragonLab 公司;荧光定量PCR 仪型号Stepone plus,产自ABI公司;超微量分光光度计型号NanoDrop2000,产自Thermo公司。
1.3 q-PCR 分析不同胶质瘤细胞系中IDH1 的表达RNA 提取:微量移液器将培养瓶中培养液吸除干净,加入1 mL 4 ℃预冷的PBS溶液,轻摇洗涤,用微量移液器将PBS吸除干净,加入1 mL的RNA提取液,用枪头吹打,破碎细胞。将液体转移到灭过菌的1.5 mL离心管内并加入250 μL三氯甲烷,充分混匀,静置3 min,离心,将上清转移到一新的离心管中,加入异丙醇混匀,4 ℃下离心,取RNA 沉淀。75%乙醇洗涤,再次离心后去除上清液,溶解RNA,55 ℃孵育5 min。检测RNA 浓度及纯度,确保使其终浓度为100~500 ng/μL(IDH1-S:5'-GCATAGGCTCATCGA CGACAT-3';IDH1-A:5'-CAGCCTCTGCTTCTACTG TCTTGC-3')。最后进行反转录操作,定量PCR按照合适比例配置反应体系进行PCR 扩增。用CT 值对比分析不同细胞系中IDH1的表达情况。
1.4 免疫组化法检测IDH1 R132H突变表达情况以及Ki-67的表达将标本包埋、制片,然后添加一抗、二抗,DAB显色液镜下显色观察;苏木素复染、清水返蓝后中性树胶封片,镜下观察,以PBS缓冲液代替一抗作对照。根据细胞内染色情况来判断IDH1 R132H 突变表达情况,光镜下可见胶质瘤细胞内因IDH1 R132H表达不同而呈现深浅不一的棕褐色,取得免疫组化图片后,采用Image-Pro Plus6.0软件对胶质瘤细胞内染色以平均光密度值的形式进行量化,以此间接的、半定量的表示IDH1 R132H表达情况。
1.5 WB法检测IDH1 R132H突变表达情况取冰冻标本进行蛋白裂解,制备分离胶、浓缩胶,按照电泳、转膜、加一抗、孵育、过夜、加二抗、孵育、显色、曝光等步骤,得到蛋白条带。用Image J 软件对蛋白条带进行量化,将脑胶质瘤标本蛋白条带的D 值与内参GAPDH蛋白条带的D值进行相比,所得值代表蛋白表达量。
1.6 统计学方法采用SPSS 24.0进行统计学处理,所得数据经正态性检验及方差齐性检验,符合正态分布的计量资料用均数±标准差(±s)表示,采用两独立样本t检验;多样本均数两两比较采用SNK法或K-W检验,分类变量采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 胶质瘤相关细胞系中IDH1 的表达q-PCR 法检测U87、U251、LN-229、HS683、U118等5种胶质瘤细胞系中IDH1 的表达,HS683、U87 胶质细胞系中IDH1表达明显高于其他胶质瘤细胞系。见图1。

图1 不同胶质瘤细胞系中IDH1的表达量(U87、HS683的相对表达量均>50%)Figure 1 Expression of IDH1 in different glioma cell lines(The relative expression levels of U87 and HS683 both exceeded 50%)
2.2 人脑胶质瘤组织中IDH1 R132H 的表达70例人脑胶质瘤组织通过免疫组化法和WB 法检测IDH1 R132H表达(图2~3),结果显示,IDH1 R132H突变36例,突变率51.4%,20例对照组脑组织标本中IDH1 R132H 突变0 例。胶质瘤组织中WHO 分级Ⅱ级29 例,突变15 例,突变率51.7%;Ⅲ级24 例,突变19 例,突变率79.2%;Ⅳ级17 例,突变2 例,突变率11.8%;不同病理级别IDH1 R132H 突变差异有统计学意义(P<0.05)。70 例胶质瘤组织中星形胶质细胞瘤30 例,突变24 例,突变率80.0%;少突胶质细胞瘤21 例,突变11 例,突变率52.4%;星形少突胶质细胞瘤4 例,突变0 例;胶质母细胞瘤15 例,突变1 例,突变率6.7%;不同病理类型IDH1 R132H 突变差异有统计学意义(P<0.05)。
2.3 IDH1 R132H突变与脑胶质瘤患者临床因素的关系70 例胶质瘤患者年龄(49.47±13.3)岁,IDH1野生型患者年龄(53.7±12.3)岁,IDH1突变型患者年龄(45.4±13.7)岁,两者对比差异有统计学意义(P=0.008)。此外IDH1 突变与患者病理级别(P<0.001)、病理类型(P<0.001)、是否并发癫痫(P=0.034)以及Ki-67(P=0.03)的表达有关,与患者性别、肿瘤大小、肿瘤位置无关(P>0.05)。见表1。

表1 IDH1 R132H 突变与脑胶质瘤患者临床因素的关系Table 1 Relationship between IDH1 R132H mutation and clinical factors in patients with glioma
2.4 IDH1 R132H突变与临床预后的关系Ⅱ、Ⅲ级胶质瘤患者中IDH1 R132H型预后好于IDH1野生型(P<0.05),Ⅳ级胶质瘤患者中IDH1突变型和野生型患者生存期差异无统计学意义(P=0.72)。总生存期(OS)生存分析见图4。
3 讨论

图2 免疫组化法检测人脑胶质瘤组织中IDH1 R132H的表达 A:阴性对照以及Ⅱ、Ⅲ、Ⅳ级胶质瘤组织中IDH1 R132H的表达免疫组化图片(400×);B:星形、少突、星形少突胶质瘤以及胶质母细胞瘤组织中IDH1 R132H 的表达免疫组化图片(400×);C:Ⅱ、Ⅲ级胶质瘤组织中IDH1 R132H表达与阴性对照组及Ⅳ级胶质瘤组织中IDH1 R132H表达差异有统计学意义(P<0.001);D:星形胶质细胞瘤组织中IDH1 R132H表达与阴性对照组(P<0.001)及其他类型胶质细胞瘤中IDH1 R132H表达差异有统计学意义(*P<0.001)Figure 2 Expression of IDH1 R132H in human glioma was detected by immunohistochemistry. A:Negative control andⅡ,Ⅲ,Ⅳgrade glioma tissues IDH1 R132H immunohistochemical expression images(400×); B:Immunohistochemical images of IDH1R132H expression in anaplastic astrocytoma, oligodendroglioma, anaplastic oligodendroglioma, and glioblastoma (400×); C:Ⅱ,Ⅲgrade glioma tissues IDH1 R132H expression and the negative control group and Ⅳgrade glioma group in IDH1 R132H expression difference was statistically significant (P<0.001); D:The expression of IDH1 R132H in anaplastic astrocytoma was significantly different from that in the negative control group (P<0.001) and other types of glioma (*P<0.001)
2007 年世界卫生组织(WHO)中枢神经系统(central nervous system,CNS)肿瘤分类按组织学形态将胶质瘤分为Ⅰ~Ⅳ级,并认为Ⅰ级为良性,Ⅱ级为交界性,Ⅲ级为恶性,Ⅳ级为高度恶性[9]。随后IDH1突变被发现在胶质瘤的演变中发挥重要作用,并影响着胶质瘤的预后。2016 年WHO 对中枢神经系统肿瘤的新分类将IDH1 突变型与野生型作为参考因素纳入到胶质瘤的分类中[10]。IDH 是三羧酸循环中的关键限速酶,催化异柠檬酸氧化脱羧生成α-酮戊二酸(α-KG)及二氧化碳,可为细胞新陈代谢提供能量和生物合成前体物质,在生命活动中发挥重要作用[11]。IDH 也参与调节多种细胞内过程,包括氧化呼吸、谷氨酰胺代谢、脂肪生成和细胞防御氧化损伤等[12]。目前普遍认为IDH1 突变是导致胶质瘤发生的重要影响因素之一,且多项研究[13-14]显示,相同病理级别胶质瘤患者IDH1突变型预后较IDH1野生型要好,但IDH1突变导致胶质瘤发生的机制仍有待研究,目前主流观点认为IDH1突变可导致DNA和组蛋白的异常高甲基化从而导致肿瘤的发生[15]。IDHl 突变也可导致2-HG 异常增高,2-HG 是一种肿瘤细胞代谢产物,可能在恶性脑肿瘤的发生中起重要作用[16]。
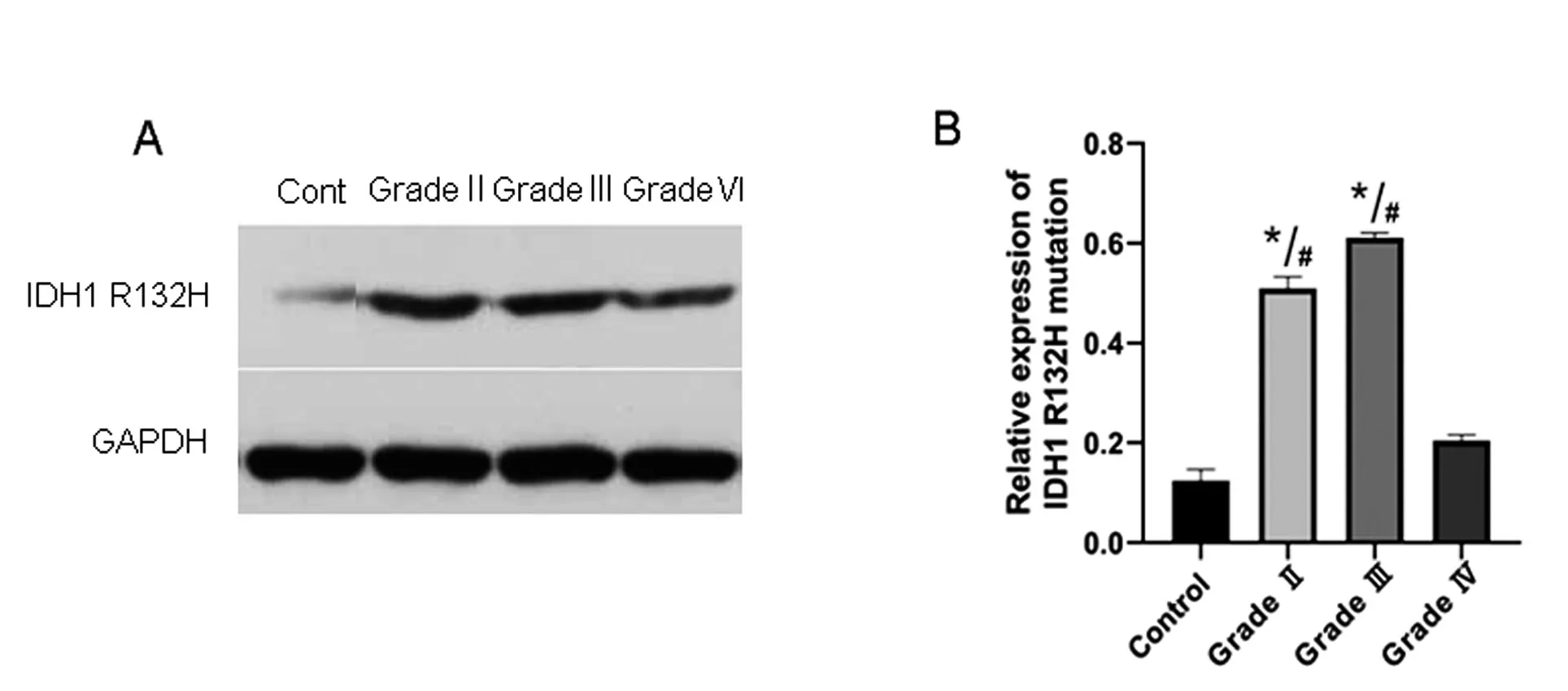
图3 WB检测人脑胶质瘤组织中IDH1 R132H的表达情况 A:阴性对照以及Ⅱ、Ⅲ、Ⅳ级胶质瘤组织中IDH1 R132H的表达蛋白条带;B:不同病理级别胶质瘤组织中IDH1 R132H表达情况,与control组比较,*P<0.05;与grade Ⅳ比较,#P<0.05Figure 3 WB was used to detect the expression of IDH1 R132H in human glioma tissues.A:Negative control and Ⅱ,Ⅲ,Ⅳgrade glioma tissues IDH1 R132H expression of the protein bands;B:Different pathological grade glioma tissues IDH1 R132H expression,compared with the control group,*P<0.05;and compared with grade Ⅳ,#P<0.05

图4 相同病理级别下IDH1 突变型与野生型生存分析 A:Ⅱ级胶质瘤患者中IDH1 突变型较IDH1 野生型预后好(P<0.05);B:Ⅲ级胶质瘤患者中IDH1突变型较IDH1野生型预后好(P<0.05);C:Ⅳ级胶质瘤患者中IDH1突变型较IDH1野生型预后差异无统计学意义(P=0.72)Figure 4 Survival analysis of IDH1 mutant and wild-type at the same pathological level. A:Ⅱgrade glioma IDH1 mutations in patients with good prognosis than IDH1 wild type(P<0.05);B:Ⅲgrade glioma IDH1 mutations in patients with good prognosis than IDH1 wild type (P<0.05); C:Ⅳgrade glioma in patients with glioma IDH1 wild type and mutant IDH1 prognosis compared to no significant statistical difference(P=0.72)
本研究进一步探讨IDH1突变与胶质瘤的关系,结果显示q-PCR法检测U87、U251、LN-229、HS683、U118 等5 种胶质瘤细胞系中IDH1 的表达,HS683、U87胶质细胞系中IDH1表达明显高于其他胶质瘤细胞系。考虑原因为不同胶质瘤细胞系来源于不同级别及不同类型的胶质瘤组织,因此细胞系之间IDH1表达存在差异,IDH1表达高者,突变率也相对较高,这也解释了IDH1 突变在不同胶质瘤中存在差异。此外,由于IDH1 突变型胶质瘤很难在体外培养,因此很多相关研究难以开展,故本研究提示HS683、U87 胶质细胞系可作为细胞实验及体外试验的研究对象,容易构建突变模型,提高实验成功率。组织学实验发现,人脑胶质瘤组织中IDH1 的突变率为51.4%,且突变多发生在Ⅱ、Ⅲ级胶质瘤中,考虑到本研究仅检测了IDH1 R132H一种突变,总体突变率偏低,但基本与国内外研究相符。此外本研究还显示,IDH1 R132H突变常见于星形胶质细胞瘤,突变率高达80%,少突胶质细胞瘤突变率为52.4%,而胶质母细胞瘤突变率则仅有6.7%。已有研究[17]报道IDH1 R132H多见于弥漫星形胶质细胞瘤和间变星形胶质细胞瘤。另有研究[18]显示IDH1 突变与胶质瘤患者并发癫痫具有一定的相关性,本研究再次证实了这一研究结果,IDH1 R132H突变与胶质瘤并发癫痫确实存在显著差异。
Ki-67是一种相对分子量为36 000的核抗原,与细胞周期关系密切[19]。Ki-67 在正常脑组织中不表达,却在脑胶质瘤中异常高表达[20-22]。本研究显示,IDH1 R132H 突变者Ki-67 表达较IDH1 野生型低,IDH1 R132H突变与Ki-67异常表达差异有统计学意义。本研究生存分析显示,在Ⅱ、Ⅲ级胶质瘤患者中IDH1 R132H突变者生存期更长,预后明显优于IDH1野生型。在Ⅳ级胶质瘤患者中,IDH1 R132H突变者与IDH1野生型预后在统计学上无明显差异。研究显示IDH1野生型的Ⅱ、Ⅲ级胶质瘤比相同病理级别的IDH1 突变型胶质瘤的预后差[23-25]。此外,亦有研究显示IDH1 突变患者对替莫唑胺的敏感度更高[26-28],使用IDH1 R132H 特异性肽的疫苗可引起特异性的抗肿瘤反应,对抗IDH1 R132H 表达的肿瘤细胞,减少颅内肿瘤的生长[29-31]。
本研究再次证实了IDH1 R132H 是影响胶质瘤发生发展的重要因素,可作为判断胶质瘤患者预后的重要标志,实验证实HS683、U87 胶质细胞系可作为研究对象,进一步行胶质瘤分子生物学研究,IDH1 R132H 影响胶质瘤的作用机制仍需进一步研究。
