FAM134B 介导的内质网自噬在无镁外液致痫海马神经元线粒体钙稳态及凋亡中的作用
2021-06-03李钰娟杜丽媛孟祥荷刘凤霞谢南昌
李钰娟 王 翠 杜丽媛 孟祥荷 刘凤霞 谢南昌
郑州大学第一附属医院,河南 郑州450052
内质网是蛋白质折叠、转运、加工和储存钙离子的重要细胞器[1]。细胞应激条件下,内质网通过自噬在维持细胞内稳态中发挥重要作用[2]。内质网自噬是一种选择性的内质网降解形式,通过内质网自噬受体吞噬内质网片段传递到自噬体中进行溶酶体降解,维持内质网形态及功能稳态[3]。FAM134B(family with sequence similarity 134,member B)是哺乳动物细胞中发现的第一个也是迄今为止最具特征的内质网自噬受体,其包含的LC3 相互作用区域(LC3-interacting regions,LIR)可诱导内质网片段化,在内质网容量和质量控制中起关键作用[4-5]。
线粒体Ca2+摄取对线粒体代谢和内质网稳态的调节至关重要[8]。当线粒体摄取大量Ca2+发生钙超载时,线粒体凋亡途径将被激活引起细胞死亡[9]。因此,严格控制内质网和线粒体之间的Ca2+交换对细胞发挥生理功能和代谢稳态十分重要。线粒体-内质网结构偶联(mitochondria-associated ER membranes,MAMs)是内质网与线粒体之间存在重要连接,可通过其中包含的钙离子转运相关蛋白,如1,4,5-三磷酸肌醇受体(inositol-1,4,5-triphosphate receptor,IP3R)等调节钙信号传导[6-7]。最新研究发现,FAM134B介导的内质网自噬在内质网稳态中发挥重要调节作用[5,10]。然而,FAM134B介导的内质网自噬是否可通过调节MAMs 调控内质网与线粒体之间Ca2+交换及线粒体凋亡途径尚不清楚。
本研究通过体外培养海马神经元,使用无镁外液构建癫痫模型,利用慢病毒干预FAM134B 表达,研究FAM134B 介导的内质网自噬对致痫海马神经MAMs及线粒体功能的影响,探讨其在体外癫痫神经元模型的线粒体钙离子稳态及凋亡中的作用。
1 材料与方法
1.1 材料试剂:无镁外液(2 mmol/L CaCl2,145 mmol/L NaCl,0.002 mmol/L 甘氨酸,10 mmol/L 葡萄糖,2.5 mmol/L KCl 和10 mmol/L HEPES,pH 7.4);正常细胞外液(1 mmol/L MgCl2和无镁外液各成分);慢病毒Lenti-FAM134B、Lenti-FAM134B-shRNA和LentipGV(上海吉凯基因公司);TUNEL试剂盒(德国Roche公司);NSE抗体(武汉博士德生物公司);内质网钙离子荧光探针Mag-Fluo-AM 试剂盒(上海杰美公司);钙离子荧光探针Rhod-2试剂盒(上海哈灵公司);βactin、LC3B、Cox-Ⅳ、IP3R抗体(美国CST公司);CytC 抗体(美国Santa Cruz 公司);cleaved caspase-3(英国Abcam)。动物:出生24 h内Sprague-Dawley 大鼠[郑州大学实验动物中心提供,许可证号SCXK(豫)2010-0002]。
1.2 海马神经元原代培养手术器械高压高温灭菌,将SD大鼠置于超净台,75%乙醇浸泡后分离出大鼠海马神经元去除表面血管膜。经胰酶消化海马组织后制成细胞悬液,将神经元提前使用左旋多聚赖氨酸包被好于培养板中。种板4 h 后将更换培养基为维持培养基,并定期半量更换培养基1次。培养至第7天鉴定神经元纯度>90%待用。
1.3 慢病毒转染取培养5 d的原代海马神经元,分组后按照感染复数MOI=15 分别转染慢病毒Lenti-FAM134B、空载病毒Lenti-pGV 或Lenti-FAM134BshRNA。感染12 h后用维持培养基换液,继续培养3 d于荧光显微镜下观察荧光行后续试验。
1.4 实验分组将原代海马神经元分5 组:对照组(CON 组)、无镁诱导组(AE 组)、空载病毒组(NC组)、Lenti-FAM134B 组(FAM134B 过表达组)和Lenti-FAM134B-shRNA 组(FAM134B 低表达组)。培养至第10天,CON组用正常细胞外液处理3 h,AE组用无镁外液处理3 h 诱导癫痫模型,NC 组、FAM134B 过表达组和FAM134B 低表达组分别转染相应慢病毒,继续用维持培养基培养至第10天经3 h无镁外液处理诱导癫痫模型,然后各组神经元用维持培养基继续培养24 h。
1.5 TUNEL 染色法分别取各组细胞将其接种到爬片上,使用4%多聚甲醛固定,PBS 浸洗后,再使用0.1%TritonX-100 处理。将含神经元的细胞爬片加入TUNEL 反应液后置于湿盒中孵育,经DAPI 复染后,在荧光显微镜下观察。
1.6 内质网钙离子浓度测定各组继续用维持培养基培养24 h 后,使用荧光探针Mag-Fluo-AM 测定内质网钙离子浓度。各组神经元按照内质网钙离子浓度荧光检测试剂盒产品说明书操作,使用荧光显微镜测定各组神经元内质网钙离子浓度。
1.7 线粒体钙离子浓度测定各组继续用维持培养基培养24 h后,使用荧光探针Rhod-2测定线粒体钙离子浓度。各组神经元按照线粒体钙离子浓度荧光检测试剂盒产品说明书操作,使用荧光显微镜测定各组神经元线粒体钙离子浓度。
1.8 观察细胞形态去除培养基后将神经元收集至离心管中,加入戊二醛固定2 h,使用系列浓度乙醇脱水。包埋切片后使用醋酸铀-枸橼酸铅双染色,电镜下观察神经元线粒体超微结构。
1.9 Western blotting 检测不同蛋白的表达分别提取全蛋白、胞质蛋白和线粒体蛋白并测量提取蛋白浓度。采用SDS-PAGE 凝胶电泳后转膜并封闭,在4 ℃用一抗β-actin(1∶2 000)、Cox-Ⅳ(1∶2 000)、LC3B(1∶1 000)、IP3R(1∶1 000)、CytC(1∶1 000)和cleaved caspase-3(1∶300)孵育过夜。次日洗膜后加入二抗于摇床上室温孵育1 h。洗膜后使用ECL 发光液显像。蛋白条带使用Image J软件分析。
1.10 统计学处理应用SPSS 19.0 软件处理数据,实验数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用Newman-Keuls检验。以P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒转染后FAM134B 蛋白的表达变化AE 组 中FAM134B 表 达 高 于CON 组(P<0.05),FAM134B 过表达组FAM134B 表达显著高于AE 组,FAM134B 低表达组FAM134B 表达显著低于AE 组(P<0.05),NC组与AE组比较差异无统计学意义(P>0.05)。见图1。

图1 各组海马神经元FAM134B蛋白表达水平Figure 1 Expression of FAM134B in hippocampal neurons of different groups
2.2 神经元凋亡检测FAM134B 过表达组中神经元凋亡较AE组显著减少,FAM134B低表达组神经元凋亡较AE 组显著增加(P<0.05),NC 组与AE 组比较差异无统计学意义(P>0.05)。见图2。

图2 TUNEL法检测细胞凋亡Figure 2 Neuronal apoptosis was detected using a TUNEL assay
2.3 各组神经元LC3-Ⅱ/Ⅰ和IP3R 表达水平AE组 中LC3-Ⅱ/Ⅰ较CON 组 显 著 升 高(P<0.05),FAM134B 过表达组LC3-Ⅱ/Ⅰ比值较AE 组显著升高,FAM134B 低表达组较AE 组显著降低(P<0.05),NC 组与AE 组比较差异无统计学意义(P>0.05)。见图3A。与CON 组相比,AE 组中IP3R 表达升高(P<0.05);与AE组相比,FAM134B过表达组IP3R表达显著升高,FAM134B低表达组显著降低(P<0.05);NC组与AE组比较差异无统计学意义(P>0.05)。见图3B。

图3 A:各组海马神经元LC3-Ⅱ/Ⅰ的表达水平;B:各组海马神经元IP3R蛋白表达水平Figure 3 A:The LC3-Ⅱ/LC3-Ⅰratios of different groups in hippocampal neurons; B:The IP3R levels of different groups in hippocampal neurons
2.4 各组神经元内质网与线粒体之间的钙离子交换与CON组相比,AE组中内质网Ca2+浓度降低,而线粒体Ca2+浓度升高(P<0.05);与AE 组相比,FAM134B 过表达组内质网Ca2+浓度增加,而线粒体Ca2+浓度降低,FAM134B低表达组内质网Ca2+浓度降低,而线粒体Ca2+浓度增加(P<0.05);NC 组与AE 组比较差异无统计学意义(P>0.05)。见图4。

图4 A:各组海马神经元内质网Ca2+浓度;B:各组海马神经元线粒体Ca2+浓度Figure 4 A: ER Ca2+ concentrations in hippocampal neurons of different groups; B: Mitochondrial Ca2+concentrations in hippocampal neurons of different groups
2.5 电镜下观察各组神经元线粒体超微结构CON组中线粒体双层膜结构清楚,嵴致密且排列整齐;AE组和NC 组中线粒体结构被破坏,可见线粒体肿胀,嵴排列紊乱,内部空泡样变性;FAM134B过表达组线粒体结构损伤较AE组显著减轻,FAM134B低表达组较AE组显著加重,可见明显线粒体肿胀及内部空泡样变性。见图5。
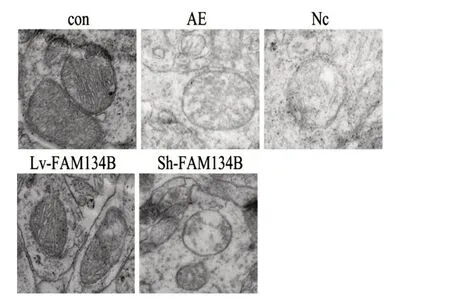
图5 各组海马神经元线粒体电镜下超微结构Figure 5 Ultrastructure of mitochondria under electron microscope in hippocampal neurons of different groups
2.6 各组神经元的CytC释放和caspase-3活化与CON 组相比,AE 组中CytC 释放和caspase-3 活化增加(P<0.05);与AE 组相比,FAM134B 过表达组CytC释放和caspase-3活化减少,FAM134B低表达组CytC释放和caspase-3 活化增加(P<0.05);NC 组与AE 组比较差异无统计学意义(P>0.05)。见图6。

图6 各组海马神经元线粒体CytC、胞质CytC及Caspase-3活化Figure 6 The levels of mitochondrial and cytosolic CytC and cleaved caspase-3 in hippocampal neurons of different groups
3 讨论
本研究发现过表达FAM134B 减少MAMs 中IP3R表达,减少内质网与线粒体间Ca2+交换,抑制线粒体凋亡途径,减少无镁外液致痫海马神经元凋亡,而降低FAM134B 表达则发挥相反作用,表明FAM134B介导的内质网自噬通过调节无镁外液致痫海马神经元MAMs 对神经元线粒体钙稳态和凋亡发挥保护作用。
内质网是细胞内最大的膜性细胞器,在蛋白质折叠和钙信号传导方面发挥重要作用[11]。为了维持细胞内环境的稳定,内质网可根据细胞应激条件调整其形状和大小[12]。研究发现内质网膜的动态变化受内质网自噬调控,各种应激条件,如钙离子异常、氧化应激均可诱发内质网应激,继而激活内质网自噬[13]。内质网自噬可通过降解受损内质网、未折叠蛋白质和清除冗余内质网膜维持内质网体积及功能[3,14]。FAM134B 作为介导内质网自噬的重要受体,可诱导内质网片段化,通过其包含的内质网同源结构域促进内质网膜重构,并通过LIR结合自噬相关蛋白LC3促进内质网与溶酶体结合降解多余的内质网膜,控制内质网的体积以维持细胞稳态[5]。本研究表明,FAM134B过表达明显增加体外癫痫海马神经元中自噬标记物表达且减轻致痫神经元凋亡,而降低FAM134B表达则起相反作用,提示FAM134B可以调节体外癫痫神经元内质网自噬水平,在神经元凋亡中起重要作用。
Ca2+是细胞的第二信使,在细胞新陈代谢、细胞死亡和存活等多个过程中发挥重要调节作用[1]。内质网作为细胞内最重要的Ca2+储存库,在癫痫发作时可释放大量Ca2+进入胞质,线粒体可通过摄取过量Ca2+发挥代偿作用维持细胞稳态[15]。内质网与线粒体之间的连接部位MAMs 与多种生理过程如内质网应激、线粒体稳态、Ca2+信号调控和细胞凋亡等密切相关,可使Ca2+快速进入线粒体[16]。IP3R作为MAMs中重要的钙离子通道,可通过介导内质网Ca2+释放在内质网与线粒体之间形成高钙微区使线粒体内Ca2+浓度升高[8]。同时,IP3R可与MAMs中其他Ca2+相关蛋白如电压依赖性阴离子通道和伴随蛋白葡萄糖调节蛋白相互协作,促进线粒体Ca2+摄取[17]。本研究发现,无镁外液致痫海马神经元中IP3R水平升高,内质网Ca2+浓度降低,而线粒体Ca2+浓度升高,提示癫痫可能通过提高MAMs中IP3R水平增加内质网与线粒体间的Ca2+交换。FAM134B过表达显著降低了体外癫痫海马神经元IP3R 表达,减少了内质网与线粒体间Ca2+交换,而降低FAM134B表达则起相反作用,提示FAM134B 可调节MAMs 中的IP3R 水平和内质网与线粒体之间的Ca2+交换,在癫痫线粒体钙离子稳态及神经元凋亡中发挥重要作用。
研究表明,线粒体在诱导细胞程序性凋亡或死亡过程中发挥重要作用[18]。线粒体Ca2+摄取是调控线粒体代谢和内质网稳态的关键,但过量Ca2+进入线粒体时将进一步导致线粒体发生功能障碍[19]。研究发现,IP3R 介导内质网释放大量Ca2+转移至线粒体内将引起线粒体钙超载[17]。线粒体钙超载可导致线粒体通透性转换孔开放,诱发线粒体膜电位去极化、呼吸链与氧化磷酸化解耦连,进而导致线粒体基质肿胀甚至外膜破裂[20]。CytC 位于线粒体内膜上,是线粒体呼吸链的重要组成部分,在线粒体凋亡途径中发挥重要作用。线粒体钙超载时,CytC 可由开放的线粒体通透性转换孔从线粒体膜间隙释放到胞浆间隙。胞浆中的CytC 与凋亡蛋白酶活化因子-1(APAF-1)相互作用结合形成凋亡小体,募集激活caspase-9,而caspase-9将进一步激活下游的凋亡因子caspase-3[20-21]。caspase-3的激活在神经元凋亡中发挥极其重要的作用,可活化线粒体凋亡途径,进而导致细胞死亡[22]。本研究发现,体外癫痫海马神经元中线粒体存在明显损伤,CytC 释放和caspase-3活化增加。FAM134B过表达可以减轻癫痫海马神经元线粒体损伤,抑制癫痫海马神经元CytC 释放和caspase-3 活性,而低表达FAM134B 发挥相反作用,提示FAM134B 可能通过调节线粒体介导的凋亡途径对癫痫神经元凋亡发挥重要作用。
FAM134B 介导的内质网自噬可能对无镁外液致痫海马神经元线粒体钙稳态及凋亡发挥保护作用,其机制可能为通过调节MAMs 中的IP3R 水平改变内质网与线粒体之间的Ca2+交换,减轻线粒体损伤,减少CytC的释放,抑制线粒体凋亡通路的激活。
