气候变暖与富营养化交互作用对浅水湖泊水-气界面N2O通量的影响
2021-06-02胡博文石彭兰
胡博文 潘 萌 石彭兰 徐 军 张 敏
(1. 华中农业大学水产学院, 池塘健康养殖湖北省工程实验室, 教育部长江经济带大宗水生生物产业绿色发展工程研究中心,武汉 430070; 2. 中国科学院水生生物研究所, 武汉 430072)
温室气体(Greenhouse gases)的大量排放与近年来的全球变暖密切相关[1], N2O作为一种重要的温室气体在大气中的浓度以年均(0.25±0.05)%的速度稳定增长[2], 估算对全球变暖的贡献率已达到6%以上[3], 排在CO2和CH4之后, 位列第三。现有的研究认为, 淡水生态系统中生成的CO2、CH4和N2O主要通过水体和沉积物进一步参与到生物地球化学循环过程[4]。全球变暖不仅会导致平均气温的升高, 还会使热浪(Heat waves, HW)等极端天气事件的发生频率显著增加[5—7]。这些事件将导致淡水生态系统尤其是浅水湖泊的理化性状及其功能特征受到强烈影响。近年来人类活动对湖泊的干扰加剧, 外源性的氮、磷负荷显著增加, 致使富营养化趋势逐渐明显, 进而对湖泊中氮的循环及N2O排放产生重要影响[8]。
国内外对于湖泊N2O交换过程的研究已有较多报道, 湖泊通常被认为是N2O的潜在排放源。Kortelainen等[9]估算芬兰及北方湖泊N2O的排放量分别达到0.6和29 Gg N2O-N/y, 表明N2O在这些区域具备显著的全球变暖潜力(Global warming potential)。国内的许多研究如太湖[10]、白洋淀[11]和鄱阳湖[12]的N2O交换过程在监测的绝大部分时间内也是以排放现象为主。尽管湖泊N2O的排放趋势明显, 但在不同区域的响应程度也存在差别。谢燕红等[13]对内陆水体479个湖泊N2O通量的纬度和营养状况的分析结果表明, N2O通量呈现随纬度升高而降低, 随营养水平升高而升高的变化特征。因此,区域之间的温差及营养水平的差异均会对湖泊N2O的交换产生显著的影响。区域性湖泊N2O通量表现出与温度及营养水平之间的相关性, 但其内在机制仍需通过控制实验进一步探究。现有的研究主要集中在温带地区, 也解释了该区域影响N2O排放规律的内在联系, 如Davidson等[4]在长期运行的控制实验中, 通过设置升温和营养盐添加的交互作用观测温室气体交换过程的响应变化, 发现高浓度的氮磷营养盐添加显著增加了系统内N2O的排放量, 但升温的直接影响却并不显著; Audet等[14]则在升温与营养盐添加的基础上进行了模拟夏季热浪的控制实验, 其结果表明N2O的排放对营养水平的响应不显著, 而热浪则显著促进了夏季N2O排放量的增长。
湖泊中N2O的产生主要依赖于水体与沉积物的微生物过程[15,16], 主要包括硝化、反硝化、硝化-反硝化耦合和硝酸盐异化还原为铵等作用[17,18]。一般认为硝化作用的最适宜温度为25—30℃, 反硝化作用的最适宜温度在30℃以上[19]。水温的适度升高能够增强沉积物界面反硝化菌群的活性, Silvennoinen等[20]对不同溶氧与温度条件下监测沉积物界面反硝化作用的研究发现升温能够显著加快反硝化的速率并且有利于反应的完全进行生成大量N2而降低了产物中N2O与N2的比值。水体中的氮营养元素及其浓度变化对N2O产生所起到的作用已有较多研究, 氮营养元素增加通常能显著促进N2O的排放[21]。磷营养元素的增加导致水体富营养化, 进而影响N2O的产生过程, 但是否存在直接作用仍需进一步探讨。根据现有的研究推测, 在升温情景下, 水域环境中理化因子和生物因子的积极响应能够显著影响N2O微生物过程, 进而引起水-气界面间N2O交换量的变化。例如水体中的溶氧状况对氮素转化途径的影响起到直接作用[22]。水温的升高能够促进沉积物中内源性磷的释放[23], 并且随着外源性营养物质的过量输入, 湖泊暴发水华的风险将显著上升。藻类的过度生长将消耗掉水体中大量的溶氧, 同时若存在有机碳的外源输入, 将影响氧气的消耗速率, 进而为水体创造出更适宜于N2O产生的厌氧微环境[24], 促使富营养化湖泊成为气候变化的潜在驱动者。
我国的富营养化浅水湖泊大部分集中于长江中下游地区[25], 未来气候变化趋势下长江中下游地区典型浅水湖泊生态系统中N2O的交换过程将会发生怎样的变化, 值得密切关注。中尺度围隔是一种适合模拟温度和营养物质的变化如何影响浅水湖泊生态系统在长期和不同营养水平下各种物质动态变化的研究方法[26], 适宜于进一步的探讨湖泊生态系统的内在响应机制。本研究以中尺度围隔(Mesocosm)控制系统模拟21世纪末期长江中下游地区典型浅水湖泊变暖(恒定升温及波动升温)与富营养化情景, 旨在评价水体营养水平升高、季节性温度变化及不同变暖模式对N2O通量的影响, 探讨气候变化与富营养化的交互作用下浅水湖泊水-气界面N2O交换的响应机制。
1 材料与方法
1.1 实验地点与系统构建
中尺度围隔控制系统位于湖北省武汉市华中农业大学水产养殖国家级实验教学示范中心, 48个相互独立的塑料水缸(直径=1.5 m, 高度=1.4 m)均匀分布。控制系统通过3种相互联系的组件实现加热功能的稳定运行: 每个围隔中都包含2个均匀放置的温度传感器和1个固定功率的加热元件(600 W),及一台全天运行的混合潜水泵。同时, 控制系统通过与远程电脑的连接实现温度实时观测与每日温度数据云端自动上传的功能。本实验于2017年10月期间在梁子湖敞水区采集表层沉积物, 充分混合均匀后加入围隔系统内, 铺设沉积物的厚度为10 cm, 并注入深度为1 m的梁子湖水。控制系统内加入湖水的初始TN浓度为0.56 mg/L, 初始TP浓度为0.065 mg/L。在准备工作结束后, 待系统稳定2个月后开始实验, 本实验始于2018年1月1日, 止于2018年12月31日。
实验设计包括3种温度模式与2种营养盐模式的处理, 交互后共计6个处理组, 每个处理组6个平行, 利用随机数抽取器将实验的处理随机分配至36个中尺度围隔中。6个处理组分别表示为: 对照组(C)自然水温, 在温度和营养水平方面模拟梁子湖的现有状态; 固定升温组(T)依据RCP8.5情景, 模拟本世纪末期的升温情况[3], 设置恒定升温4℃; 波动升温组(V)在固定升温的基础上考虑温度波动的情形, 根据多项研究预测的极端气候事件持续时间和频率[3,27—30], 总共设定15次升温趋势的波动, 持续时间在2—12d, 以及17次降温趋势的波动, 持续时间在3—11d, 最终保持该处理总热量输入与恒定升温处理一致; 磷添加组(P)是在自然水温条件下每2周向水体中加入磷酸二氢钾(KH2PO4) 25 μg/L(磷的添加量和频率根据高伟等[31]及黄文钰和许朋柱[32]的研究结果并进行适当的调整, 用以模拟梁子湖的富营养化进程); 固定升温添加磷组(TP)是在自然水温的基础上恒定升温 4℃, 并且每2周向水体中加入KH2PO425 μg/L; 波动升温添加磷组(VP)是在恒定升温 4℃同时考虑温度波动情景, 同时每2周向水体中加入KH2PO425 μg/L。
1.2 样品采集与测定
实验期间, 1—2月每2周1次、其余月份每周1次的频率在控制系统中进行样品采集及水体理化指标进行现场监测。pH、电导率和溶解氧(Dissolved Oxygen, DO)等参数由HQ40d多功能水质分析仪(HACH, 美国)进行现场测定。利用有机玻璃柱状采水器(长度=1 m, 直径=70 mm)取得混合水样, 过滤水样通过Whatman GF/C滤膜抽滤后获得。水体中的TN、TP、硝态氮和氨态氮参照《水和废水监测分析方法(第四版)》[33]进行测定, 水体叶绿素a(Chlorophylla, Chl.a)的测定方法参照杨玉珍等[34]对“热乙醇”法的优化。溶解性有机碳(Dissolved Organic Carbon, DOC)由Vario TOC总有机碳分析仪(Elementar, 德国)测定。浮叶植物和沉水植物的生物量分别进行测定,浮叶植物直接估算其盖度, 沉水植物则估算其浸水体积(Plant volume inhabited, PVI), 具体计算公式为“PVI指数=植物盖度×植物高度/水深”[35], 以此来反映2种类型水生植物的生物量特征。
N2O交换通量采用漂浮箱-气相色谱法进行分析测定。漂浮箱箱体为聚乙烯材质的一端开口圆桶(内径=45 cm, 总高度=50 cm), 箱体外部固定有质量均匀的浮圈, 并通过固定高度使箱体的下部浸没在水面以下约5 cm, 以此确保采样期间箱体下部的密闭性, 漂浮箱的工作原件设有气压平衡管、采样管和温度探头, 箱体外部均用铝箔完全覆盖以反射阳光并尽量减少内部升温。实验期间, 每月中下旬选取天气晴朗的一日于8:30—11:30完成气体的采集工作, 具体操作步骤为每一批次气体采集前将漂浮箱横置3min使其与周围空气充分混匀, 随后将其平稳放置于水面并待水面静止, 于 2min、14min和26min抽取气体样品共3次。第一次取样时先进行2次排空, 随后再将30 mL注射器注满, 余下2次抽取气体样品仅需进行一次排空。待完成气体样品采集后, 于48h内完成N2O气体样品的测定。具体的操作方法为: 使用带有三通阀的 30 mL医用注射器将10 mL气体样品注入至CA-6手动气体进样仪并连用GC 7890气相色谱工作系统(Agilent, 美国)完成测定工作, N2O浓度由电子捕获检测器(ECD)测得, 工作温度设置为300℃, 利用两根内径为2 mm, 长度分别为1和3 m的 80—100目的Porapak Q不锈钢分离柱完成对N2O的分离和反吹,柱箱温度55℃, 载气为高纯 N2(纯度>99.999%), 流量为25 cm3/min。
通过计算可得到气体浓度随时间的变化速率(回归曲线的斜率,为确保良好的线性关系, 仅选取R2≥0.90的实验数据)。交换通量公式如下所示:
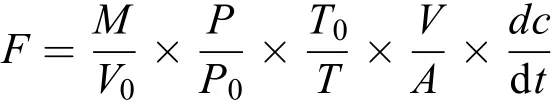
式中,F为N2O交换通量,M为N2O的摩尔质量44 g/mol,P0和T0是标准状态下的大气压力和温度,V0为目标化合物在标准状态下的摩尔体积,V/A在规则箱体中转化为水面上方的有效箱高,P和T为采样时箱内的实际气压和气温, dc/dt为漂浮箱体内N2O气体浓度随时间变化的斜率(ppm/h)。
通过对实验期间每一个处理组内的月均N2O交换通量数据进行加法运算, 以此表示N2O年累积交换量。若年累积交换量为负值则处理组在全年尺度上表现为大气N2O的汇, 而年累积交换量为正值则处理组在全年尺度上表现为大气N2O的源。年累积交换量公式如下所示:
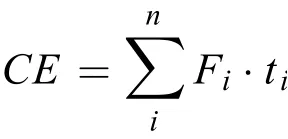
式中,CE(Cumulative exchange)表示N2O的年累积交换量g/(m2·y),n为全年总的采样次数,Fi表示为第i月的平均N2O交换通量,ti表示为第i月的天数。
1.3 数据分析
实验数据依据季节性的变化特征将整个实验周期具体划分为冬季12月和1—2月, 春季3—5月,夏季6—8月和秋季9—11月。对所有的环境因子进行月均值的处理, 对应于N2O交换通量的月度数据。统计分析均采用R软件(version 3.6.1)完成。通过对实验数据的正态性及方差齐次性检验发现, 大部分不满足正态分布与方差齐次性的条件, 进行数据转化后仍有大部分数据无法满足检验条件, 所以选择多个独立样本的非参数检验方法(Kruskal-Wallis 秩和检验)检测处理组间参数的显著性, 测试不同时期的处理组间对控制系统水-气界面N2O交换通量的影响, 并通过Spearman相关分析筛选显著影响于水-气界面N2O交换的环境因子并探究其影响机制。所有的实验数据的绘图工作均通过GraphPad Prism软件(version 8.0.2)制作完成。最终处理的实验数据全部以均值±标准误的结果表示,统计性检验以P<0.05标注显著差异。
2 结果
2.1 控制系统内环境因子的变化特征
水温实验期间, 控制系统内不同处理组的日均水温变化趋势如图 1所示。控制系统内T组和TP组的水温在整个实验期间恒定高于自然水温(C组和P组的水温)4℃左右, 而波动升温的V组和VP组水温则在固定升温4℃的基础上表现出0—8℃的波动变化。
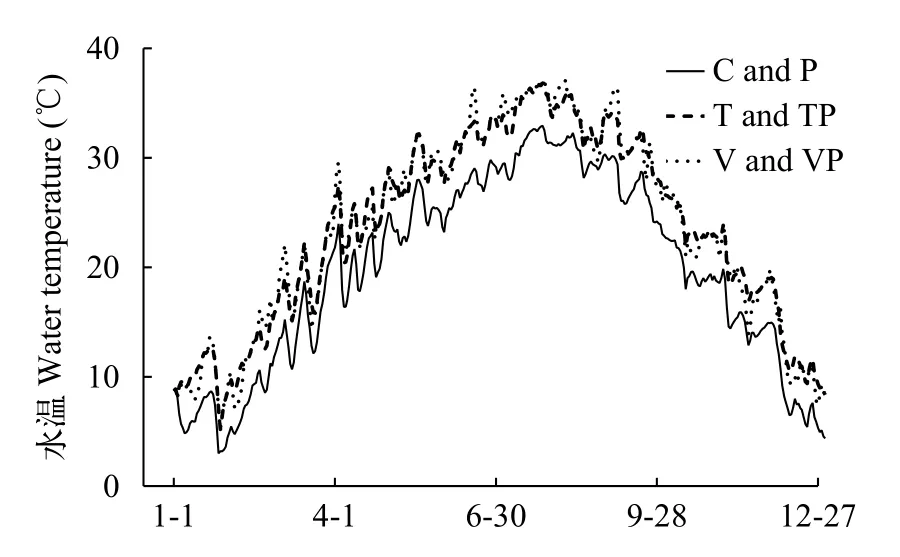
图 1 实验期间控制系统内不同处理组的日均水温变化趋势Fig. 1 Daily average water temperature in different treatments in mesocosms during the whole experiment period
季节间的水温变化趋势明显, 常温的处理组(C和P)、固定升温的处理组(T和TP)和波动升温的处理组(V和VP)的冬季均温分别为(7.45±0.28)℃、(11.43±0.28)℃和(11.16±0.33)℃, 春季均温分别为(20.16±0.47)℃、(24.19±0.48)℃和(24.27±0.48)℃,夏季均温分别为(29.55±0.22)℃、(33.31±0.21)℃和(33.71±0.25)℃, 秋季均温分别为(20.86±0.54)℃、(24.81±0.53)℃和(24.63±0.60)℃, 水温总体表现出冬季低、夏季高和春秋两季变化快的特征(图 1)。
电导率、溶解氧和pH控制系统实验期间电导率(图 2A)的变化范围为171.03—426.50 μS/cm,冬季的水体电导率高, 春季则下降至实验期间的最低水平, 而在夏、秋季又呈现出逐渐回升的趋势。水体中DO(图 2B)的波动变化相对强烈, 处理组间的变化保持一致, DO在冬季的浓度均值为(11.50±0.37) mg/L、春季的浓度均值为(9.79±0.16) mg/L、夏季的浓度均值为(4.59±0.31) mg/L和秋季的浓度均值为(3.37±0.28) mg/L。水体pH(图 2C)在实验期间的变化范围在6.88—10.37, 总体上实验期间不同处理组间pH均表现出冬春季上升、夏秋季下降的趋势。
碳、氮、磷含量不同处理水体中DOC含量(图 2D)整体呈现春、夏季上升, 随后秋、冬季下降的趋势, 于夏季到达峰值。统计结果表明整个实验期间内处理组间的DOC含量存在显著差异(P<0.01), 且C组和P组长期处于较低的水平。水体中的TN(图 2E)在整个实验期间持续表现出强烈的波动性, 其变化范围在0.19—2.16 mg/L, 而季节性的变化趋势并不明显(P>0.05)。TP(图 2F)的变化范围在0.006—0.352 mg/L, 总体上呈现为随冬、春和夏季的演替逐渐升高而后在秋季下降的变化特征。水体中(图 2G)含量有着明显的季节性变化特征, 冬季的含量最高, 春季相对较低,夏、秋季节缓慢升高, 且整个实验期间处理组间的含量显著不同(P<0.01), 其中P组的N含量显著低于T组(P<0.05)和V组(P<0.05)。水体中(图 2H)的含量随季节交替呈现出逐渐升高的变化趋势, 但在整个实验周期内处理组间的含量无显著差异(P>0.05)。
藻类与水生植物的变化在整个实验期间,控制系统中处理组间的水体Chl.a含量(图 2I)在夏秋季节均显著升高, 同时C组的Chl.a含量显著低于T组(P<0.05)、P组(P<0.05)和VP组(P<0.01)。系统中沉水植物与浮叶植物的季节性变化特征如表 1所示, 沉水植物的优势种为菹草(Potamogeton crispus),主要出现于冬、春季节, 沉水植物PVI指数(冬春)的变化范围为0—91.29%, 均值为(44.69±2.25)%, 处理组间在冬季的沉水植物PVI指数显著不同(P<0.01),表现为C和P组低于T、TP、V和VP组; 而在春季,处理组间沉水植物PVI指数无显著差异(P>0.05)。此外, 系统中的浮叶植物主要为菱(Trapa bispinosaRoxb.)和芡实(Euryale ferox), 生长期集中于夏秋2个季节, 浮叶植物盖度(夏秋)为0—98.33%, 均值为(25.35±2.15)%, 处理组间在夏、秋季的浮叶植物盖度均表现为P组>C组>T组>V组>TP组>VP组。
2.2 控制系统内处理组间N2O交换通量的变化特征
N2O交换通量的季节性变化十分显著。冬季各处理组均表现为N2O吸收, 控制系统内所有的处理组均表现为N2O的汇; 春季N2O交换通量与全年的变化趋势一致, C组、T组和V组呈现出N2O从水体向大气排放, 而P组、TP和VP组则呈现为水体吸收大气中的N2O, 其中T组的N2O交换通量显著高于P组(P<0.05)和TP组(P<0.05); 夏季期间N2O在水-气界面间的交换过程更为复杂, T和TP组表现为水体向大气吸收N2O的状态, 而C、V、P和VP组则表现为水体向大气排放N2O的状态; 秋季控制系统内(特别是升温的T组和V组)水-气界面间N2O的交换则表现出十分强烈的排放现象(图 3)。
统计检验表明(表 2), V组的全年平均N2O交换通量显著高于添加了磷营养盐的P组(P<0.01)、TP组(P<0.05)和VP组(P<0.05), 表现出添加磷营养盐之后控制系统内水-气界面N2O的排放量显著减少,这与水-气界面N2O年累积交换量得到的结果相一致(图 4), C、T和V组的N2O年累积交换量分别为0.0039、0.0094和0.0200 g/(m2·y), 而P组、TP组和VP组的N2O年累积交换量分别为–0.0049、–0.0065和–0.0018 g/(m2·y), 磷营养盐的添加促进控制系统内水-气界面间N2O由排放向吸收的转换。
2.3 控制系统内处理组间N2O交换通量与不同环境因子的相关性分析
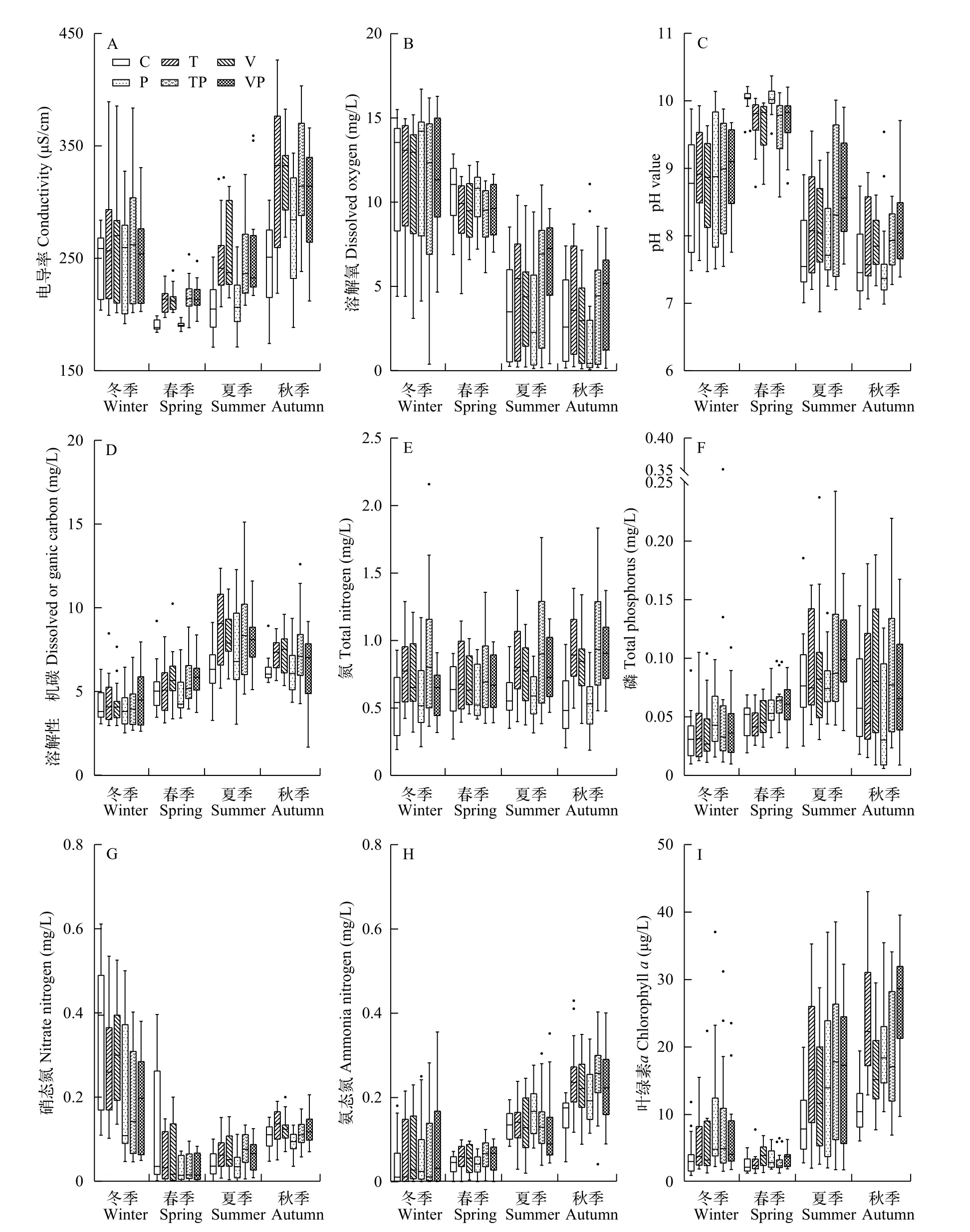
图 2 控制系统内处理组间环境因子的季节性变化特征Fig. 2 Seasonal variation of environmental factors between experimental treatments in the mesocosms
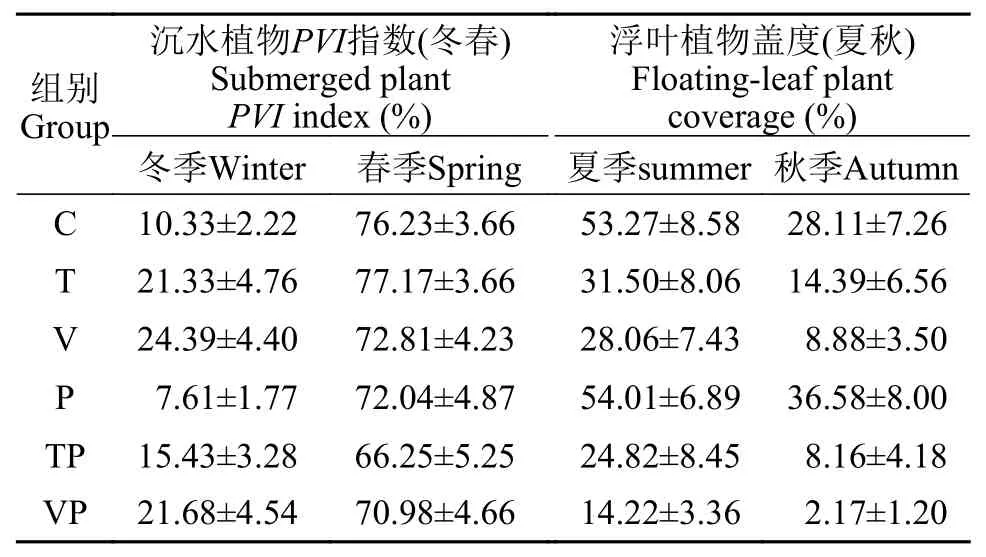
表 1 实验期间控制系统内不同处理的沉水植物PVI指数和浮叶植物盖度的季节性变化特征(均值±标准误)Tab. 1 Submerged plant PVI index and floating-leaf plant coverage of each treatment in mesocosms during the different seasons (Mean±SD)
3 讨论
3.1 升温对水-气界面N2O交换的影响
现有的研究表明, 浅水泊生态系统中N2O的生成与排放过程均会受到水温升高的显著影响。例如当水温高于5℃时, 沉积物界面的反硝化菌群活性与自然水温表现出显著的正相关性[36]。水体中N2O的饱和溶解度也会随着温度的升高而降低, 这可能有利于水-气界面N2O排放量的增加[37]。本研究的结果显示, 处理组间N2O交换通量的季节性变化十分显著, 6个处理组在冬季均表现为N2O由水体向大气的吸收, 而其他季节(尤其是T和V组)则主要表现为N2O由水体向大气的释放。统计检验表明(表 2), 整个实验期间V组的年均N2O交换通量显著高于添加磷营养盐的各处理组, 而恒定升温与波动升温处理中水-气界面N2O年累积交换量也相对较高。这种效应与代谢理论具有一致性, 代谢理论认为温度升高与温室气体排放速率的增加有显著相关性[38,39]。Soued等[40]对加拿大魁北克地区不同类型水体的N2O交换通量进行了监测并结合全球区域性湖、库的研究结果发现, 总体上热带地区的年N2O排放量最高, 分别是温带地区的10倍和寒带地区的23倍, 表明温度是影响N2O排放的一个重要因素。对北欧地区的湖泊[8,41]、我国太湖[42]及三峡水库[43]等水体N2O季节性排放规律的相关研究也发现, N2O的排放量在平均水温更高的夏、秋季要高于处于全年平均水温最低时候的冬季。在近期的一项控制实验中也得到类似结果, Audet等[14]在长期运行的控制系统中发现模拟夏季热浪会显著促进温室气体(尤其是CH4和N2O)的排放。进一步说明水温的升高通常能够对湖泊水体N2O的排放起到促进作用。
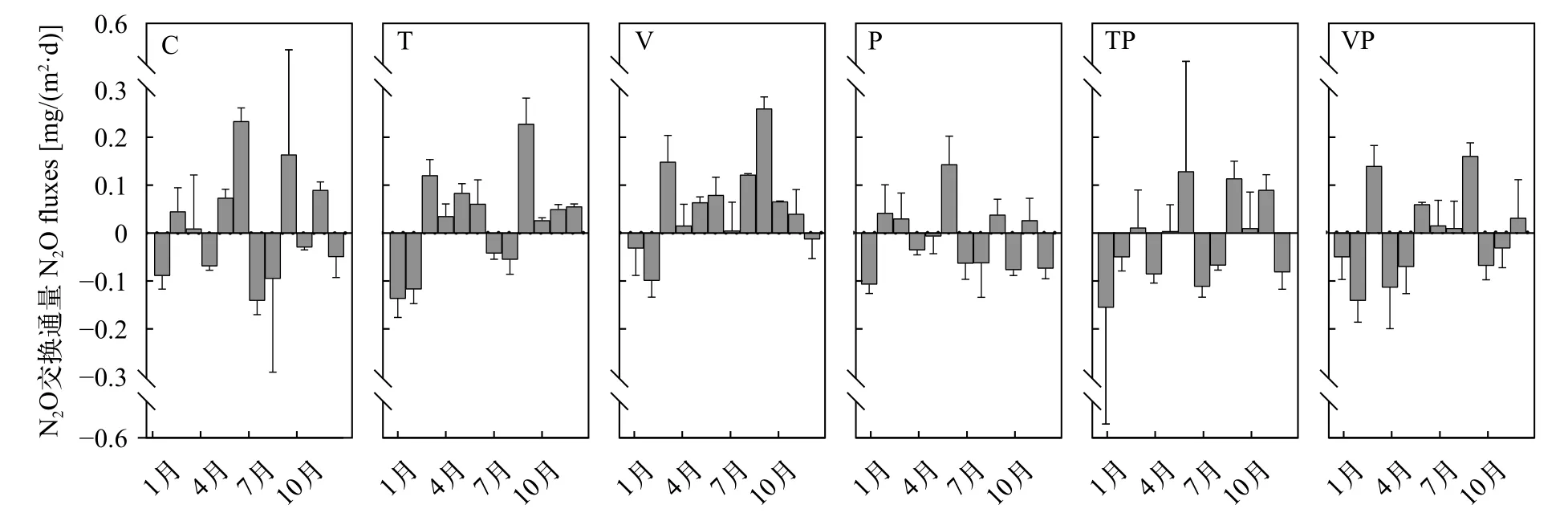
图 3 控制系统内不同处理N2O交换通量的月度变化特征Fig. 3 Monthly N2O fluxes of each treatment in the mesocosms

表 2 控制系统内不同季节N2O交换通量的组间变化特征(均值±标准误)Tab. 2 N2O fluxes of each treatment in mesocosms during the different experiment periods (Mean±SD)

图 4 控制系统中不同处理水-气界面间N2O年累积交换量Fig. 4 Total annual N2O flux in water-air interface of different treatments in the mesocosms
3.2 磷添加对水-气界面N2O交换的影响
有研究表明, 富营养钙质湖泊的N2O含量与CH4含量分布特征类似, 均呈较高的浓度水平[44],表明湖泊营养状态与温室气体浓度关系密切, 进一步说明富营养化可能导致温室气体排放量的增加, 而在本研究中所得到的结果与其不同, 表现为磷营养盐的添加反而引起了N2O排放量的降低。究其原因, 磷添加对于N2O交换过程的影响仍存在许多不确定性。N2O的产生首要受到水体中氮循环的限制[45], 但有关氮素循环中产生N2O的过程受到的影响因素十分复杂, 其中与本研究相关的主要讨论磷添加对于湖泊水体N2O产生速率和排放量的结果仍有待进一步补充。而现有的陆地生态系统中磷元素添加对N2O排放影响的研究结果表明, 磷驱动N2O排放减少的主要机制是由于磷的高有效性使植物增强了对土壤中氮的吸收, 降低了硝化细菌和反硝化细菌反应过程中氮的有效性,从而抑制了N2O的排放[46]。此外, Zheng等[47]的研究发现在热带森林中长期增加磷元素可能会使N2O的排放减少。尽管水域环境与陆地之间存在极大的差异性, 但仍可提供一定的参照, 依据现有的研究推测可能是由于磷营养盐的增加对水生植物与浮游植物生长有促进作用, 初级生产者的大量生长会进一步增强对氮的利用, 导致水体中氮营养元素水平降低, 从而降低了控制系统内水-气界面间N2O的交换量。
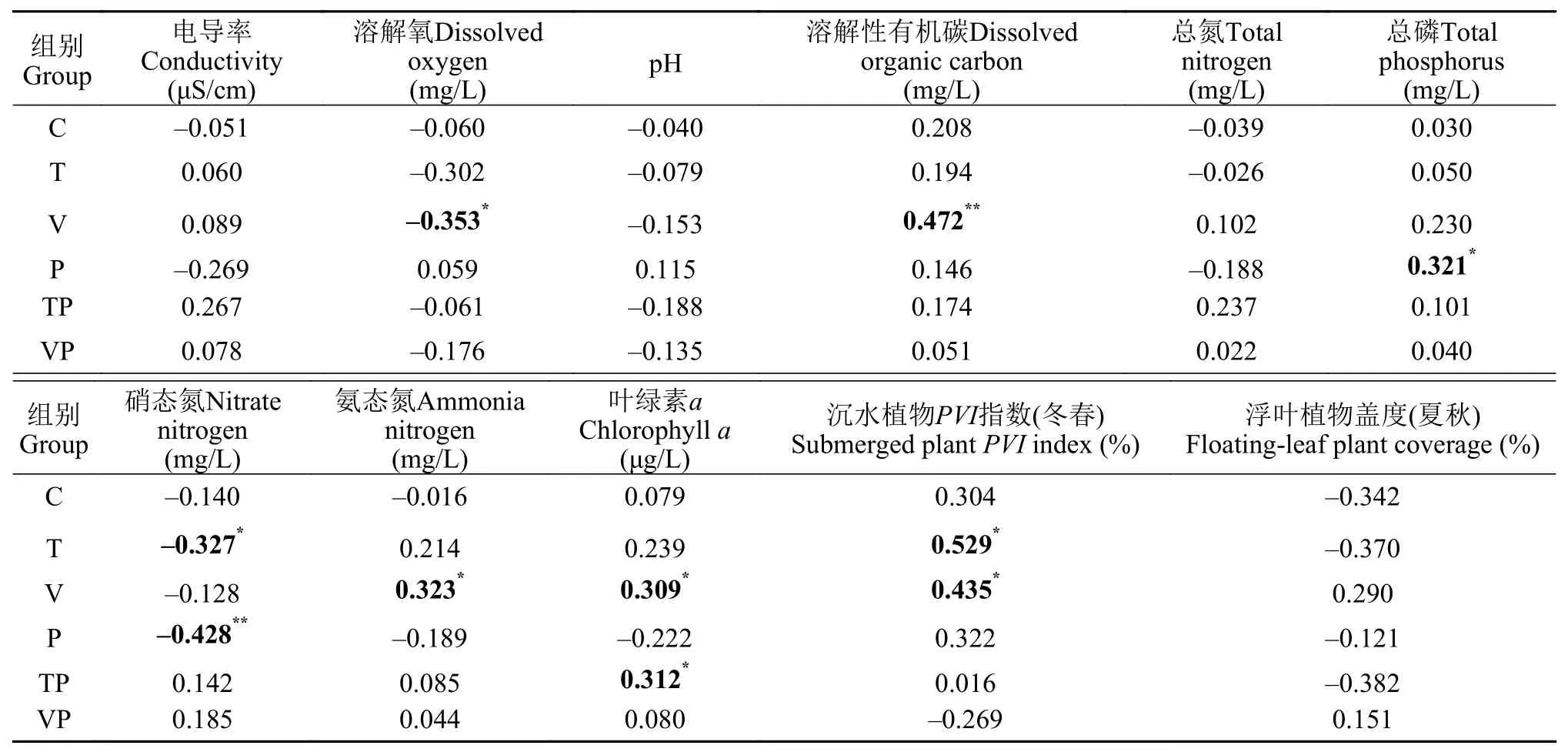
表 3 整个实验期间不同处理组的N2O交换通量与环境因子的Spearman相关性分析Tab. 3 Spearman correlation analysis of N2O fluxes and environmental factors during the whole experiment period
3.3 升温与磷添加交互作用对水-气界面N2O交换的影响
统计检验的结果表明, 升温与磷添加显著促进了整个实验期间电导率、pH、DOC和TN含量的升高, 而显著抑制了浮叶植物的生长。本研究结果表明, N2O生成与消耗的过程与溶解氧、有机物含量、pH、温度和无机氮可利用性等多重环境因素的调节密切相关[48]。本研究中控制系统水-气界面N2O交换通量与升温与磷添加交互作用下的DO、和沉水植物PVI指数(冬春)等环境因子具有显著的相关性。不同的环境因子在控制系统内受到升温与磷添加的交互作用而表征出十分显著的变化。同时, 环境因子对于温度和磷营养盐的迅速响应将进一步改变湖泊水体N2O的交换过程。
Kortelainen等[9]在芬兰87个湖泊中发现N2O含量在pH为6.5左右时最高, 这反映了水体中N2O累积的适宜pH。且有研究表明N2O还原酶更适宜在较高的pH环境中生存[49], 因此在偏碱性的水体中可能更易于消耗掉N2O。在本研究中, 升温与磷添加交互作用的影响下绝大多数时间水体pH表现为中偏碱性状态, 水体并未处于N2O生成过程中最适宜的pH范围之内, 这很可能导致水体中N2O的生成过程受到抑制。
DO是平衡水体中硝化和反硝化反应的重要环境因子, 影响水体中N2O的产生过程[50], 有研究表明湖泊生态系统中的N2O排放通量与水深和DO浓度具有显著的相关关系, 在水深较浅的区域, DO浓度相对较高, 因而湖滨带的N2O排放量通常最高[51]。此外, 对氧气需求相反的硝化细菌与反硝化细菌在整个氮素循环中均起到重要作用, 因而N2O产生速率与DO的关系相对复杂[52], 在本研究中N2O交换通量与DO显著负相关, 控制系统内冬、春季的DO浓度高于夏、秋季, 较高的DO浓度能够抑制水体中的反硝化作用[12]。因此, 在本研究期间, 控制系统内冬、春季水-气界面间N2O主要吸收趋势为主, 而在夏、秋季则表现出渐强的N2O排放趋势。
控制系统内N2O交换通量与TN含量的相关性并不显著, 而与TP、显著正相关, 与N显著负相关。这可能是由于水体中TP含量高的富营养化浅水湖泊会导致有关反硝化细菌代谢需求的N和P比例发生变化, 进而影响反硝化过程和N2O的生成[13], 由此可能改变水体的营养状态, 减弱湖泊应对气候变化的前哨作用[53]。我们的研究结果显示, 升温能够显著提升水体中的含量并且促进水-气界面间N2O的交换, 而添加磷营养盐则表现出对水体中含量和N2O交换通量显著的抑制作用。以上表明无机氮是N2O生成过程中重要的环境因子, 但在气候变化的趋势下对富营养化湖泊生态系统水-气界面间N2O交换的响应机制发生了变化。
水体DOC含量能够反映有机质的动态积累过程[54], 本实验期间观察到夏季水体中DOC的含量显著高于其他季节, 同时Chl.a的含量亦显著增加, 表明随季节交替控制系统内有机质逐渐积累并且浮游植物的密度逐步升高。初级生产者本身即是有机质的载体, 同时也会显著影响控制系统内的生物地球化学循环。Forshay和Dodson[55]发现在水生植物的生长过程中沉水植被丰富的沉积物比无沉水植被的沉积物具有更高的反硝化速率, 其原因是有沉水植物的沉积物在反硝化过程中不会受到碳的限制。在本研究中, 控制系统内沉水植物同样对沉积物-水界面间N2O的生成产生显著促进作用。水生植物衰亡后产生的大量凋落物也能为硝化细菌提供充足的碳源和丰富的底物, 亦有利于N2O的生成和排放[56]。控制系统内沉水植物与浮叶植物随季节的交替, 整个生命周期内有机质不断积累。因此, N2O交换通量与DOC呈显著正相关关系表明有机质积累促进了沉积物界面N2O的生成。
4 结论
(1)升温显著促进了水-气界面间N2O的排放,表现出与代谢理论的一致性, 而不同的升温模式间N2O的交换过程无明显差异。(2)磷的添加对水-气界面间N2O的排放过程表现出明显的抑制作用, 其原因可能是磷的添加促进了初级生产者的生长, 提高了水体环境中氮的利用。N2O的年累积交换量进一步表明, 磷的添加改变了湖泊生态系统水-气界面间N2O的源汇转换动态。(3)升温与磷营养盐交互作用下环境因子与N2O交换通量有着显著的相关关系, 控制系统内和沉水植物PVI指数(冬春)表现为显著正相关, DO、表现为显著负相关。(4)水-气界面间N2O的通量与无机氮含量显著相关, 而升温与磷添加的交互作用下N2O均表现出相同的变化趋势,较高的TP含量可能影响反硝化代谢过程中更为适宜的N和P比例, 导致水体的营养状态发生改变, 进而削弱水-气界面N2O的排放。(5)初级生产者是有机质的主要载体, 升温及与磷营养盐添加的交互作用显著促进初级生产者的生长。实验期间随着季节的交替, 有机质逐渐积累, 水-气界面间N2O的排放也显著强烈。
