日粮中添加桑叶提取物和1-脱氧野尻霉素对大鲵生长、消化、免疫能力和肠道菌群的影响
2021-06-02冯麒凤李战福黄先智翟旭亮林仕梅陈拥军
冯麒凤 李战福 黄先智 李 虹 翟旭亮 薛 洋 林仕梅 陈拥军 罗 莉
(1. 西南大学水产学院, 淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715; 2. 家蚕基因组生物学国家重点实验室,重庆 400715; 3. 重庆市水产技术推广总站, 重庆 401121)
大鲵(Andrias davidianus), 俗称“娃娃鱼”, 属两栖纲(Amphibia)、有尾目(Caudata)、隐鳃鲵科(Cryptobrachidae)。因其肉质鲜嫩, 营养丰富, 且具有极高的药用价值[1], 被誉为“水中人参”, 是我国农业产业化和特色农业重点开发的品种。目前大鲵的人工养殖以饲喂活饵及冰鲜鱼虾为主, 配合饲料使用还不普遍。大鲵在养殖过程中易患胃肠相关疾病, 长期投喂冰鲜鱼虾时疾病问题尤为突出。因此迫切需要绿色和高效的添加剂来增强配合饲料的功效, 以改善其胃和肠功能, 提高其生长性能, 优化肠道微生态环境, 同时增强其免疫能力和抗应激能力, 减少疾病的发生。
桑叶物提取物(Mulberry leaf extract, MLE)是桑叶经水浸提后干燥而得, 富含生物碱、黄酮类和多糖等多种生物活性成分。1-脱氧野尻霉素(1-deoxynojirimycin, DNJ)是MLE中主要活性物质之一, 是一种多羟基哌啶生物碱。目前关于DNJ的研究多集中在药理活性方面, 而关于DNJ作为饲料添加剂在水生动物上的研究未见报道。研究表明,MLE和DNJ均具有降糖降脂、抗菌抗氧化和抑制癌细胞生长等作用[2—6]。研究表明, 在蛋鸡[7]、矮脚黄鸡[8]和AA肉鸡[9]的日粮中添加桑叶提取物或桑枝提取物, 可以提高养殖动物的采食量和生长性能, 在饲料中添加桑叶黄酮[10,11]和桑叶多糖[12,13]可提高养殖动物生长性能和机体抗氧化性能及肠道菌群多样性, 添加DNJ可以改善小鼠肠道内环境,调节肠道菌群[14,15]。本课题组先前的研究发现, 添加适宜的MLE可提高中国大鲵的生长性能、抗氧化能力、消化吸收功能和免疫功能[16]。至于MLE与DNJ作为饲料添加剂对养殖动物胃、肠结构和功能有无不同影响的研究尚未见相关报道。
基于此, 本实验以中国大鲵为研究对象, 比较研究MLE和DNJ对大鲵生长、消化、免疫功能及肠道菌群的影响, 评价二者作用效果的异同, 并初步揭示其作用机制, 为科学应用该绿色饲料添加剂,生产优质、高效和安全的大鲵配合饲料提供重要依据。
1 材料与方法
1.1 实验饲料
饲料原料均购于重庆市大发饲料有限公司, MLE由家蚕基因组生物学国家重点实验室提供, DNJ(HPLC≥98%)购于北京世纪奥科生物技术有限公司。
以大鲵基础饲料为对照组, 分别添加0.75%的MLE和0.04‰的DNJ为MLE组和DNJ组, 用膨润土调平, 配制3种等氮等脂的实验饲料, 实验饲料配方及主要营养水平见表 1。其中, MLE和DNJ的添加剂量设置依据为根据前期大鲵配合饲料中MLE添加量的研究, 设置本实验MLE添加量为0.75%, 同时根据本批次桑叶提取物中DNJ的含量, 换算该MLE添加量下饲料中DNJ添加量为0.04‰。饲料原料过60目筛, 混合制粒机制成直径3 mm的硬颗粒饲料, 风干后–20℃保存。
1.2 实验鲵饲养与管理
实验大鲵购于陕西省汉中市绿源大鲵养殖场,大鲵饥饿5d后以对照组饲料驯养15d。选择72尾规格均匀、体质健壮的大鲵[初始体质量(47.81±0.23) g],随机置于9个70 cm×45 cm×17.5 cm的塑料方形箱中, 每箱8尾大鲵, 分为3组, 每组3个重复。
每天17:00饱食投喂, 投喂2d停食1d。水深3—5 cm, 每天早晚用曝气自来水100%换水, 正式实验90d。饲养期间避光, 水温19—23℃, 溶解氧>6.0 mg/L, 氨氮含量<0.10 mg/L, 亚硝酸盐含量<0.10 mg/L, pH 6.5—7.0。
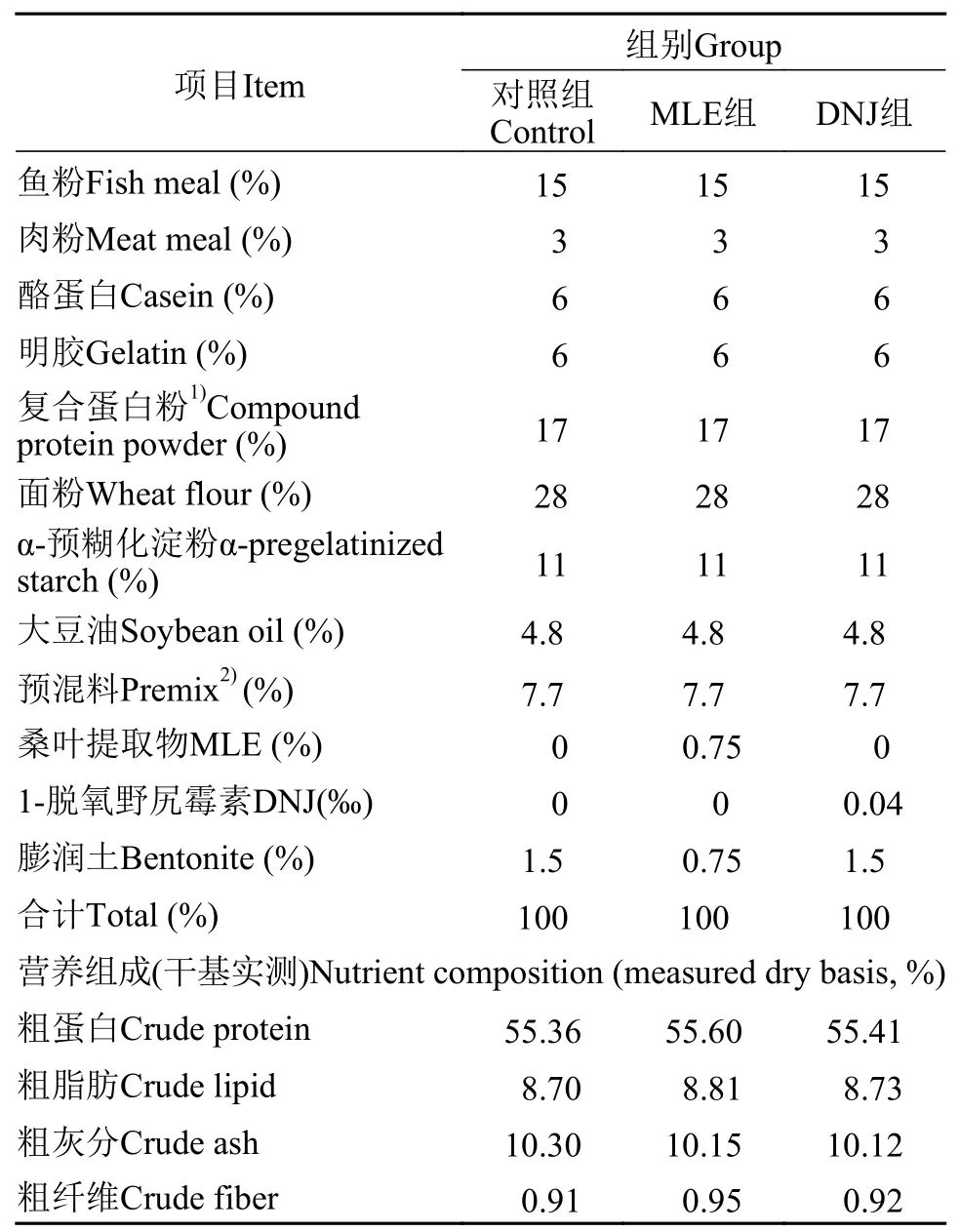
表 1 实验饲料配方及主要营养成分(风干基础)Tab. 1 Formulation and nutrient composition of diets (air-dry basis)
1.3 样品采集
因大鲵消化食物时间较长, 在养殖结束后, 停食72h。MS-222麻醉, 分别计数、称重。每个重复取3尾大鲵, 冰盘中解剖, 分离胃和肠道, 取前肠分别于多聚甲醛和戊二醛固定液中固定, 用于石蜡切片和扫描电镜的制备; 胃及其余肠道组织液氮速冻后–80℃中保存。另外, 每重复取3尾实验鲵, MS-222麻醉后于无菌操作台上分离肠道并收集肠道内容物, 液氮速冻后–80℃保存, 用于肠道微生物多样性分析; 取前肠于1.5 mL无酶管后液氮速冻, –80℃保存, 用于肠道免疫相关基因表达量测定。
1.4 生长指标测定
生长指标测定: 采用以下公式计算生长性能和生物学性状: 摄食量(Feed intake,FI, g)=∑F0–∑Fr; 增重率(Weight gain rate,WGR, %)=(Wt–W0)/W0×100;平均日增重(ADG, g/d)=(Wt–W0)/t; 饲料效率(Feed Efficiency,FE, %)=(Wt–W0)/F×100。式中,W0为起始鲵尾均重(g);Wt为终末鲵尾均重(g);F0为每次投喂量(g);Fr为每次残饵量(g);F为尾均摄食量(g);t为饲喂天数。
1.5 肠道组织结构与消化酶指标测定
前肠石蜡组织切片制样: 多聚甲醛固定后, 乙醇脱水, 置于二甲苯中透明, 用低熔点的石蜡包埋成蜡块, 用Leica UC7 RT切片机连续切片, 厚度为4 μm, 展片后HE染色, 中性树胶封片。
前肠扫描电镜制样: 经戊二醛固定后, 蒸馏水漂洗样品, 乙醇脱水, 环氧丙烷处理2次, 临界点干燥, EIKO离子溅射仪镀膜, 处理好的样品在JSM-6380LV型扫描电镜中观察并拍照。
消化酶指标的测定: 胃蛋白酶、胰蛋白酶、脂肪酶、H+-K+-ATP酶和Na+-K+-ATP酶活力采用南京建成生物工程研究所生产的试剂盒测定, 碳酸酐酶(CA)采用上海优选Elisa试剂盒测定。
肠黏膜屏障指标测定: 内毒素和D-乳酸指标采用上海优选Elisa试剂盒测定。
1.6 肠道抗氧化指标测定
肠道总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活力和丙二醛(MDA)采用南京建成生物工程研究所生产的试剂盒测定。
1.7 Illumina-HiSeq宏基因组测序
采用DNA提取试剂盒(TaKaRa)提取肠道细菌总DNA后进行16S rDNA(V3+V4)区扩增特异区域,细菌16S rDNA(V3+V4)区域引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增好的DNA序列, 经1.8%琼脂糖(TaKaRa, 100 bp)电泳检测阳性后, 委托百迈客生物科技有限公司用Illumina HiSeq高通量测序技术进行序列测定和分析。
1.8 总RNA的提取与免疫相关基因表达量测定
按照RNAiso Plus试剂盒(TaKaRa)的方法提取肝脏组织总RNA, 用1.2%琼脂糖凝胶Agarose Regular (TaKaRa) 电泳检测RNA完整性, 并用核酸测定仪(Thermo Fisher)测定RNA的纯度和浓度。采用Premix ScriptTMRT Master Mix反转录试剂盒(TaKaRa)得到cDNA, 于–20℃保存备用。根据本课题组大鲵肠道转录组测序(RNA Seq)结果, 设计特异性引物(表 2), 委托生工生物工程(上海)股份有限公司合成。用ABI7500 型荧光定量PCR仪(Applied Biosystems,美国)进行RT-PCR。反应体系: 总体积20 μL, 2 μL cDNA模板, 10 μL SYBR Premix ExTaqTM(TaKaRa),上、下游引物各0.5 μL, 7 μL ddH2O。RT-PCR反应条件: 95℃预变性60s, 95℃变性5s, 60℃退火30s, 共40个循环, 每个样品3个重复, 以EF l-α作为内参, 分别测定肠道组织IL-8、IL-10、TOR、pIgR、TLR2、MyD88和IRAK4相对表达量, 结果以2–ΔΔCt表示。
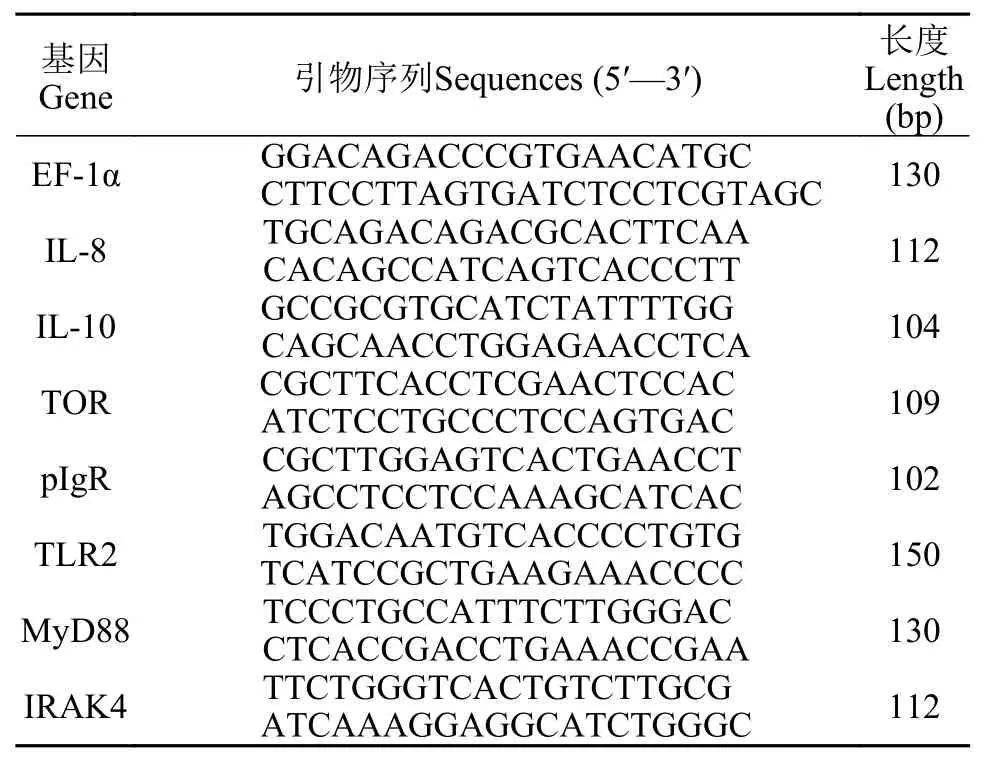
表 2 免疫相关基因及内参基因引物序列Tab. 2 Primers used for quantitative real-time PCR
1.9 数据处理
采用SPSS 22.0进行方差齐性检验和单因素方差分析(One-way ANOVA)。用Duncan氏多重比较分析组间差异显著性程度, 显著水平为(P<0.05)。数据用平均值±标准差(Mean±SD)形式表示。
2 结果
2.1 生长性能及饲料利用指标
由表 3可知, MLE和DNJ组的FBW、WGR、ADG及FE均显著高于对照组(P<0.05), 而MLE和DNJ组间无显著差异(P>0.05)。其中, MLE和DNJ组的WGR分别较对照组提高了39%和46%,FE提高了20%和27%。此外, MLE组的FI显著高于对照组(P>0.05)。
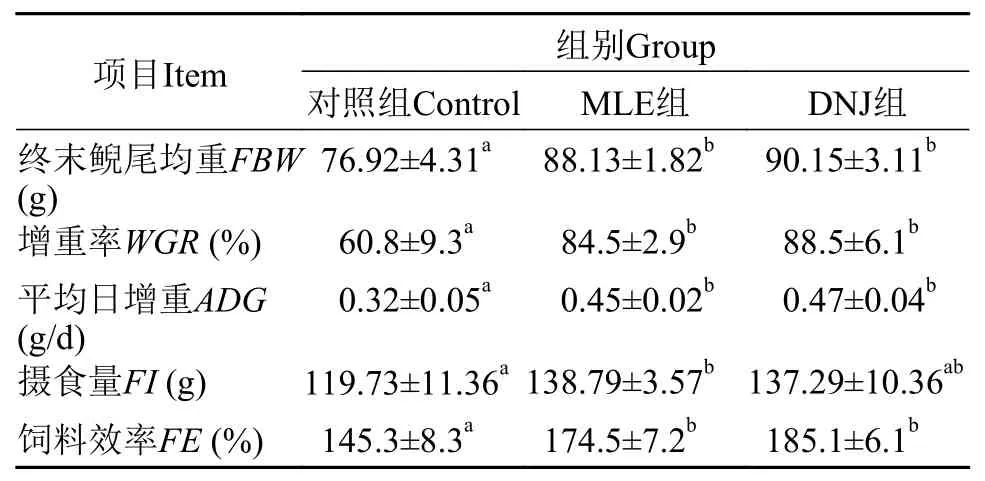
表 3 MLE和DNJ对大鲵生长性能及饲料效率的影响Tab. 3 Effects of MLE and DNJ on growth performance and feed utilization of Andrias davidianus
2.2 胃的消化、泌酸能力指标
由表 4可知, MLE组和DNJ组CA酶活性均显著高于对照组(P<0.05), 而MLE组与DNJ组差异不显著(P>0.05)。MLE组胃蛋白酶和H+-K+-ATP酶活性均显著高于对照组和DNJ组(P<0.05), 而DNJ组与对照组差异不显著(P>0.05), MLE组胃蛋白酶和H+-K+-ATP酶活性分别较DNJ组提高了45%和9%。
2.3 肠道消化、吸收能力指标
由表 5可知, 与对照组相比, MLE组和DNJ组胰蛋白酶和脂肪酶活力均显著提高(P<0.05), 淀粉酶活力显著降低(P<0.05)。其中, MLE组和DNJ组胰蛋白酶活力较对照组分别升高了69%和59%, 脂肪酶较对照组分别升高了16%和13%。MLE组胰蛋白酶和Na+-K+-ATP酶活力均显著高于DNJ组(P<0.05), 其中, Na+-K+-ATP酶活性较DNJ组提高了14%。MLE组和DNJ组的脂肪酶和淀粉酶活力无显著性差异(P>0.05)。
2.4 肠黏膜通透性指标
由表 6可知, 与对照组相比, MLE和DNJ组血浆内毒素含量显著降低, 其中, MLE组显著低于DNJ组(P<0.05)。MLE组D-乳酸含量显著低于对照组(P<0.05)。DNJ组D-乳酸含量与对照组差异不显著(P>0.05)。
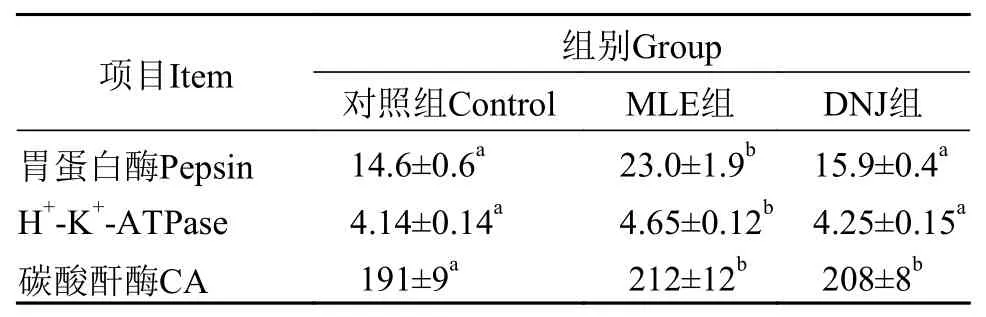
表 4 MLE和DNJ对大鲵胃功能的影响Tab. 4 Effects of MLE and DNJ on gastric function of Andrias davidianus (U/mg)
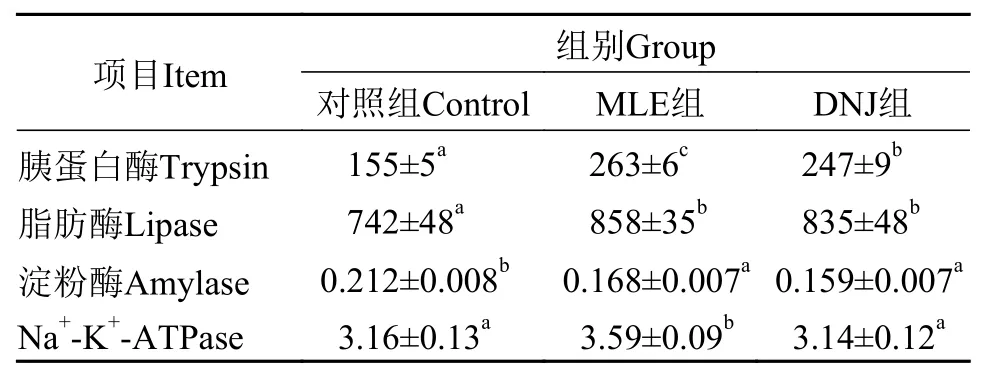
表 5 MLE和DNJ对大鲵肠道消化吸收功能的影响Tab. 5 Effects of MLE and DNJ on intestinal digestion and absorption function of Andrias davidianus (U/mg)

表 6 MLE和DNJ对大鲵肠黏膜通透性影响的比较Tab. 6 Effects of MLE and DNJ on intestinal permeability of Andrias davidianus
2.5 肠道形态结构及肠黏膜上皮细胞紧密连接结构观察
由图 1和表 7可知, 与对照组相比, MLE组和DNJ组肠道绒毛数量分别增加了16%和12%(P<0.05)。MLE组绒毛高度显著高于对照组和DNJ组(P<0.05)。MLE组和DNJ组的肠道空腔率分别较对照组降低27%和12%(P<0.05), MLE组空腔率显著低于DNJ组。
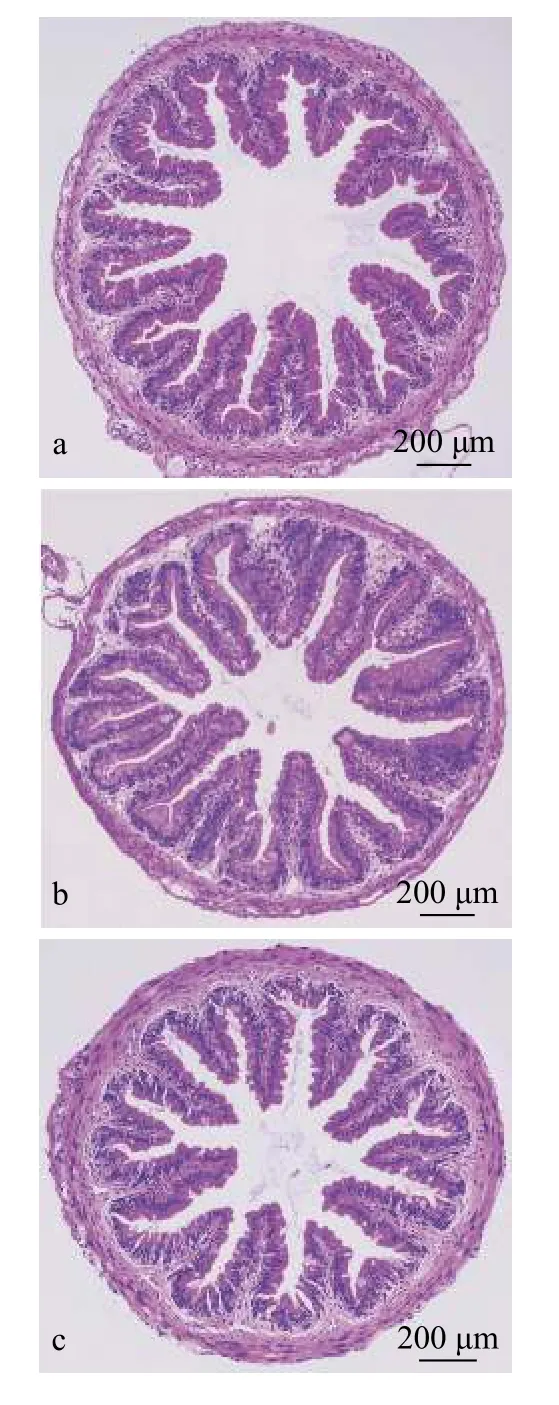
图 1 MLE与DNJ对大鲵前肠形态结构的影响(HE染色,40×)Fig. 1 Effects of MLE and DNJ on intestinal morphology and structure of Andrias davidianus
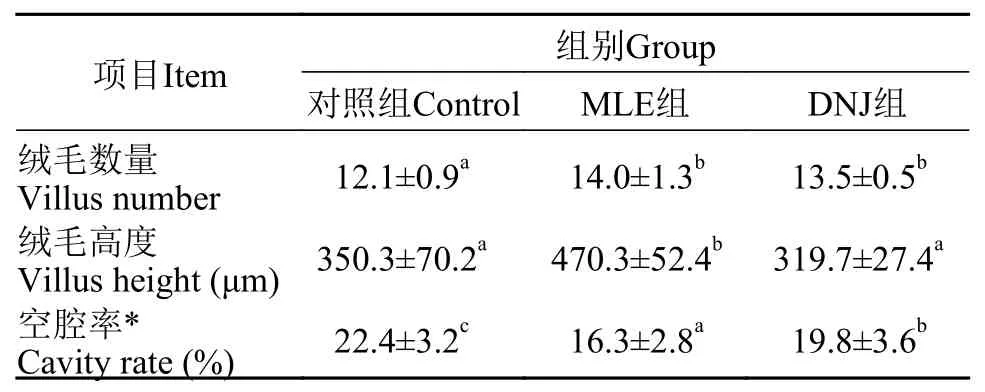
表 7 MLE与DNJ对大鲵肠道形态结构的影响Tab. 7 Effects of MLE and DNJ on intestinal morphology and structure of Andrias davidianus
通过图 2扫描电镜结果的观察, MLE组和DNJ组上皮细胞间紧密程度高于对照组, 且相比之下,MLE组上皮细胞间的连接更加紧密。
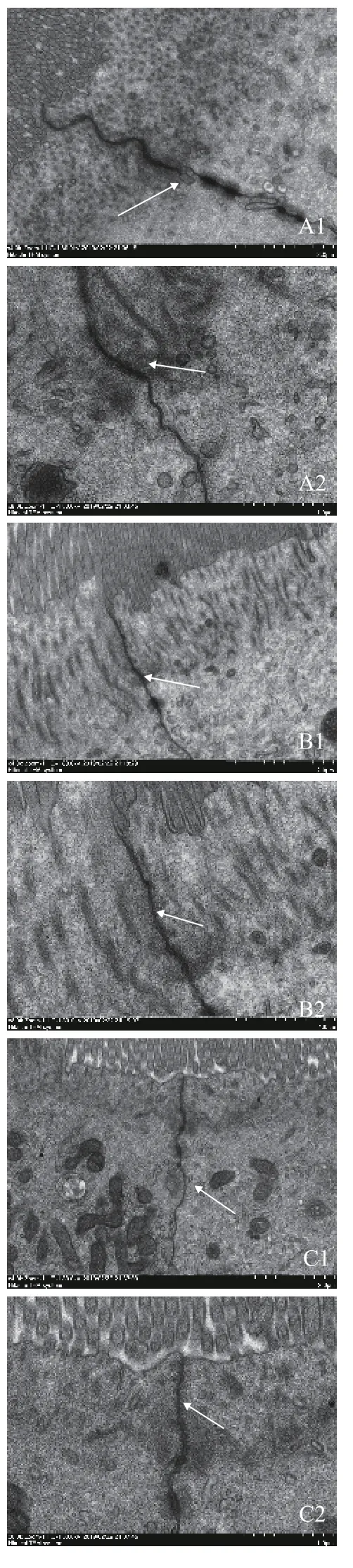
图 2 MLE与DNJ对大鲵肠黏膜细胞紧密连接结构的影响Fig. 2 Effects of MLE and DNJ on tight junctions in intestinal mucosa of Andrias davidianus
2.6 肠道抗氧化能力指标
由表 8可知, MLE组肠道总抗氧化能力(T-AOC)显著高于对照组和DNJ组(P<0.05)。MLE组和DNJ组肠道MDA含量显著低于对照组(P<0.05), 分别较对照组降低了28%和16%, MLE组和DNJ组的T-AOC和MDA含量无显著差异(P>0.05)。
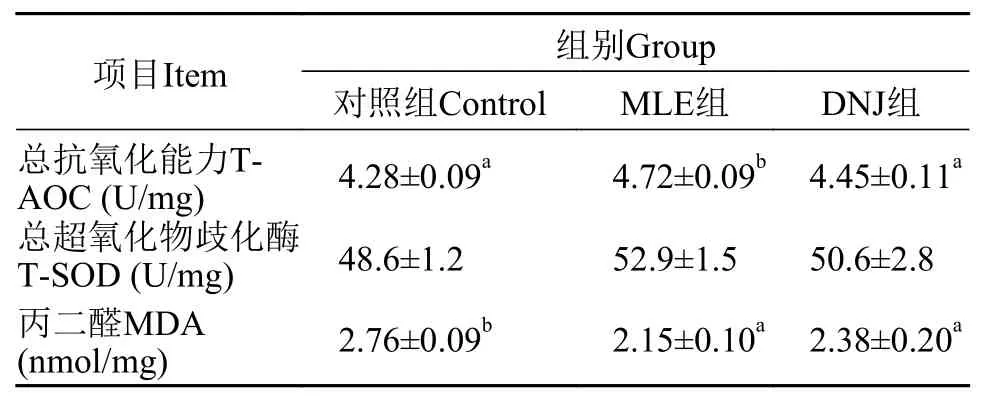
表 8 MLE与DNJ对大鲵肠道抗氧化能力的影响Tab. 8 Effects of MLE and DNJ on intestinal antioxidant of Andrias davidianus
2.7 肠道免疫基因相对表达量
由图 3可知, MLE和DNJ的添加对大鲵肠道免疫相关基因表达量有不同程度的影响。相较对照组, MLE组TOR、IL-10、pIgR、TLR2、MyD88和IRAK4表达量显著提高(P<0.05), DNJ组pIgR和MyD88表达量显著提高(P<0.05)。
MLE组TOR、IL-10和pIgR表达量较DNJ组显著提高(P<0.05), 其他基因表达量与DNJ组无显著差异(P>0.05)。
2.8 肠道菌群结构分析
运用usearch进行聚类划分共获得255个OTUs(图 4a), 其中有180个OTUs是3个组共有的, 占三者的70.59%; MLE与DNJ共有OTUs占两者总数的93%, CTR与MLE、DNJ共有OTUs分别占两者总数的73%和75%。通过图 4b发现, MLE组与DNJ组聚为一枝, 而CTR组独立一枝。在门和属水平上进行物种丰度分析, 共有14个门163个属的细菌被发现,3个处理组的最具优势菌门均为厚壁菌门(Firmicutes), MLE和DNJ组厚壁菌门丰度较对照组下降,MLE组变形菌门(Proteobacteria)丰度高于CTR及DNJ组(图 4c)。在属水平上, MLE组和DNJ组均以Romboutsia为优势菌属, 而对照组以Runimococcaceae为优势菌属(图 4d)。
测试结果覆盖率均在99.9%以上, MLE组和DNJ组Chao1和Ace指数要比CTR组高, MLE组的香农指数最高, 辛普森指数最低(表 9)。
3 讨论
3.1 MLE和DNJ对大鲵生长性能影响的比较
本实验结果显示, 添加MLE和DNJ均提高了大鲵的生长性能和饲料效率。宋琼莉等[8]在矮脚黄鸡饲料中分别添加0.2%、0.5%和0.8%的MLE, 发现实验组的日增重和平均日采食量均比对照组显著增高; 范京辉等[9]在AA肉鸡上添加0.3%的MLE, 肉鸡生长速度和日粮表观消化率均提高[17]; 李婉涛等[18]在日粮中添加0.3%的杜仲和MLE, 发现育肥猪的平均日增重和饲料报酬显著提高; 此外, 本课题组先前的研究已经证明添加适宜含量的MLE可以提高大鲵的生长性能以及饲料利用率[16], 与本研究结果相似。而关于DNJ对动物生长性能影响的研究未见报道。桑叶提取物富含多种天然活性成分, 其中,桑叶黄酮[19]和多糖[12]等已被证明可以提高养殖动物生长性能, 这些单体活性成分可能在大鲵体内发挥了协同效应共同起到了促生长作用。另外, MLE组和DNJ组大鲵摄食量提高是其生长性能提高的可能原因之一, 关于MLE提高养殖动物摄食量在大鲵[16]和矮脚黄鸡[8]等的研究中得到了证实。
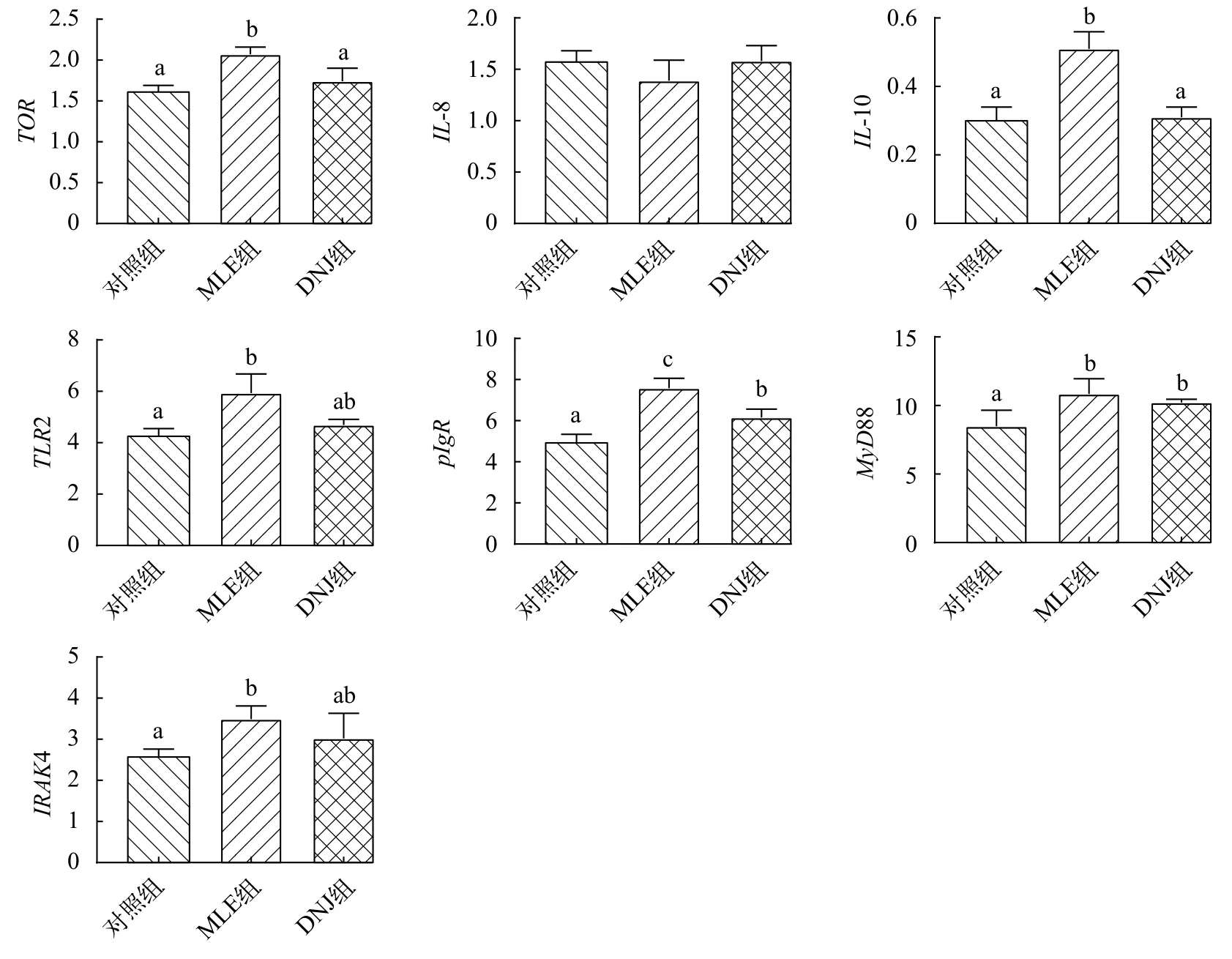
图 3 MLE和DNJ对大鲵肠道免疫相关基因相对表达量的影响Fig. 3 Effects of MLE and DNJ on intestinal immune related gene expression of Andrias davidianus
3.2 MLE和DNJ对大鲵胃和肠道消化、吸收能力影响的比较
动物获取营养物质主要是通过胃、肠的消化与吸收作用实现的。在胃酸和胃蛋白酶的作用下,实现对饲料蛋白的初步消化。盐酸的分泌是在H+-K+-ATP酶(又称为胃质子泵或酸泵)和碳酸酐酶(CA)的共同作用下完成的, 这2种酶是反映胃泌酸能力的指标[20,21]。关于MLE和DNJ对胃消化酶的影响尚未见报道。在本研究中, 添加MLE提高了胃CA酶、蛋白酶和H+-K+-ATP酶活力, 添加DNJ提高了胃CA酶活力。可见添加MLE可以提高大鲵胃的消化及泌酸能力, 而添加DNJ仅对胃的泌酸能力有所改善, 这可能是桑叶提取物中除了DNJ之外, 有其他活性成分在提高胃的消化及泌酸能力方面了发挥作用。杨春涛[22]的研究表明, 桑叶黄酮可以提高瘤胃a-淀粉酶以及皱胃蛋白酶活性从而提高犊牛对营养物质的消化能力; 彭思博等[23]发现饲料中添加60—120 mg/kg的γ-氨基丁酸, 乌鳢(Ophicephalus argus)肠道胰蛋白酶和脂肪酶活性显著提高。
肠道是营养物质消化和吸收的主要场所。在肠道内, 食物在胰蛋白酶和脂肪酶等的作用下消化分解为小分子物质, 通过肠绒毛内的乳糜管和毛细血管吸收入血, 为机体提供营养。肠道消化吸收酶活力、绒毛高度和数量的提高及空腔率的降低反映肠道消化、吸收能力的提高。王永昌[24]和王咏梅等[10]的研究表明, 桑叶粉和桑叶黄酮可以改善肠道结构, 提高消化吸收能力。在本研究中, 饲料中添加MLE和DNJ均能促进大鲵肠道发育, 改善肠道的形态结构, 提高肠道蛋白酶和脂肪酶活力, 同时降低了肠道淀粉酶活力。大鲵作为肉食性水产动物, 对淀粉的利用率较低。对于肉食性动物来说,提高机体对饲料蛋白和脂肪的消化吸收, 降低对淀粉的利用是有利的。MLE和DNJ对肠道淀粉酶活力有抑制作用, 这可能与桑叶中的生物碱抑制机体对二糖类分解酶活性密切相关[25], 相似的结果在Nuraniye等[26]的研究中也有发现。
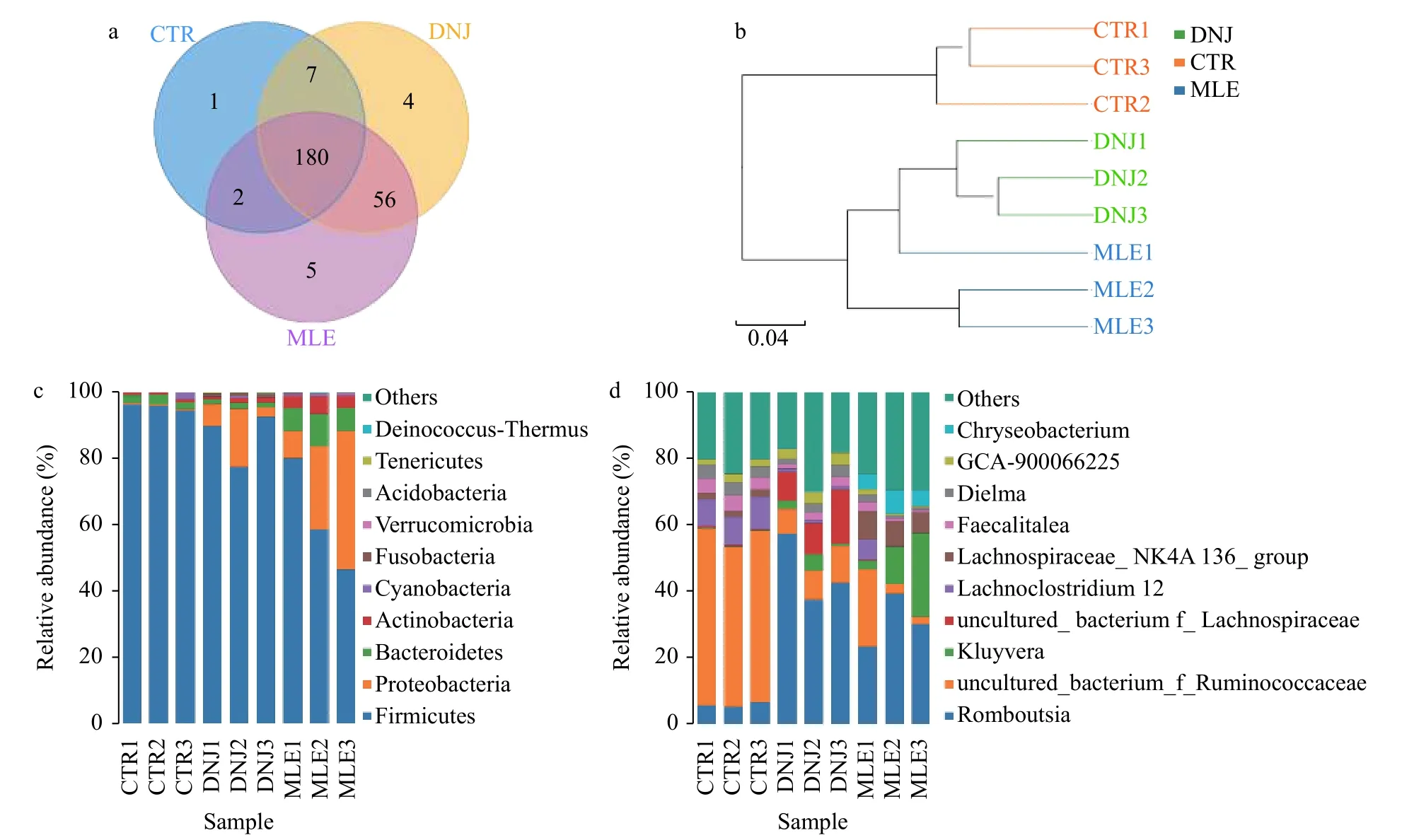
图 4 MLE和DNJ对大鲵肠道菌群的结构分析Fig. 4 Effects of MLE and DNJ on intestinal flora structure of Andrias davidianus
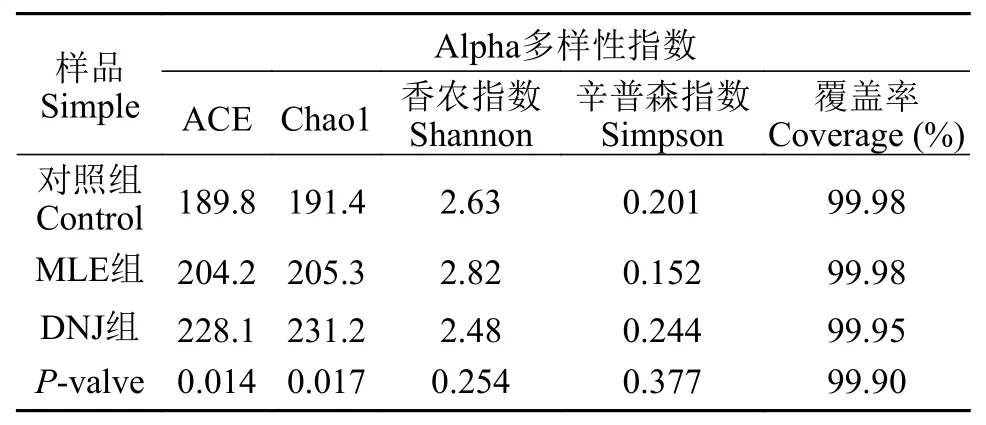
表 9 肠道菌群Alpha多样性指数Tab. 9 Alpha diversity indices of samples
3.3 MLE和DNJ对大鲵肠黏膜屏障功能影响的比较
肠道是机体抵御病原体入侵的第一道屏障, 其结构和功能完整性是维持养殖动物肠道健康的基础。肠道上皮细胞紧密连接及细胞膜结构是维持肠道通透性的物质基础, 保证营养物质的正常运转,同时阻止有害物质进入[27]。肠道上皮细胞结构受损会破坏肠黏膜屏障功能, 致使肠道通透性增加,使得内毒素等有害物质透过上皮细胞, 随血液循环至全身各处, 危害养殖动物健康。D-乳酸是胃肠道细菌的代谢产物; 内毒素是革兰氏阴性菌细胞壁成分, 正常情况下由于肠黏膜屏障功能完整难以进入血液循环[28]。当屏障功能受损时, 细胞内的D乳酸会释放出来, LPS穿过肠黏膜, 进入血液循环系统,从而对机体产生毒害作用。因此, 血浆中的DAO活力及内毒素、D-乳酸含量可反映肠道损伤状态。有研究表明, 在NASH小鼠日粮中添加DNJ可以上调肠道ZO-1的表达水平, 增强肠黏膜屏障功能[15],与本研究结果相似。在本研究中, 添加MLE和DNJ均降低了血液中内毒素和D-乳酸, 但二者差异较大, MLE降低幅度较大, DNJ降低幅度较小。有研究表明, 植物多糖[29]和黄酮[29]等活性物质可以增加细胞间紧密连接蛋白的表达, 有利于调节肠黏膜屏障通透性、保持上皮结构完整和修复受损的肠黏膜屏障。MLE中的多糖和黄酮类物质可能与DNJ发挥了协同作用增强了大鲵的肠黏膜屏障功能。
3.4 MLE和DNJ对大鲵肠道抗氧化能力影响的比较
抗氧化能力的强弱是衡量机体健康程度重要指标。肠道与外源物质直接接触, 因此极易产生各种氧化应激反应, 影响肠道的正常生理功能。TAOC和MDA是反映机体抗氧化综合能力的指标。MDA是体内脂质过氧化反应的终产物, 其含量的高低反映了体内脂质过氧化程度。MLE和DNJ的抗氧化作用在其他研究中得到证实, 如桑叶水提物可以降低糖尿病大鼠血清中MDA含量[30], DNJ可以提高胃溃疡小鼠胃的抗氧化能力, 具体表现为抗氧化酶活性提高, MDA含量降低[31]。本研究得到了与前人相似的结果, 在大鲵饲料中添加MLE和DNJ均可提高肠道总抗氧化能力, 降低丙二醛含量,但二者差异较大, MLE对肠道抗氧化能力的增强效果优于DNJ。除DNJ外, 桑叶提取物中所含的桑叶多酚[32]、黄酮[33]和多糖[34]等物质也具有较好的抗氧化作用, 这些活性成分与DNJ一同发挥了抗氧化作用, 这可能是本研究中MLE组肠道抗氧化能力强于DNJ组的主要原因。
3.5 MLE和DNJ对大鲵肠道免疫相关基因影响的比较
肠道不仅是主要的消化吸收与抗氧化器官, 也是机体重要的免疫器官。IL-8和IL-10由活化的免疫细胞产生, IL-8是重要的促炎细胞因子, IL-10是抗炎因子, 在控制和消除炎症中起重要作用[35,36]。多聚免疫球蛋白受体(pIgR)参与多聚免疫球蛋白(pIg)的转运, 与免疫球蛋白的形成有关。TLRs识别病原体表面的脂多糖、酵母多糖、肽聚糖和脂蛋白等PAMP, 通过MAL与接头蛋白MyD88结合,并向下游传递信号, 募集IRAK家族成员, 引起一系列级联反应, 调控炎症因子的转录。DNJ及其他桑叶活性成分如桑叶黄酮等的免疫作用在其他研究中得到证实, 例如, DNJ降低了糖尿病小鼠肝脏组织中TNF-α, IL-1β和IL-6的水平[31,37]。在本实验中,添加MLE和DNJ均可以提高大鲵肠道免疫能力,MLE不同程度上调了IL-10、pIgR、TLR2、MyD88和IRAK4的表达, 可能是通过TLR2→MyD88→IRAK4信号通路途径激活机体免疫系统, 提高抗炎因子IL-10和多聚免疫球蛋白受体的表达, 改善大鲵肠道免疫功能, 而DNJ的提高效果不及MLE, 这可能是MLE中所含的桑叶多糖增强了大鲵的免疫功能。有研究表明, 桑叶多糖能增强长期大负荷运动小鼠机体免疫功能, 调节免疫细胞及免疫分子,其中桑叶多糖中、高剂量的效果尤为明显[38]。
3.6 MLE和DNJ对大鲵肠道菌群结构影响的比较
肠道微生物群作为一种新的功能器官和营养靶点, 参与人体多种代谢, 其重要性受到越来越多的关注[39]。通过Chao1指数、ACE指数和Shannon指数等Alpha多样性指标反映了肠道微生物的丰富度和均匀度。本研究显示, 在饲料中添加MLE和DNJ对肠道菌群有影响, 可以提高肠道菌群的丰富性和多样性, MLE组和DNJ组肠道菌群结构也更加接近; 在门水平上, 厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinbacteria)为大鲵肠道优势菌群, 这一结果与许超[40]在大鲵上的研究一致。有研究表明, 添加DNJ[14,15]、桑叶多糖[41]和桑叶粉[42]等可以促进小鼠肠道有益菌的生长并抑制有害菌的生长, 改善肠道菌群结构。此外, 在本实验中, 添加MLE和DNJ降低了大鲵肠道厚壁菌门的丰度, 添加MLE提高了拟杆菌门的丰度, Yuan等[42]和Zheng等[15]在桑叶粉和DNJ上的研究得到了相似的结果。在属水平上, 对照组肠道优势菌群为瘤胃球菌科中的属, 添加MLE和DNJ后, 瘤胃球菌科细菌丰度降低, 而Romboutsia丰度增加并成为优势菌属。瘤胃球菌科细菌和Romboutsia均属梭菌目, 能够降解纤维素, 是肠道中的有益菌[43,44]。
4 结论
在日粮中添加MLE可以提高大鲵生长性能, 促进肠道发育, 提高大鲵胃和肠消化吸收、抗氧化与免疫功能, 改善肠道菌群结构, 提高肠道微生物多样性; 而添加DNJ对大鲵肠道消化、抗氧化、免疫能力及肠道发育有一定改善作用, 改善肠道菌群结构。综合胃和肠结构和功能, 复合MLE较单体DNJ效果更优。
