植物内质网胁迫研究进展
2021-06-02张融雪孙玥苏京平王胜军刘燕清佟卉孙林静
张融雪, 孙玥, 苏京平, 王胜军, 刘燕清, 佟卉, 孙林静
天津市农作物研究所, 天津市农作物遗传育种重点实验室, 天津 300384
内质网具有很多重要的功能,如参与蛋白质合成的折叠、组装、转运、分泌以及糖基化等,其中最为重要的功能之一就是对蛋白质的质量控制。内质网中存在精确的内质网质量控制系统(endoplasmic reticulum quality control, ERQC),正常条件下,分子伴侣和糖基化修饰能辅助蛋白质正确折叠,一些不正确折叠的蛋白质会被糖链标记后再次折叠[1];如果持续不能正确折叠则会被输出内质网,通过内质网相关降解(endoplasmic reticulum-associated degradation, ERAD)或自噬进行降解[2]。然而,在应激条件下,错误折叠和未折叠蛋白质大量产生而ERQC系统无法及时处理,错误折叠和未折叠蛋白质大量积累导致内质网胁迫(endoplasmic reticulum stress, ERS),进而引发未折叠蛋白质响应(unfolded protein response, UPR)。UPR能够调控一系列下游基因,如分子伴侣、ERAD组分等,如果这些调控还不能使植物内质网稳态恢复正常,UPR将会启动细胞程序性死亡(program cell death, PCD)[3]。
酵母作为一种模式生物,被广泛用于科学研究,酵母中的ERS和UPR等相关分子机制的研究已较为透彻[4]。在动物体系中,ERS的相关分子机制也己被深入探究,并发现其在神经性疾病和心血管疾病的治疗中起到关键作用[5]。当植物遭受干旱、高温、盐等胁迫时,也会引发内质网胁迫,但目前,植物内质网胁迫方面的研究较酵母和动物滞后。因此,本文从内质网质量控制系统和未折叠蛋白质响应2个方面对植物内质网胁迫现有研究进行综述,以期为进一步理解内质网胁迫和植物逆境胁迫的关系提供参考。
1 植物内质网质量控制系统
内质网是分泌蛋白和膜蛋白折叠与修饰的重要场所,存在严密的质量控制系统,该系统被称为ERQC[2]。该系统主要作用包括通过分子伴侣和糖基化修饰帮助蛋白质正确折叠,利用ERAD和自噬清除错误折叠蛋白质来维持内质网稳态[3]。正常条件下,蛋白质折叠和错误折叠蛋白质清除之间存在着精确的平衡。
1.1 植物内质网分子伴侣
植物内质网中存在多种分子伴侣,能够帮助蛋白质正确折叠。拟南芥中有3个重链结合蛋白基因(heavy-chain binding protein,BiP),均受内质网胁迫诱导因子衣霉素诱导表达,BiP能够结合内质网降解底物蛋白——油菜素内酯不敏感突变体1-5(brassinosteroid-insensitive 1-5, bri1-5)和bri1-9[6];辣椒中有3个BiPs,分别是CaBiP1、CaBiP2和CaBiP3,其中CaBiP1和CaBiP2在正常和胁迫条件下均稳定表达,CaBiP3受胁迫诱导表达,CaBiP1的RNAi植株对多种胁迫敏感[7]。拟南芥内质网定位DNAJ家族成员3B(ER-localized DnaJ family 3B, ERdj3B)是DNAJ/HSP40(heat shock protein 40)同源物,能够与BiP结合参与ERQC。谢非德基因(SHEPHER, SHD)是葡萄糖调节蛋白94(glucose-regulated protein 94, GRP94)的同源物,具有分子伴侣功能,受内质网胁迫诱导因子衣霉素和二硫苏糖醇强烈诱导[8],对其突变体分析发现SHD是克拉瓦塔蛋白(CLAVATA, CLV)合成的必要条件[3,9]。内质网滞留的蛋白质二硫键异构酶(protein disulfide isomerase, PDI)也是分子伴侣,拟南芥中有13个内质网滞留的PDI类蛋白[10],目前还没有直接证据表明PDI与错误蛋白质清除有关,但ERAD底物bri1-5的Cys62Tyr突变体能被滞留于内质网,暗示PDI可能与内质网错误蛋白质的清除有关[11]。
1.2 植物CNX/CRT循环
外源凝集素钙联蛋白(calnexin, CNX)是内质网定位的单次跨膜蛋白,N末端有凝集素结构,能够结合糖蛋白葡萄糖残基,C末端含有跨膜域。钙网蛋白(calreticulin, CRT)是内质网腔可溶性蛋白,N末端结构与CNX类似,而C末端无跨膜域但有内质网滞留信号。CNX和CRT都是凝集素类蛋白,能特异识别并结合葡萄糖基1-甘露糖基9-葡萄糖胺2(Glc1Man9GlcNAc2)修饰,还能够招募其他分子伴侣帮助被上述糖基修饰的蛋白质折叠。折叠正确的糖基化蛋白质在葡萄糖苷酶Ⅱ的作用下去除Glc1Man9GlcNAc2的Glc,使CNX/CRT对糖基亲和力下降并解离下来;折叠不完全的蛋白质由尿苷二磷酸葡萄糖糖蛋白糖基转移酶(UDP-glucose:glycoprotein glucosyl-transferase,UGGT)催化Man9GlcNAc2又生成Glc1Man9GlcNAc2,进入CNX/CRT循环[12]。拟南芥中有3个钙网蛋白CRT和2个钙联蛋白CNX,N末端球型结构、脯氨酸丰富的P结构域和C结构域是二者共同点,不同之处在于P结构域和C结构域之间是否有跨膜域,CNX有该跨膜域而CRT没有。二者N末端均可结合单葡糖基修饰的低分子聚糖,并且存在保守的KHEQKLDCGGGYVLL和IMFGPDICG序列[13]。植物CRT的另一个特征是N末端有潜在糖基化位点,但是没有高甘露糖低分子聚糖修饰。bri1-9是功能完整但是部分结构有变异的油菜素内酯受体,能被AtCRT3结合从而滞留在内质网,但是在atcrt3 bri1-9双突变体中,没有AtCRT3可结合的bri1-9又能正常转运出内质网,从而恢复了突变体对油菜素内酯(brassinosteroids, BR)的敏感性,但AtCNX没有滞留bri1-9于内质网的功能[14]。同时有研究表明,UGGT突变也能让bri1-9逃逸出内质网,当UGGT缺失时,bri1-9虽然没有正确折叠但也不能被糖基化,所以不必进入CNX/CRT循环,会被当做正常的蛋白质直接转运出内质网[15]。
1.3 植物糖基化修饰
真核生物的内质网和高尔基体中会发生N端糖基化,Asn-X-Ser/Thr被称为糖基化位点,此类糖基化由寡糖基转移酶(oligosaccharyl transferase, OST)完成,衣霉素阻断此过程可导致低聚糖链无法正确连接到初生蛋白,缺乏糖基化修饰的初生蛋白不能被分子伴侣识别而形成未折叠蛋白,进一步导致内质网胁迫[16]。
N端糖基化的质量检测由Ⅰ类α-甘露糖苷酶(alpha-mannosidase Ⅰ, MNS)控制。拟南芥中有5个MNS,分别是MNS1、MNS2、MNS3、MNS4和MNS5。其中,MNS1和MNS2定位于高尔基体,MNS3、MNS4和MNS5定位于内质网。MNS3将Man9GlcNAc2切除1个甘露糖残基后形成Man8GlcNAc2,MNS1/2继续剪切3个α-1,2甘露糖残基。MNS4和MNS5是降解bri1-5和bri1-9所必需的,而MNS1、MNS2和MNS3不参与降解过程[16]。当糖蛋白未折叠完全或者错误折叠,UGGT可催化这些蛋白质重新糖基化[17]。
1.4 植物内质网相关降解
无法恢复正确折叠的糖蛋白会被转运出内质网通过26S蛋白酶体降解,被称为ERAD。植物中已报道的ERAD相关底物有拟南芥BR受体突变蛋白bri1-5和bri1-9[18]、拟南芥液泡羧肽酶Y277位甘氨酸突变精氨酸蛋白(arabidopsis carboxypeptidase Y*glycine 277 arginine, AtCPY*-G277R)[19]、大麦抗白粉病基因1(barley powdery mildew O 1, MLO-1)和MLO-12[20]、蓖麻毒蛋白A链(ricin toxin A chain,RTA)[21]和蓖麻凝集素(ricinus communis agglutinin,RCA)[22]。
底物识别方面,AtOS9含有甘露糖6磷酸盐受体同源结构域(mannose-6 phosphate receptor homology, MRH),能识别C 链末端α-1,6甘露糖残基。在功能缺失突变体atos9中,bri1-5和bri1-9的表型可被抑制。AtOS9能与羟甲基戊二酰辅酶A还原酶降解因子3A(hydroxymethyl glutaryl-coenzyme A reductase degradation 3A, HRD3A)相互作用,二者的功能缺失突变体均对盐胁迫敏感,表明AtOS9和HRD3A均参与了植物糖蛋白的降解[23-24]。
底物转运方面,酵母与哺乳动物中推测的转运因子是羟甲基戊二酰辅酶A还原酶降解因子1(hydroxymethyl glutaryl-coenzyme A reductase degradation 1, Hrd1)、内质网降解1(degradation in the ER, Der1)和Sec61[25]。拟南芥中,Hrd1的同源物有2个(AtHrd1A、AtHrd1B),Der1的同源物有3个(DER1、DER2.1、DER2.2),Sec61的同源物有3个(AT2G34250、AT1G29310、AT1G78720);玉米中Der1的同源物有4个(ZmDer1-1、ZmDer1-2、ZmDer2-1、ZmDer2-1),ZmDer1和ZmDer2能互补酵母Δder1的表型[26]。这也表明不同物种之间ERAD作用机制是保守的。
底物泛素化方面,AtHRD1A和AtHRD1B是定位于内质网的E3泛素连接酶,参与了bri1-5和bri1-9的降解,二者的单个缺失突变体对bri1-5和bri1-9均无影响,只有二者同时突变才有影响[27]。Matα2降解子10(degradation of Matα2 10, Doa10)是酵母中定位于内质网的泛素连接酶,拟南芥中的同源物叫做无蜡质9(eceriferum 9, CER9)或者干旱缺陷抑制子(suppressor of DRY2 defects 1, SUD1),负调控脱落酸(abscisic acid, ABA)和蜡质合成从而负调控耐旱性[28],还能够通过调节甲羟戊酸途径中的关键因子HMGR的活性影响甾醇类和异戊二烯类物质的合成[29]。膜锚定环指蛋白1(RING-finger protein with membrane anchor 1, RMA1)是动物细胞中又一个定位于内质网的泛素连接酶。拟南芥中有3个同源物:AtRMA1、AtRMA2和AtRMA3,三者也都定位于内质网,并且具有体外泛素连接酶活性[30];辣椒中RMA1的同源物是CaRma1H1,通过降解水通道蛋白PIP2;1正调控转基因拟南芥的抗旱性[31];苜蓿中RMA1的同源物是MKB1,通过负调控羟甲基戊二酰辅酶A还原酶影响甾醇类物质合成[32]。黄花苜蓿盐和衣霉素诱导环指蛋白1(Medicagofalcatasalt tunicamycin-induced RING finger protein, MfSTMIR)是1个跨膜域和1个C3H2C3类型RING结构域的E3泛素连接酶,定位于内质网,表达受盐、干旱和衣霉素诱导。过表达MfSTMIR的拟南芥和苜蓿盐胁迫耐受性增强。进一步研究表明,MfSTMIR能与内质网定位的泛素结合酶MtUBC32以及内质网蛋白转运通道亚基MtSec61γ相互作用,促进ERAD相关底物MtCPY*的降解,以ERAD方式清除内质网错误折叠蛋白质来缓解盐胁迫对植物的损害[33]。底物泛素化不仅需要泛素连接酶还需要E2泛素结合酶,植物中参与ERAD的E2目前只有AtUBC32,其表达受到衣霉素和盐胁迫诱导,但是其缺失突变体对衣霉素和盐胁迫均不敏感,AtUBC32能与AtDoa10相互作用,调控bri1-5和bri1-9的降解过程[20]。
底物降解方面,细胞分裂调控蛋白48(cell division control protein 48, CDC48)是AAA(ATPases associated with diverse cellular activities)型ATP水解酶,在烟草叶肉细胞中是降解RTA和RCA所必需的[34]。无ATPase活性的CDC48A-QQ能稳定MLO-1。酵母中与ERAD相关的Ubx2、Rad23在植物中也有同源物,但是在ERAD方面的具体功能尚未报道[35]。
植物内质网降解系统还包含其他组分。甲基磺酸乙酯诱变油菜素内酯不敏感突变体1抑制因子7(ethyl methanesulfonate-mutagenized brassino-steroid insensitive 1 suppressor 7,EBS7)编码一种植物特异性的内质网定位蛋白,与ERAD组分AtHRD1a相互作用,并可能调节HRD1a的稳定性。在ebs7 bri1-9中,EBS7的缺失使得AtHrd1a稳定性下降,从而导致bri1-9多聚泛素化水平下降,增加了bri1-9的稳定性,部分恢复了ebs7 bri1-9的BR敏感性[36]。Hrd1-1相关蛋白1(protein associated with Hrd1-1, PAWH1)和PAWH2定位于内质网膜上,并且与EBS7直接互作。在ebs7突变体中,PAWH1和PAWH2的蛋白质稳定性下降,pawh1 pawh2双突变体中EBS7和HRD1稳定性下降,对内质网胁迫和盐胁迫的敏感性增强[37]。
1.5 植物内质网自噬
在内质网胁迫条件下,内质网特定区域能通过自噬进行降解和循环,这也是质量控制的一部分,植物中UPR和内质网自噬紧密相关[38]。内质网胁迫感受器IRE1B通过降解自噬基因表达抑制因子的转录本间接促进自噬,从而将自噬与内质网胁迫联系起来[39]。自噬相关基因9(autophagy related 9, ATG9)对植物中内质网胁迫引起的自噬体形成至关重要,在atg9突变体自噬相关蛋白中ATG18a的转运被破坏[40]。上述结果表明自噬在清除受损内质网膜、错误折叠蛋白质方面有重要作用。
2 植物未折叠蛋白质响应
当植物遭受干旱、高温、盐等胁迫时,会引起内质网胁迫。内质网胁迫能够引发UPR。哺乳动物中有3条经典UPR通路:肌醇需求酶1(inositol requiring enzyme 1, IRE1)-X盒结合蛋白1(X-box-binding protein 1, XBP1)、转录激活因子6(activating transcription factor 6, ATF6)-位点2蛋白酶(site-2 proteases, S2P)、蛋白激酶样内质网激酶(PKR-like ER Kinase, PERK)-转录激活因子4(activating transcription factor 4, ATF4)[41]。在植物中,IRE1-bZIP60通路对应IRE1-XBPl,bZIP17/bZIP28-S2P通路对应ATF6-S2P,目前尚未发现PERK在植物中的对应通路[3]。UPR下游调控基因一般为帮助蛋白质折叠的分子伴侣和清除错误蛋白质的ERAD组分,胁迫严重时会引发PCD相关基因表达[3]。
2.1 植物未折叠蛋白响应信号感知
IRE1是内质网胁迫感受器,在拟南芥中存在2个同源物IRE1A和IRE1B,N末端在内质网腔内具有感受结构域,中间有1个跨膜结构,C末端是激酶和核糖核酸酶结构域[42]。拟南芥中IRE1的靶基因是AtbZIP60,正常条件下AtbZIP60定位于内质网外膜。内质网胁迫能活化IRE1,AtbZIP60mRNA被活化的IRE1剪切导致跨膜域移码缺失,编码产物不再定位于内质网而是进入细胞核发挥转录因子作用[43]。这种可变剪接在ire1a和ire1b中均能检测到,但是在ire1a ire1b双突变体中却消失了,表明IRE1A和IRE1B在剪接AtbZIP60mRNA的功能上存在冗余性。AtbZIP60突变体中许多内质网胁迫相关基因表达与野生型相比显著降低,AtbZIP60还能诱导自身表达[44]。水稻中OsIRE1对OsbZIP74也有这种可变剪接的作用,不仅去除了跨膜域,而且还产生了新的核定位信号[45]。此外,AtbZIP28或AtbZIP60能与转录起始复合物组分Ash2或WDR5a相互作用,对靶基因启动子附近组蛋白H3K4me3水平进行调控,从表观层面调控目的基因表达[46]。
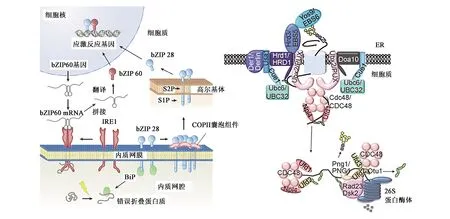
图1 植物UPR途径及ERAD系统[2,47]
ATF6是另一个内质网胁迫感受器,在拟南芥中的同源物是AtbZIP17和AtbZIP28,正常条件下均定位在内质网膜。胁迫条件下,高尔基体滞留蛋白酶S1P和S2P酶切AtbZIP17和AtbZIP28,使其进入细胞核发挥转录因子功能[48]。ATF6本身不具有结合CCACG box的活性,与NF-Y相互作用后才有顺式作用元件结合活性。AtbZIP28能与NF-YA4、NF-YB3和NF-YC2相互作用后行使基因表达调控功能,NF-YA、NF-YB和NF-YC之间也存在功能冗余[49]。AtbZIP17缺失突变体中盐响应基因ATHB-7表达量下调,对盐胁迫敏感;AtbZIP28突变体对盐胁迫不敏感,但对高温、衣霉素、二硫苏糖醇敏感[50]。在拟南芥中过表达ZmbZIP17增强了转基因拟南芥对衣霉素和二硫苏糖醇的抗性,还增强了对ABA的敏感性[51]。拟南芥bZIP28和bZIP60在热击胁迫下共同调控了一些UPR响应基因的上调表达。bzip28bzip60双突变体对热胁迫敏感,角果长度和育性均降低[52]。ZmbZIP60通过激活HSFTF13上调HSP基因表达,增强玉米耐热性,缺失突变体Zmbzip60在高温条件下不能诱导HSP上调表达,弱化了高温热击反应,导致突变体耐热性降低[53]。
还有一些植物特异的膜定位转录因子也受内质网胁迫诱导表达,参与内质网胁迫相关基因的表达调控。NAC062定位于质膜,受衣霉素和二硫苏糖醇诱导表达,并且能从质膜解离下来进入细胞核,AtbZIP60缺失影响NAC062表达。NAC062的RNAi植株中,仅有部分内质网胁迫相关基因表达受损,如SHD、BiP1/2和CRT1,而其他内质网胁迫相关基因BiP3、CNX1、PDI5和PDI6表达正常,这表明NAC062能够调控的内质网胁迫相关基因较为特异[54]。NAC089是另一个定位于内质网的转录因子,内质网胁迫时NAC089能够从内质网膜解离进入细胞核。NAC089受内质网胁迫上调表达,是AtbZIP28和AtbZIP60的直接下游。过量表达NAC089可以诱导PCD相关基因表达,但降低NAC089的表达却增强了植物内质网胁迫耐受性[55]。
2.2 植物未折叠蛋白质信号传递
UPR上调表达基因的启动子区域大部分有植物特异的顺式作用元件Motif Ⅰ CCACGTCA和Motif Ⅱ CC-N12-CCACG,小部分有动物UPR顺势作用元件ERSE-Ⅰ和ERSE-Ⅱ,还有一些酵母UPRE;UPR下调表达的基因没有发现保守的顺势作用元件[56]。拟南芥UPR信号途径诱导表达的基因分为3类:①增强蛋白质折叠和转运相关基因,如分子伴侣和囊泡运输基因;②错误折叠蛋白质降解相关基因,如ERAD相关的泛素连接酶;③减少蛋白质合成相关基因,如抑制分泌蛋白表达基因。
UPR还调控了细胞凋亡相关基因。AGB1是G蛋白β亚基,ire1a ire1b abg1三突变体与ire1a ire1b双突变体相比,对衣霉素更加敏感,但是BiP3、ERdj3A和ERdj3B的表达量在abg1中比野生型增加的多[57]。内质网胁迫和渗透胁迫诱导大豆脱水早期响应因子15(early responsive to dehydration 15,ERD15)表达,然后上调天冬氨酸丰富蛋白(N-rich protein,NPR)表达[58]。过表达NRP能够促进细胞凋亡蛋白酶类似物Caspase-3Like表达,加速DNA片段化,进而导致大豆叶片衰老[59]。衣霉素诱导的拟南芥细胞凋亡初期,Bax抑制因子1(Baxinhibitor1,Bi1)表达量急剧增加,bi1突变体对衣霉素超敏感,而过量表达Bi1的转基因拟南芥苗期对衣霉素不敏感,这表明Bi1在内质网胁迫诱导细胞死亡中起到关键作用。Bcl-2相关永生基因(Bcl-2-associated athanogene, BAG)是另一个抗凋亡因子,AtBAG7定位于内质网,与BiP2有相互作用,bag7缺失突变体对衣霉素更敏感[60]。
3 展望
内质网中的蛋白质折叠是真核细胞的一个重要过程,该过程受到内质网质量控制监测,内质网中异常折叠蛋白质的积累导致ERS,进而引发UPR,这一过程在酵母和哺乳动物细胞中研究较为详细,而植物中研究较少。随着ERAD和UPR关键组分在植物中得到确认,植物内质网胁迫研究逐渐深入,如HRD1和Doa10是哺乳动物细胞中构成ERAD复合体的核心泛素连接酶,在植物中分别是AtHRD1A/AtHRD1B和SUD1/CER9[28-29];哺乳动物细胞中UPR通路IRE1-XBPl和ATF6-S2P,在植物中对应的分别是IRE1-XBPl和bZIP17/bZIP28-S2P[3]。除了上述保守组分,研究还发现了一些植物特异组分,如ERAD途径相关的EBS7[36]、MfSTMIR[33]、PAWH1和PAWH2[37],UPR途径中的膜定位NAC转录因子NAC62[54]以及内质网定位的NAC089[55],这些研究极大丰富了对植物内质网胁迫的认识。虽然植物内质网胁迫研究取得了长足的进步,但是仍存在一些问题,如Doa10在植物干旱反应中发挥作用,但其作用靶标尚未确定;哺乳动物细胞中UPR途径的PERK/ATF4通路在植物中并未发现对应组分。因此,在植物内质网胁迫研究中还应关注以下几方面:①内质网相关降解的底物鉴定研究需要加强,目前仅有CaRma1H1和SDIR1 的底物比较明确,其他内质网降解相关E3泛素连接酶的底物仍不清楚。②植物内质网胁迫相关的特异组分,例如EBS7、MfSTMIR等报道对环境胁迫有作用,但是尚未有其他特异组分报道。③关于内质网降解相关底物由内质网腔转运至细胞质的过程在植物中仍不明确,具体组分不清楚。④植物UPR途径组分研究相对较少,还有待发现更多组分并明确功能。
