Apelin-13对急性坏死性胰腺炎大鼠胰腺组织中自噬的影响
2021-06-02
(南华大学附属第一医院胃肠外科,湖南省衡阳市 421001)
急性胰腺炎(acute pancreatitis,AP)是由于各种因素引起的胰酶被激活而造成胰腺及周围正常组织呈现自身消化进而引起的急性炎症性疾病。AP在病情控制不好而进展为伴有局部及全身并发症的急性坏死性胰腺炎(acute necrotizing panceratitis,ANP)、重症急性胰腺炎(severe acute pacreastitis,SAP)时其病情非常凶险,因为其可发展成为全身炎症反应综合征、胰腺组织坏死及出现多器官功能障碍综合征,死亡率可达15%~20%[1]。自噬是细胞生存的机制之一,参与并维持着机体的正常生物活动,LC3-Ⅱ、Beclin-1为参与自噬过程不同阶段的重要蛋白质。目前已证实自噬可以调节细胞的代谢来适应外部环境的刺激[2]以及调控多细胞机体的免疫及炎症反应等[3]。自噬参与了急性胰腺炎的病理和生理过程,并且不正常的自噬促使了胰蛋白酶的激活,进而诱发急性胰腺炎。Apelin是一种具有生物活性的肽类激素,具有多个亚型,其中Apelin-13是正常人体血浆中存在的最主要的亚型[4-5]。而且Apelin可以通过阻碍NF-κB的活化从而抑制炎症反应[6]。本实验通过研究Apelin-13对急性坏死性胰腺炎大鼠胰腺组织病理学变化、自噬相关基因LC3-Ⅱ、Beclin-1的表达情况以及血清淀粉酶水平的影响,来探究Apelin-13在ANP治疗中的作用及其机制,以期为探索ANP新的治疗方案提供理论依据。
1 材料和方法
1.1 试剂
牛磺胆酸钠、抗LC3-Ⅱ抗体购自美国Sigma公司,水合氯醛购自上海生工生物公司,抗β-Actin购自中国中杉金桥生物技术有限公司,Apelin-13购自美国Santa公司,抗Beclin-1抗体购自美国BioVision公司,BCA蛋白定量试剂盒购自上海玉博生物科技有限公司,ECL显色液购自美国Pierce公司。
1.2 动物及分组
8周龄健康、清洁级SD大鼠54只,由南华大学动物部提供,雌雄不限,体质量220~250 g,25 ℃室温条件下自由饮水、摄食。将54只SD大鼠随机分为对照组、造模组、给药组,每组18只。各组内再采用随机分组法分为处理后3 h、6 h、12 h亚组,每个亚组6只SD大鼠。
1.3 ANP模型的建立
造模组和给药组采用改良的Ahd方法经十二指肠乳头微量泵逆行胰胆管注射5%牛磺胆酸钠溶液(0.1 mL/min,1 μL/g)构建急性坏死性胰腺炎模型[7],即实验前SD大鼠禁食12 h、禁水2 h,于SD大鼠的腹腔内注射10%的水合氯醛(3 μL/g)约5 min后大鼠被完全麻醉,将其于实验架固定、腹部予以备皮、消毒、铺无菌单。取其剑突下正中切口依次进入腹腔,用眼科镊缓慢拉出十二指肠,见一斜型透明的管道开口于十二指肠大乳头处,确定了此斜型透明的管道即为胰胆管,胰腺组织呈粉红色、片状包绕透明的胰胆管,用无损伤的动脉夹将肝门部的胆管予以夹闭,以防浓液进入肝脏,用无菌钳轻柔地提起十二指肠,在十二指肠大乳头孔侧边的无肠系膜血管区的肠壁上缓慢地插入一次性静脉留置针,仔细辨别胰胆管的起始部位和胰胆管的走向,将留置针缓慢地插入胰胆管,长度约5 mm,拔出留置针针芯后将胆总管段的留置针轻轻捏住,等待助手将留置针末端的导管接至装有5%的牛磺胆酸钠注射器,然后使用微量输液泵匀速推注5%的牛磺胆酸钠溶液,缓慢匀速注完,拔出针头用生物蛋白胶封闭肠壁穿刺孔,缝合关腹。5 min后给药组大鼠尾静脉注射Apelin-13(0.1 μg/g),造模组大鼠尾静脉注射等量生理盐水。对照组大鼠开腹仅翻动胰腺后关腹,尾静脉注射等量的生理盐水。造模完成后根据血清淀粉酶水平、病理学变化对ANP大鼠模型是否建立成功进行判定。
1.4 胰腺大体和病理形态观察
按照实验分组方案,在术后的3 h、6 h、12 h肉眼观察胰腺病理变化及钙化灶、胰腺周围器官的血运情况,然后腹主动脉穿刺取血3~5 mL,采血完成后立即处死大鼠,然后将大鼠的胰腺组织切下,取一部分胰腺组织用10%的中性甲醛固定,常规HE染色,光镜下阅片,观察胰腺组织病理学变化,并进行胰腺组织的病理评分。按照改良的Schmidt评分标准[8]对大鼠胰腺组织进行病理评分,评分越高代表胰腺损伤程度越重。
1.5 血清淀粉酶的检测
将新鲜大鼠血液4 ℃ 3 000 r/min离心10 min,取上清液,采用全自动生化分析仪测定血清淀粉酶。
1.6 Western blot测定自噬相关蛋白
将切下的胰腺组织保存在-80 ℃冰箱,提取胰腺组织总蛋白,Western blot检测自噬相关蛋白LC3-Ⅱ、Beclin-1的表达情况。
1.7 统计学处理
2 结 果
2.1 3组大鼠各时间点血清淀粉酶比较
对照组各时间点血清淀粉酶含量差异无显著性;造模组、给药组各时间点较对照组的血清淀粉酶含量均明显升高(P<0.05)。与造模组比较,给药组大鼠各时间点血清淀粉酶明显降低(P<0.05;表1)。

表1 3组大鼠各时间点血清淀粉酶比较 单位:U/L
2.2 3组大鼠胰腺形态变化
对照组中胰腺组织未见水肿,形态呈分叶状,分叶结构清晰,质软。造模组胰腺重度充血水肿,呈紫黑色,可见出血、坏死的表现及有胃肠道扩张及胃储留现象,有皂化斑形成,并有少量或中量腹水形成。给药组可见组织局部水肿,表面充血,包膜张力增高(图1)。

图1 3组大鼠术后不同时间胰腺形态
2.3 3组大鼠胰腺组织病理变化
对照组各时间点的胰腺未见明显病理变化,结构清晰,腺泡较完整,叶间偶见水肿,无出血、坏死等表现。造模组中可见灶状或大片状坏死表现,腺泡结构遭到破坏,并见炎症细胞及红细胞浸润,血管扩张有出血表现,给药组大鼠各相对应的时间点胰腺组织的水肿、炎症、出血及坏死表现均较造模组大鼠程度有所减轻,偶尔可见小部分胰腺腺泡细胞变性坏死(图2)。
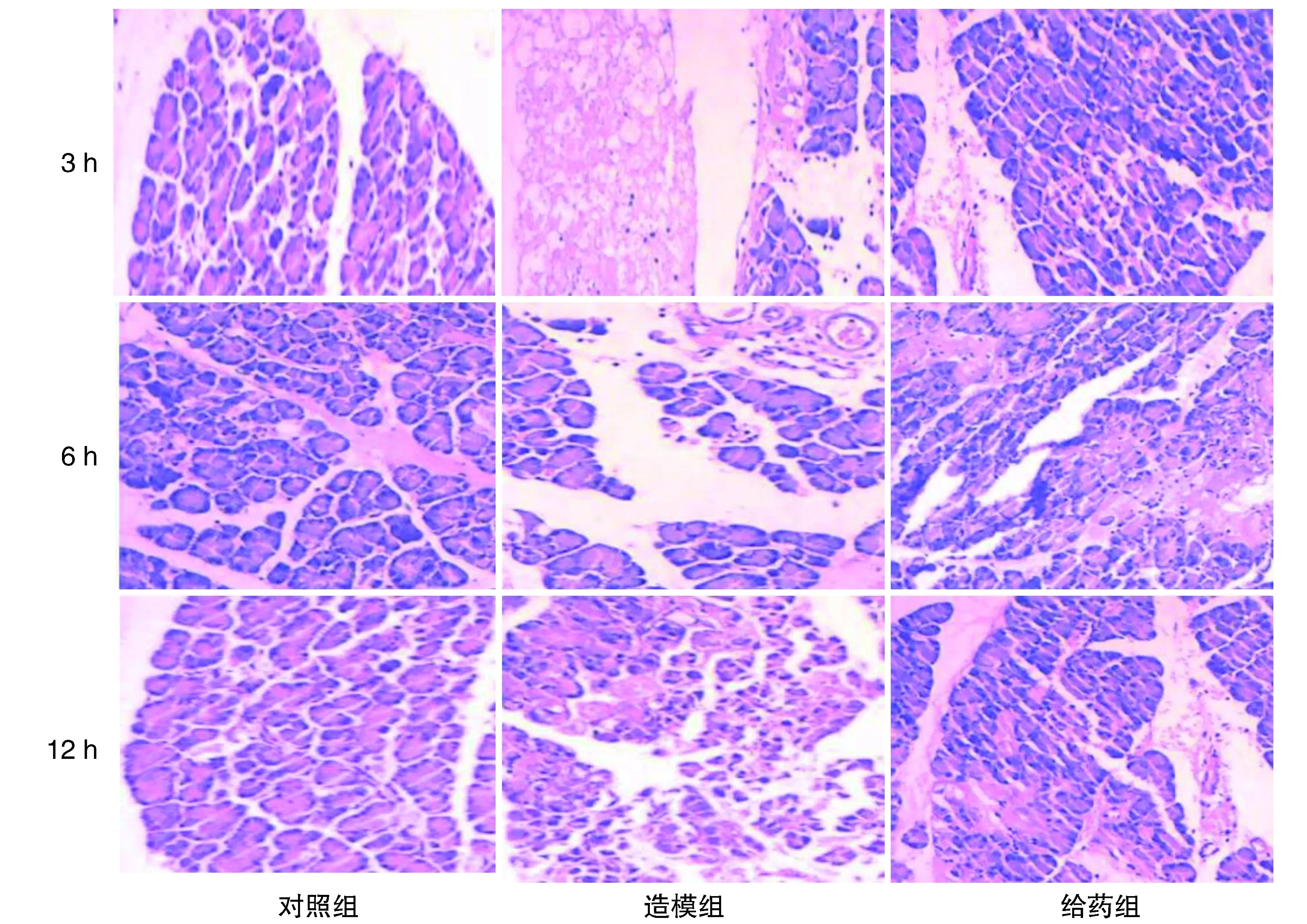
图2 3组大鼠术后不同时间胰腺组织病理变化(HE,100×)
2.4 3组大鼠胰腺组织病理改变评分比较
造模组、给药组与对照组同一时间点的病理评分比较,差异有显著性(P<0.05);造模组损伤评分明显增加,且随着时间的延长损伤程度有所增加(P<0.05);与造模组比较,给药组大鼠各时间点病理评分明显降低(P<0.05;表2)。

表2 各组大鼠术后各时间点胰腺组织的病理改变评分 单位:分
2.5 Apelin-13对LC3-Ⅱ蛋白的影响
与对照组比较,造模组及给药组大鼠胰腺组织中LC3-Ⅱ蛋白的表达在造模成功后的3 h、6 h和12 h均出现显著增加(P<0.05),且在12 h达到高峰;给药组较造模组在各时间点的LC3-Ⅱ表达显著降低(P<0.05;图3和表3)。
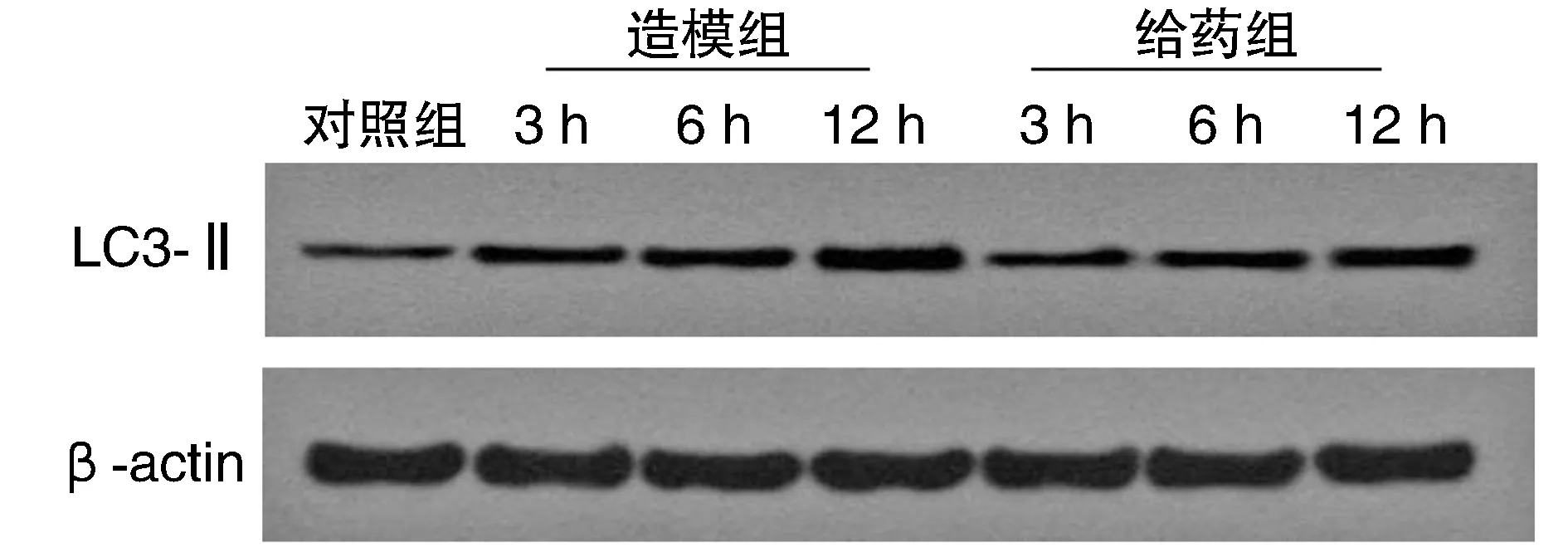
图3 ANP大鼠胰腺组织LC3-Ⅱ蛋白的相对表达量
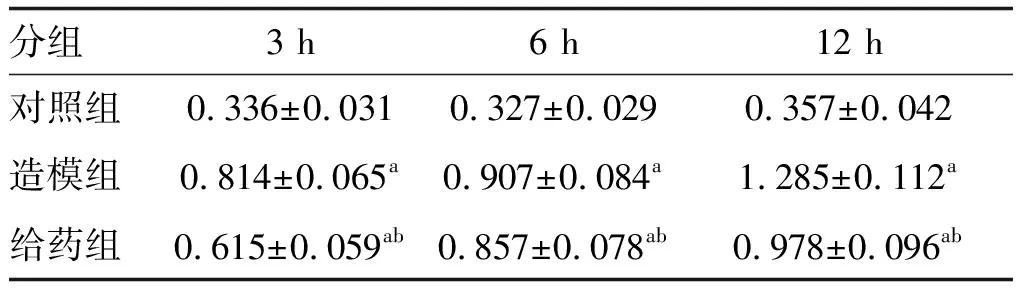
表3 各组大鼠不同时间LC3-Ⅱ的比较
2.6 Apelin-13对Beclin-1蛋白的影响
与对照组比较,造模组、给药组大鼠胰腺组织细胞Beclin-1蛋白的相对表达水平显著增加(P<0.05),并且在12 h时达到最高。与造模组比较各时间点给药组大鼠胰腺组织细胞Beclin-1蛋白的相对表达量显著降低(P<0.05;图4和表4)。
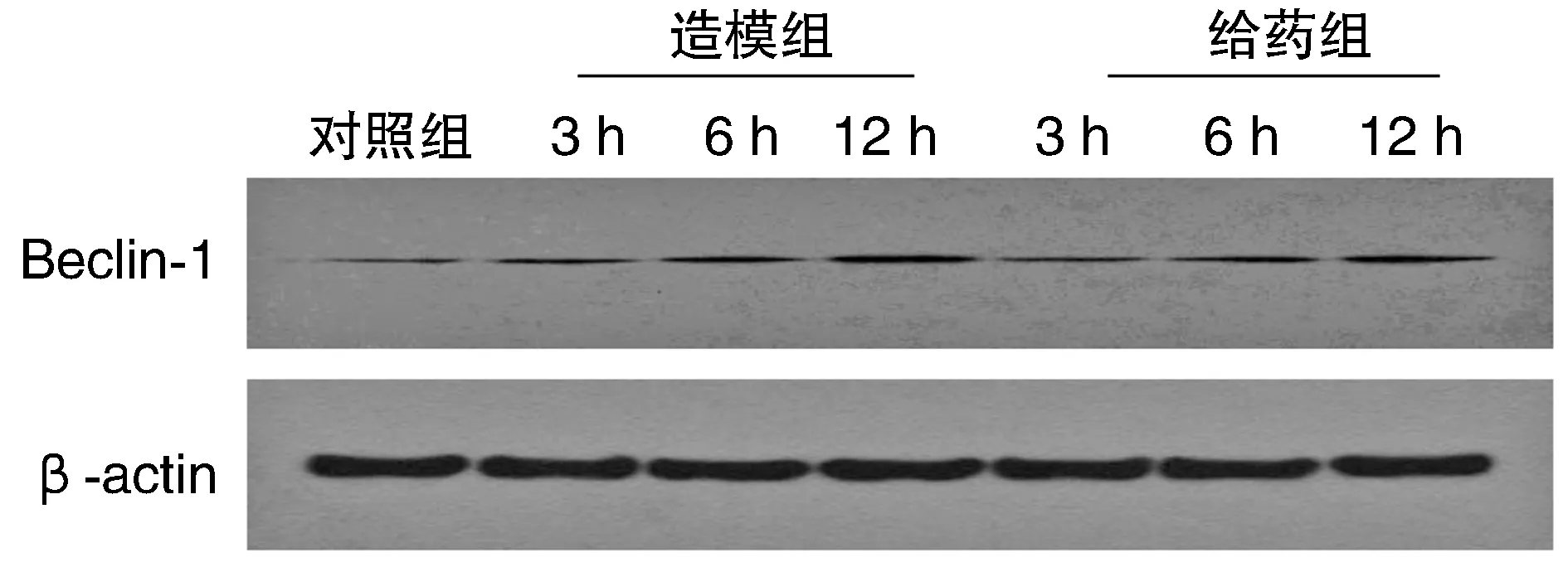
图4 ANP大鼠胰腺组织Beclin-1蛋白的相对表达量
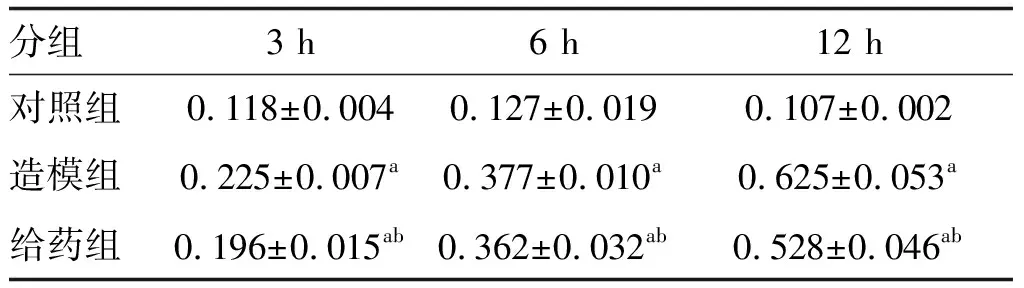
表4 各组大鼠不同时间Beclin-1的比较
3 讨 论
3.1 SD大鼠ANP模型的建立
国内外学者为了对ANP的发病机制进行研究,对于建立动物模型有着丰富的经验,与人体疾病类似,其可靠性、可重复性、可控性是建立急性坏死性胰腺炎理想模型[9]的必备条件。ANP的动物模型建立通常有五种方法:雨蛙素注射法[10]、牛黄胆酸钠胰胆管逆行注射法[11]、结扎法[12]、高钙血症法、L-精氨酸诱导法[13],其中牛黄胆酸钠胰胆管逆行注射法为首选。此次实验使用5%牛磺胆酸钠胰胆管逆行注射方法制备出了SD大鼠ANP模型,并根据血清淀粉酶水平、病理学变化来对ANP大鼠模型是否建立成功进行了判定。大鼠的造模组、给药组与对照组的血清淀粉酶值比较有着显著性提高,并且给药组较造模组大鼠血清血清淀粉酶有所降低。对照组的胰腺组织未见明显的病理变化;造模组中可见胰腺组织大片状坏死、红细胞及炎症细胞的浸润,腺泡结构遭到破坏,并随时间的延长而有所加重。3 h给药组可见部分叶间隙出现水肿现象,少许炎症细胞浸润,6 h、12 h给药组可见叶间隙弥漫性水肿,小叶有分离,出现大量炎症细胞浸润,并出现少量出血。根据实验结果,可以证实造模非常成功,并说明了Apelin-13能降低ANP SD大鼠的血清淀粉酶值及缓解胰腺组织的病理损伤程度。
3.2 自噬在ANP发病过程中的作用
自噬在细胞受损时起到了重要的保护作用,正常自噬在急性坏死性胰腺炎发病过程中对胰腺细胞起着很好的保护作用。然而自噬相关蛋白在ANP中表达是增加的,目前此结论已被国内学者在实验中[13-14]所证实。并有国外的学者在实验动物和人的胰腺炎腺泡细胞中发现都有空泡的累积[15-16],并且通过研究证实了大多数空泡就是自噬空泡,且证实自噬溶酶体是自噬空泡的主要组成部分。
现阶段学者们已把LC3当作观察自噬是否存在的标志性分子[17]。LC3有I型和Ⅱ型之分,有研究表明LC3-Ⅱ/LC3-Ⅰ的比值或者LC3-Ⅱ的含量与自噬成正相关[17],特别是LC3-Ⅱ蛋白的相对表达量,通常可以用来反映自噬的活性。本次实验应用Western blot来检测LC3-Ⅱ蛋白的相对表达量,结果显示造模组各时间点LC3-Ⅱ蛋白的表达较对照组明显增加。由此表明了SD大鼠发生ANP后自噬活性是增强的且自噬活性会随着病理损伤程度的加重而增加。
Beclin-1基因已知广泛存在于人类的正常组织中,它最主要的作用是调节自噬过程,因而被称为“自噬基因”。Beclin-1对自噬的调控起到了重要作用[18],一旦Beclin-1基因缺失时将会导致自噬活性明显降低[19]。本次动物实验结果中造模组各时间点的Beclin-1蛋白的表达较对照组明显增加。
3.3 Apelin-13对ANP中自噬相关蛋白表达的影响
本实验采用Western blot来检测自噬相关蛋白的相对表达量。结果显示给药组SD大鼠发生ANP后各时间点的LC3-Ⅱ、Beclin-1蛋白相对表达量较造模组显著降低,提示ANP后自噬活性可能被Apelin-13所抑制。证实了Apelin-13通过对自噬活性的抑制来实现对大鼠ANP后胰腺组织细胞的保护。
综上所述,Apelin-13可以通过下调自噬相关蛋白LC3-Ⅱ、Beclin-1的表达水平及抑制SD大鼠ANP后的自噬活性,来实现对胰腺组织的保护作用。从而为ANP的药物治疗开拓了新的临床思路。
