E型沙眼衣原体持续性感染模型的建立与鉴定
2021-06-02
(南华大学衡阳医学院病原生物学研究所 特殊病原体防控湖南省重点实验室,湖南省衡阳市 421001)
沙眼衣原体(Chlamydia trachomatis,Ct)是专性细胞内寄生病原体,具有独特的双相发育周期。Ct生殖道感染通常呈慢性或无症状,容易形成上行性感染,从而导致严重并发症,例如附睾炎、前列腺炎、子宫内膜炎、异位妊娠和不育等[1-2]。尽管许多国家实行了包括教育、筛查和抗生素治疗在内的公共卫生干预,Ct感染仍然是一个严重的全球性健康问题[3-4]。
Ct原体(elementary body,EB)通过内吞、受体介导等方式进入宿主细胞后发育为网状体(reticulate body,RB),当RB暴露于不利的环境条件时,形成异常增大、有一定代谢活力而无感染力的RB,称为异形体(aberrant body,AB),从而进入持续性感染。抗生素的暴露、氨基酸、葡萄糖、铁的剥夺以及病毒感染等均被证明可诱导衣原体持续性感染[5-7]。Ct持续性感染与致病性和药物敏感性等密切相关,因此,建立Ct持续性感染模型可为研究其致病机制和新药研发提供重要研究手段。Ct持续性感染的诱导因素中,干扰素-γ(interferon-γ,IFN-γ)和青霉素最为常见[8-9]。IFN-γ主要通过活化吲哚胺-2,3-双加氧酶(indoleamine2,3-dioxygenase,IDO),IDO将色氨酸分解为犬尿氨酸,从而引起Ct发生营养应激;青霉素可使青霉素结合蛋白失活,抑制细菌细胞壁合成所需的肽聚糖交联作用,促进Ct进入持续性感染状态。为建立适宜的细胞内生存环境,衣原体已进化多种策略调控宿主细胞生物学行为,其中,抵抗宿主细胞凋亡是衣原体实现免疫逃逸的重要机制之一[10-12]。
Ct共有19个血清型,不同国家和地区Ct感染基因型存在差异。流行病学发现,江苏省、广东省、广西省和海南省的男性Ct阳性标本以血清型F、E、J、D和G型为主[13];广东省男性尿液中Ct感染以血清型D、E、F和J型为主[14];中国南方地区女性生殖道中Ct感染以血清型E、F、J和D型为主[15]。鉴于E型Ct(Ct E)感染在临床上较为常见,且IFN-γ作为诱导剂更能模拟生理状态下宿主与衣原体之间的相互作用,因此,本实验选择IFN-γ作为持续性感染诱导剂,建立E型Ct持续性感染细胞模型,并分析了Ct感染细胞抵抗细胞凋亡的能力,为进一步探讨Ct持续性感染致病机制提供实验基础。
1 材料和方法
1.1 主要材料
FITC-Annexin V/PI凋亡试剂盒为苏州宇恒生物科技公司产品;TRIZol为Invitrogen公司产品;Cy2标记的羊抗兔IgG抗体为Proteintech公司产品;DEAE-葡聚糖为Sigma公司产品;Ct E型菌株、HeLa细胞均为南华大学病原生物研究所保存。
1.2 衣原体持续性感染模型的构建
将HeLa细胞接种于6孔板培养过夜,当融合度为80%时,吸弃培养基,细胞经30 mg/L DEAE预处理15 min后,每孔加入Ct E血清型感染2 h,随后更换为含25~150 U/mL IFN-γ、2 mg/L放线菌酮和10% FBS的DMEM培养基,37℃、5% CO2细胞培养箱中培养40 h。部分实验在Ct持续性感染诱导24 h时更换为不含IFN-γ的新鲜培养基,继续培养16 h后收集衣原体,再感染新的HeLa细胞,分析去除IFN-γ后衣原体感染力。实验中以不加IFN-γ培养基的衣原体感染组作为急性感染组对照。
1.3 间接免疫荧光检测衣原体包涵体
HeLa细胞经不同因素处理后,依次经4%多聚甲醛固定、0.1% Triton X-100透化和含10% FBS的DMEM封闭处理后,加入兔抗Ct抗体,37 ℃孵育1 h,PBS洗涤后再加入Cy2标记的羊抗兔IgG抗体以及核酸染料Hoechst 33258,37 ℃、1 h,荧光显微镜计算Ct包涵体形成单位(inclusion forming units,IFUs),每个样本随机挑选高倍镜视野5~10个,Image J软件计算包涵体大小(以面积表示大小)。
1.4 实时荧光定量PCR检测Ct相关基因表达水平
分别收集12、24、40 h急性感染组和持续性感染组细胞,TRIZol裂解液提取不同时间总RNA。从GenBank中查找Ct dnaA、dnaK、groEL、ompA、ftsK、htcA、oppA.4和htrA基因序列,设计各目的基因特异性引物,基因引物序列见表1,引物由上海生工生物公司合成。以总RNA为模版反转录成cDNA,然后再进行实时荧光定量PCR(qRT-PCR)扩增,体系设置为cDNA 1 μL,SYBR® Green PCR Master Mix 12.5 μL,正、反向引物各1 μL,灭菌蒸馏水9.5 μL。反应条件设置为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸30 s,40个循环后,72 ℃继续延伸5 min。通过2-△△Ct计算目的基因mRNA的相对转录水平。

表1 qRT-PCR引物序列
1.5 Hoechst染色分析细胞凋亡率
Ct持续性感染12、24、40 h时加入20 μg/L肿瘤坏死因子-α(TNF-α)处理6 h诱导细胞凋亡,同时设立对照组。细胞经固定、透化和封闭后,加入Hoechst 33258,室温下避光染色30 min,PBS洗涤后置于荧光显微镜下观察。每个样本随机选取5个视野,计算视野中总细胞数和凋亡小体数量,依照公式对各时间点凋亡率进行计算,细胞凋亡率(%)=细胞凋亡数/总细胞数×100%。
1.6 流式细胞仪检测细胞凋亡
分别收集Ct急性感染和持续性感染12、24、40 h后并且经TNF-α处理的HeLa细胞,100 μL结合缓冲液重悬细胞(5×105个),每管加入5 μL FITC-Annexin V和5 μL PI工作液,4 ℃避光孵育15 min,流式细胞仪(FCM)检测细胞凋亡率。
1.7 统计学分析
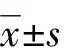
2 结 果
2.1 IFN-γ诱导Ct持续性感染最佳剂量
与未处理组(0 U/mL)比较,50、75、100和150 U/mL IFN-γ均可降低Ct的感染能力(P<0.05)。当IFN-γ剂量增加为75 U/mL及以上时,子代Ct IFUs较未处理组显著降低(P<0.001;图1和图2),故选择75 U/mL IFN-γ作为Ct持续性感染最佳诱导剂量。
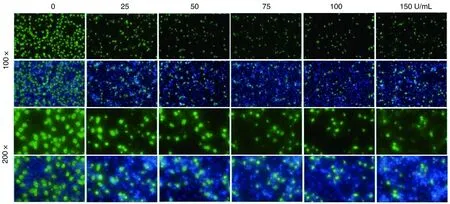
图1 不同剂量IFN-γ对Ct子代IFUs的影响(Hoechst 33258染色)
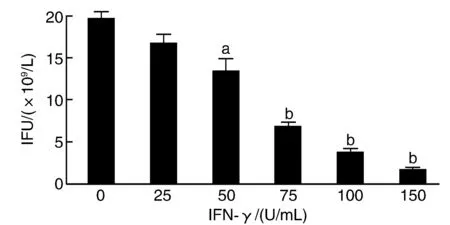
图2 不同剂量IFN-γ对Ct持续性感染的影响a为P<0.05,b为P<0.001,与未处理组(0 U/mL)比较。
2.2 持续性感染状态下Ct包涵体的形态变化
与IFN-γ未处理组比较,IFN-γ诱导后包涵体结构相对疏松,包涵体面积为(89.33±15.56) μm2,显著小于IFN-γ未处理组(144.70±12.34) μm2(P<0.05),并且出现大小不均一的现象(图3)。
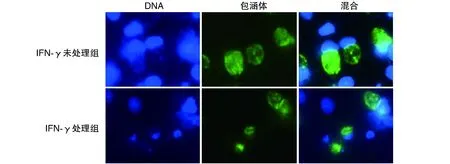
图3 持续性感染下Ct包涵体的形态学变化(Hoechst 33258染色,1 000×)
2.3 移除诱导因素后Ct感染能力的恢复
IFN-γ移除组子代Ct IFUs为(12.60±0.52)×109/L,而未移除IFN-γ组IFUs为(3.60±0.52)×109/L,培养过程中移除IFN-γ后,子代衣原体感染力得到显著提高(P<0.05;图4)。
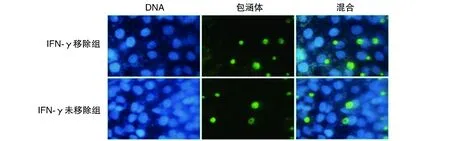
图4 IFN-γ对子代Ct IFUs的影响(Hoechst 33258染色,400×)
2.4 持续性感染状态下Ct基因转录水平检测
Ct持续性感染状态下,dnaA和dnaK转录水平24 h明显受到抑制(P<0.05;图5);热休克蛋白60编码基因groEL和细菌分裂相关基因ftsK在持续性感染中期阶段转录水平受到抑制(P<0.05;图5),而在感染晚期释放阶段,急性感染细胞中两者转录水平下降,低于持续性感染细胞(P<0.05;图5);膜结构基因ompA转录水平显著低于急性感染(P<0.05;图5);参与发育调节的htcA转录水平在感染晚期阶段低于急性感染;参与能量代谢的oppA.4和htrA在两种感染状态下差异无显著性(P>0.05;图5)。以上结果表明,Ct在持续性感染状态下仍具有代谢活性,但其DNA复制、细菌分裂和发育周期调节均受到抑制。
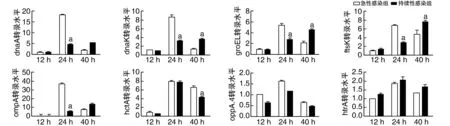
图5 急性感染和持续性感染12、24、40 h Ct相关基因相对转录水平的比较a为P<0.05,与同时间持续性感染组比较。
2.5 Ct持续性感染抵抗宿主细胞凋亡
TNF-α诱导细胞凋亡后,Hoechst染色结果显示(图6A),与阳性对照组比较(31.46%),Ct持续性感染12 h、24 h和40 h的细胞凋亡率分别为14.32%(P<0.05)、16.98%(P<0.05)和24.83%(P>0.05)。FCM结果显示(图6B),Ct持续性感染12 h和24 h的细胞凋亡率分别为14.77%、18.71%,均显著低于阳性对照组(33.63%;P<0.05),感染40 h时细胞凋亡率为26.32%,与阳性对照组差异无显著性(P>0.05)。Ct在感染12和24 h时呈现抗凋亡现象,随着感染时间延长,Ct抗凋亡能力下降。
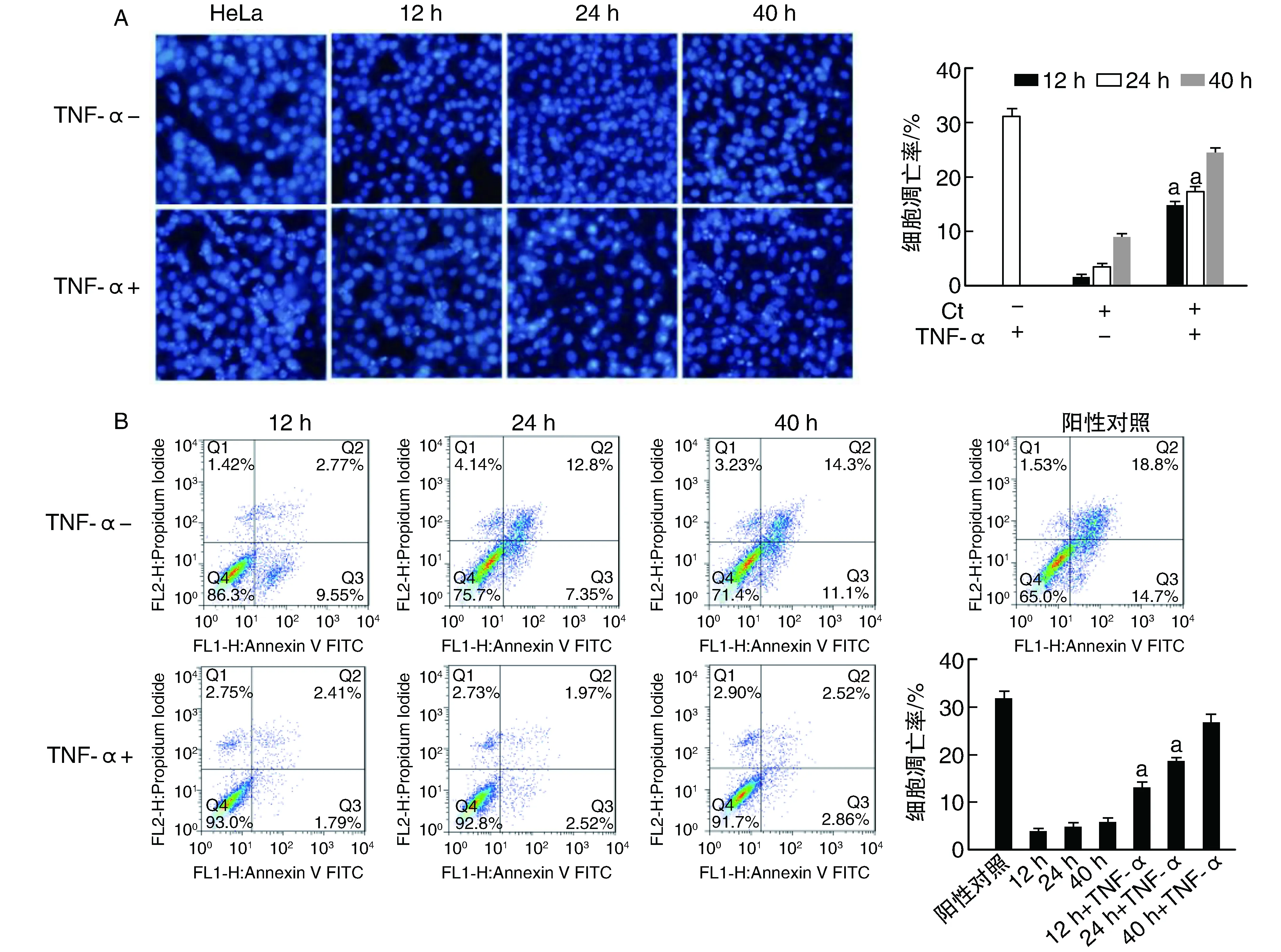
图6 Ct持续性感染12、24、40 h抵抗TNF-α诱导的细胞凋亡A为Hoechst染色检测细胞凋亡(200×);B为FCM检测细胞凋亡。a为P<0.05,与阳性对照组比较。
3 讨 论
Ct是世界范围内引起性传播感染的主要病原体之一,可在细胞因子、营养缺陷和某些抗生素应用等不利情况下,形成形态异常且体积明显增大的AB,AB有活力但无感染力,能长期存在于细胞内,是衣原体持续性感染的重要标志。尽管针对Ct已开发出了许多药物进行治疗,但衣原体在宿主体内形成隐匿的持续性状态仍是衣原体长期且反复感染的根本问题。因此,构建Ct体外持续性感染的细胞模型能够为探究衣原体持续性感染状态下的分子机制提供研究基础。
NK细胞和活化的T淋巴细胞是IFN-γ的主要来源细胞[16]。与青霉素相比,IFN-γ是机体内源性产生的免疫调节因子,以IFN-γ作为诱导剂的Ct持续性感染模型相比于青霉素所诱导的模型,更为接近衣原体感染宿主后的生理状态。IFN-γ诱导持续性感染的主要机制在于其诱导IDO的生成,该酶是色氨酸分解代谢过程中的关键酶,而色氨酸是Ct生长发育过程中必不可少的氨基酸。IFN-γ诱导IDO生成后,色氨酸分解为犬尿氨酸导致衣原体可利用的色氨酸减少,从而抑制衣原体生长。由于生殖道Ct(血清型D-K型)的色氨酸合成酶基因trpBA可将阴道菌群所分泌的吲哚转化成为色氨酸,使得Ct在IFN-γ诱导的色氨酸缺乏状态下不会因为色氨酸的完全缺乏而死亡,进入持续性感染状态。本实验使用不同剂量IFN-γ处理Ct感染细胞,研究发现75 U/mL IFN-γ可显著诱导建立E型Ct持续性感染。
Ct在持续性感染过程中,其形态会发生显著变化。不同诱导因素下,不同种属衣原体在不同类型的宿主细胞中所形成的包涵体形态具有一定差异。在青霉素G诱导的持续性感染模型中,E型Ct感染HeLa细胞后,包涵体显著减小,结构致密[6];而青霉素G诱导鹦鹉热衣原体Hep-2细胞持续性感染状态下,包涵体形状上多不规则,包涵体同质性降低[17];IFN-γ诱导Hep-2细胞中E型Ct持续性感染中,包涵体轮廓不规则,呈现多形态性,体积上大小不均一[18]。本实验发现IFN-γ诱导后,Ct包涵体大小和形态发生改变,移除IFN-γ诱导剂,包涵体形态部分得到恢复,子代衣原体感染后IFUs显著增加。
Ct持续性感染期间,除形态发生变化外,参与膜结构、能量代谢和发育周期调节等细胞生物学进程的基因表达同样也会发生变化[17]。AB在细胞内表现为具有代谢活力而复制能力减弱,因此本实验对衣原体参与DNA修复和重组相关的dnaA和dnaK、参与细菌分裂的ftsK、参与蛋白水解和肽转运的oppA.4和htrA、参与衣原体膜结构的ompA以及发育调节的htcA和groEL进行了转录水平的检测。结果发现与DNA重组(dnaA和dnaK)、细菌分裂(ftsK)、膜结构(ompA)相关基因的转录在持续性感染中期阶段明显受到抑制。DNA重组和细菌分裂发生于衣原体感染早期阶段,该阶段EB分化形成RB后,RB从宿主细胞中获取营养物质从而实现自身增殖,IFN-γ诱导的持续性感染则限制了Ct摄取营养进行复制。值得注意的是,在感染晚期阶段,急性感染细胞中RB再分化为EB,因此参与复制和分裂相关基因的转录水平明显降低。
衣原体通过抵抗宿主细胞凋亡来完成自身增殖,抗凋亡效应是衣原体自我保护机制之一[10,19-21]。因此,对衣原体感染抗凋亡机制的研究,能够为治疗衣原体感染提供新的靶点。为检测Ct持续性感染状态的抗凋亡作用,通过Hoechst染色和FCM对细胞凋亡率的分析,证实Ct感染后能抵抗宿主细胞凋亡,并且发现随着感染时间的延长,Ct抗凋亡能力下降,推测可能与Ct感染晚期EB释放有关。
总之,本实验成功构建了IFN-γ诱导的E型Ct持续性感染体外模型,发现Ct在持续性感染状态下仍具有代谢活性,参与Ct DNA复制、细菌分裂和发育周期调节等相关基因在持续性感染中期或晚期转录水平发生明显改变,本研究为进一步探讨Ct致病机制提供实验依据。
