核磁共振脂肪量化预测骨质疏松椎体骨折的意义△
2021-06-01孙文路刘姣姣郭兴满陈华芳
孙文路,刘姣姣,郭兴满,陈华芳,秦 健
(山东第一医科大学第二附属医院医学影像科,山东泰安271000)
随着人口老龄化日趋加剧,骨质疏松症(osteo⁃porosis,OP)的发病率在逐年攀升,由此引发的OP性骨折的风险也逐渐增大。虽然,低骨量是脆性骨折的一个主要指标,但超过50%的骨折病例发生在骨密度 (bone mineral density,BMD) 正常的人群中[1],因此BMD不能完全反映骨强度的实际变化。研究证明骨强度不仅取决于BMD,还取决于骨髓质量,OP患者的骨强度降低往往伴随着骨髓脂肪组织数量的增加[2]。近年来,IDEAL-IQ作为脂肪量化技术的使用,越来越多地应用于腹部脏器如肝脏、胰腺等[3,4],在骨质疏松性椎体压缩骨折(osteoporotic vertebral compression fracture,OVCF)中的应用罕见报道,本文拟探讨IDEAL-IQ技术在OVCF中的意义。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)住院或门诊患者;(2)年龄40~90岁,行腰椎MRI常规序列及IDEAL-1Q序列扫描,以及BMD检查;(3)伴有或无OVCF。
排除标准:(1)内分泌、代谢性疾病,如严重肝肾疾病、甲状旁腺疾病、糖尿病、先天性骨代谢异常等;(2)未服用影响骨代谢的药物,如激素;(3)椎体肿瘤、结核等疾病,以及有放化疗史。
1.2 一般资料
本研究经过医院伦理委员会讨论批准,受检者均选自山东第一医科大学第二附属医院门诊或住院患者,2020年1月~2020年12月行腰椎MRI常规序列及IDEAL-1Q序列扫描,共147例患者。其中,女108例,男39例,年龄40~89岁,平均(66.72±8.78)岁。依据临床及影像是否发现脊柱OVCF,将患者分为两组。骨折组82例,女59例,男23例;非骨折组65例患者,女49例,男16例。从每个受试者的医疗记录中收集一般数据,包括患者年龄、性别、身高、体重、体质指数(bodymassindex,BMI)等。
1.3 检查方法
1.3.1 核磁共振成像检查
采用GE公司Discovery MR 750 3.0T及CTL线圈,患者取仰卧位,扫描序列包括腰椎常规序列及矢状位IDEAL-IQ序列。IDEAL-IQ序列扫描参数:TR=7.7 ms,TE=Min full,NEX=0.5,FOV=25.0 cm×25.0 cm,层厚=10 mm,Phase=160,间距=0.5 mm,反转角=40,扫描时间38 s,扫描后系统自动生成脂肪分数图。
1.3.2 双能X线吸收骨密度测量
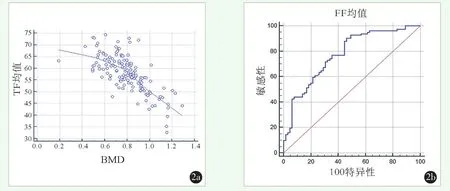
采用双能X线吸收计量(dual-energy X-ray ab⁃sorptiometry,DXA)检测BMD。DXA测量仪为HO⁃LOGIC,Horizon W(S/N303039M),前后位扫描测得的L1~4椎体BMD,结果以g/cm2表示。对于骨折的椎体予以去除。按照世界卫生组织的标准,测量椎体骨密度值(T),评定标准T值≥-1.0SD为骨量正常,-2.5 SD 1.3.3 MRI影像测量 由两名有经验的放射科医师分别应用GE AW4.6工作站对L1~4椎体的骨髓脂肪含量进行定量测定。测量时选择椎体松质骨最大区域,尽量避开骨皮质、终板、椎间盘及解剖异常区域,在图上手动勾画长方形感兴趣区(region of interest,ROI)(图1),测量脂肪分数值(fat fraction,FF),两名医师测量结果取平均值作为最终结果。 图1 腰椎MRI示意图 IDEAL-1Q序列扫描,在工作站上手动勾画椎体病变部位的最大矢状面ROI,测量椎体FF值 1a:患者,女,60岁,无椎体骨折 1b:患者女,57岁,L1椎体骨折 1c:患者,男,58岁,L5椎体骨折 骨折组与非骨折组单项因素比较见表1。骨折组年龄显著大于非骨折组(P<0.05),两组间性别构成的差异无统计学意义(P>0.05),骨折组BMI显著低于非骨折组(P<0.05),骨折组的BMD显著低于非骨折组(P<0.05)。骨折组与非骨折组的FF量从L1~4逐渐升高,骨折组的L1~4椎体FF以及平均FF均显著高于非骨折组,差异均有统计学意义(P<0.05)。单因素分析提示,高龄、低BMI、低BMD和高FF均是发生骨折的危险因素。 表1 发生与未发生骨折两组患者的单因素比较 FF与BMD的Pearson相关分析表明,FF与BMD呈显著负相关(r=-0.717,P<0.05)(图2a)。 以是否发生椎体骨折的二分变量为因变量,其他因素为自变量,行二元多因素逻辑回归分析,结果见表2。模型分类能力为76.00%,经卡方检验模型有效 (x2=53.000,P<0.05)。结果显示年龄 (OR=2.932,P<0.05)、FF(OR=1.095,P<0.05)是骨折发生的独立危险因素;而BMD(OR=0.022,P<0.05)是骨折的保护因素;BMI的差异无统计学意义(P>0.05)。 表2 是否发生骨折的多因素逻辑回归分析结果 FF判断OVCF的ROC曲线下面积为0.776,95%CI(69.9%~84.0%) ,诊断骨折的临界值为54.03,其敏感度90.24%,特异度为53.85%(图2b)。 图2 统计图 2a:Pearson检验显示FF与BMD呈显著负相关 2b:FF诊断OVCF的ROC曲线,Auc的值为0.776 骨质疏松症影响了大约40%的50岁以上女性和20%的男性[6],引起骨质丢失,增大骨折的发生率。全世界范围内,据估计每年报告的骨质疏松症相关骨折病例为900万例[7]。骨由矿化成分(即皮质和骨小梁)和非矿化成分(即骨髓)组成[8]。骨髓作为骨的非矿化成分,对骨骼和全身代谢有重要作用[9]。病理证明,FF随着骨矿化的减少而增加[6]。这是由于在骨质疏松症期间,骨髓内间充质干细胞产生成骨细胞和脂肪细胞的分化程序有利于脂肪生成和成骨细胞的形成,导致骨髓脂肪增加,骨形成减少[10]。因此,脊椎骨髓脂肪已成为诊断骨质疏松症的指标[11]。 在本研究中,骨折组的脂肪含量高于非骨折组,差异有统计学意义,这与既往研究结果基本相符,李[12]等认为OP椎体骨折组FF值比非OP椎体骨折组高。Schwartz等[13]也认为,在老年人中,较高的脊椎骨髓脂肪与普遍的脊椎骨折相关,这可能解释为骨髓中脂肪组织水平的增加削弱了骨质强度,增加了OP患者脆性骨折的风险[2]。值得注意的是,本研究骨折组与非骨折组的脂肪含量从L1至L4显示出一个逐渐增加的趋势,这一结果与之前的一份报告[14]一致,该报告评估了从L1至L4的四个椎体,显示出相同的趋势。 骨密度在临床常规中被用来确定骨质疏松相关的骨折风险[15],先前的多项研究已经证明BMD与FF存在负相关[10,11],随着椎体骨密度的增加,椎体脂肪含量是降低的,Ergen[6]及 Maciel等[16]分别发现它们之间相关性为r=-0.42,r=-0.310。本研究发现两者呈中度负相关(r=-0.717)。脂肪含量与BMD之间的负相关可归因于以下观察结果:椎间隙中丢失的骨组织和功能性骨髓会被脂肪组织替代[17],造成腰椎的骨小梁枯竭和脂肪沉积,因此,FF可被认为是BMD的重要预测因子。二元Logistic回归模型发现,年龄也是骨折的高危因素,这和Poiana等[18]的研究一致,均认为年龄是OVCF的独立危险因素,即骨髓FF的生理学含量随着年龄的增长逐渐增加,OVCF的危险也逐渐增加。骨活检显示,骨骼和功能性骨髓随着年龄增长被脂肪组织取代[19]。 本研究有一定的局限性,虽然发现骨折和非骨折患者之间有显著差异,但入选的患者总数相对较少;两名高年资医生仅根据常规MRI图像来评估椎体骨折,均未采用最经典的Genant半定量法,这对于椎体骨折的判断可能存在一定影响;因骨质疏松更常见于女性,纳入的也以女性居多,研究结论并不能描述整体人群的情况。 总之,使用IDEAL-IQ技术预测OVCF的能力将极大地受益于患者,因为此序列可以很容易地包括在标准的腰椎MRI方案中。从临床角度看,IDEAL-IQ技术有望成为无创性评估骨折风险的实用工具。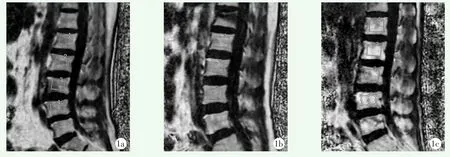
1.4 统计学方法
2 结果
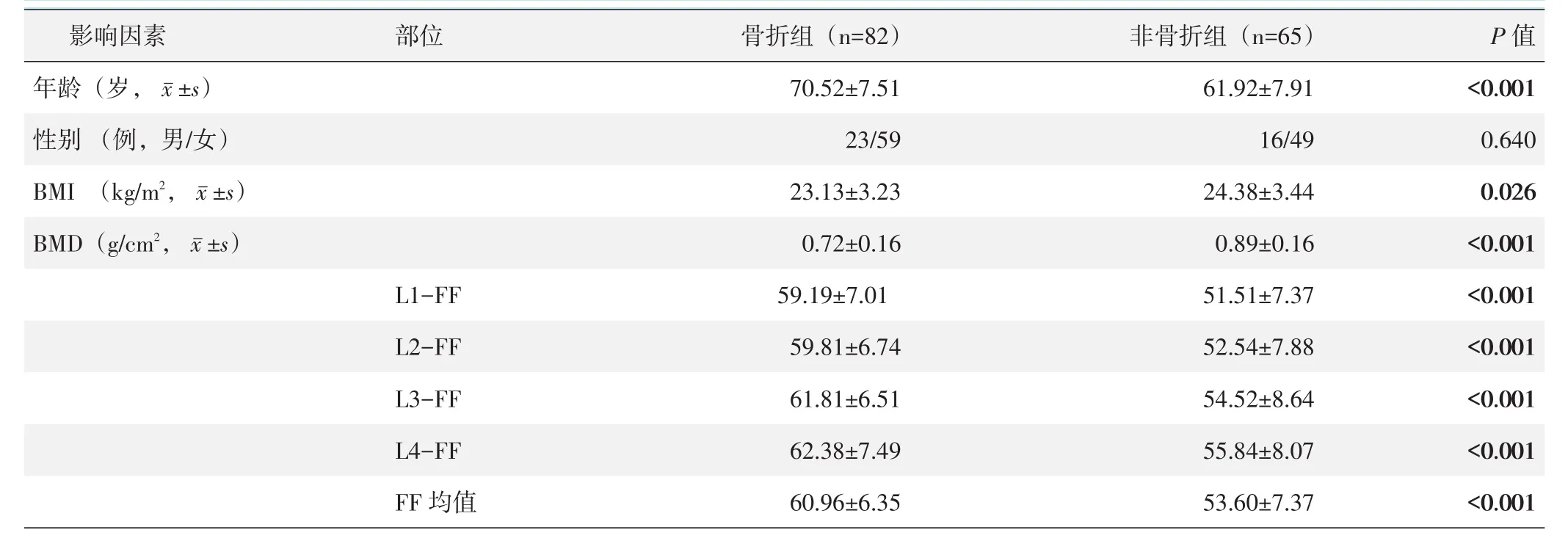
2.1 是否骨折的单项因素比较
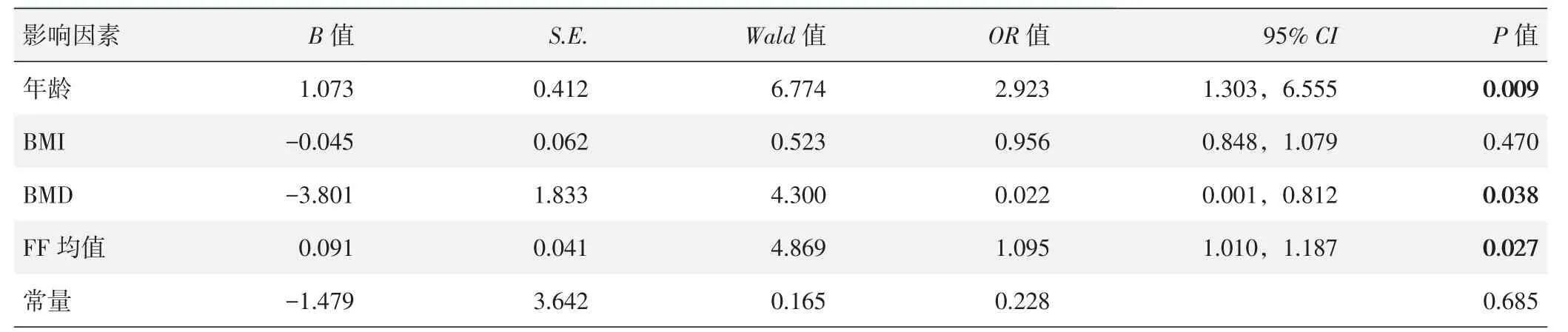
2.2 是否发生椎体骨折的逻辑回归分析
2.3 ROC曲线分析
3 讨论
