长链非编码RNA MEF2C-AS1对大鼠骨量的影响
2021-06-01彭启华王力刚赵玉驰
彭启华,王力刚,赵玉驰
(1.南华大学附属邵阳医院骨科, 湖南邵阳 422000; 2.南方科技大学盐田医院骨科,广东深圳 518000)
骨质疏松症(osteoporosis,OP)是以骨密度(bone mineral density,BMD)显著降低和骨折风险增加为特征的人类常见骨代谢疾病,且随着年龄增长发病率越明显[1]。SOST蛋白(sclerostin)是由人类17q12-21染色体上SOST基因编码的糖蛋白。肌细胞增强因子2C(myocyte enhancer factor 2C,MEF2C)是重要转录调节因子。Kramer等[2]发现,敲除小鼠MEF2C基因会导致SOST表达下降,从而使骨量和骨密度增加。因此,MEF2C-SOST转录轴的发现对于骨代谢疾病的治疗具有重要意义。慢病毒载体以其较高感染率和稳定基因表达已成为实验室常用转基因载体[3]。肌细胞增强因子2C-反义链1(myocyte enhancer factors 2C-antisense RNA1, MEF2C-AS1)是近年来新发现的lncRNA,基因位于5q14.3, 编码于MEF2C基因的反义链上,不仅可以调节正义转录本的表达水平,还可以反馈蛋白质和基因组水平。有研究发现MEF2C-AS1与股骨颈密度显著相关[4]。
课题组前期在细胞实验中,发现lncRNA MEF2C-AS1可以促进成骨细胞分化成熟,对机体骨量增加可能存在积极作用[5]。因此,本实验将构建大鼠骨质疏松动物模型,通过体内注射MEF2C-AS1慢病毒载体后检测骨组织形态计量学变化,进一步探讨MEF2C-AS1对机体骨量的影响。
1 材料与方法
1.1 实验动物
SD雌性大鼠46只,SPF级,体重180~220 g,购于湖南斯莱克景达实验动物公司;在湖南省药物安全评价研究及动物实验中心屏障环境C区饲养。动物使用得到动物实验中心伦理委员会批准,并按照《实验动物护理和使用指南》执行。
1.2 主要试剂和仪器
2%戊巴比妥钠购自德国Merck公司;青霉素购自华北制药股份有限公司;ELISA试剂盒购自上海酶联免疫生物科技公司;MEF2C、b-actin(兔抗)购自武汉爱博泰克生物技术公司;慢病毒载体MEF2C-AS1及空病毒载体购自湖南赢润生物科技有限公司; 4%多聚甲醛固定液、裂解液、Western洗涤液、转膜液均购自武汉谷歌生物科技公司;SDS-PAGE凝胶配制试剂盒购自杭州弗德生物科技有限公司;Tanon4100全自动数码凝胶成像分析系统购自上海天能公司;ME2002E型电子天平购自日本岛津公司;Micro-CT仪购自德国Bruker公司;LABOSPECT003全自动血液生化分析仪购自日本日立公司;Spectra Max i3x酶标仪购自美谷分子仪器有限公司。
1.3 动物建模
SD大鼠46只,标准饲料、分笼饲养,自由饮水,温度、湿度等饲养环境相同,保持饲养室良好通风。大鼠适应一周后,按体重随机分为假手组(SHAM)、去卵巢组(OVX),每组共23只。OVX组大鼠用2%戊巴比妥钠(0.2 ml/100 g)麻醉后,取侧卧位于动物实验手术台上,两侧背部剪毛,盖上洞巾,用碘酒、乙醇局部消毒术野皮肤,先逐层切开左侧皮肤,分离肌肉,用镊子轻轻提起脂肪团,露出与子宫角紧密相连的卵巢(呈粉红色颗粒状),组织钳夹闭卵巢下输卵管,结扎输卵管并切除卵巢,余下组织送入腹腔,缝合肌肉和皮肤。另一侧与之相同操作。SHAM组于相同部位切开皮肤、暴露卵巢,于卵巢组织周边切除相等大小脂肪组织,切口逐层缝合。术后连续3 d腹腔注射青霉素(8×104IU, 0.1 ml/只),观察大鼠皮肤切口、饮食和活动状态。
1.4 动物处理及分组
术后12周,每组各随机剖杀7只大鼠,取右侧股骨行MicroCT成像检测以验证模型。将假手术组剩下的16只大鼠随机分成2组,每组各8只,分别为假手术对照组(SHAM)、假手术+MEF2C-AS1组(SHAM+MEF2C-AS1);将去卵巢组剩下的16只大鼠随机分成2组,每组各8只,分别为去卵巢对照组(OVX)、去卵巢+MEF2C-AS1组(OVX+MEF2C-AS1)。SHAM+MEF2C-AS1组及OVX+MEF2C-AS1组取大鼠尾静脉注射MEF2C-AS1慢病毒载体(5×107TU,100 μl/只),SHAM组及OVX组同样部位注射等量空病毒载体。8周后行Western blot分析、ELISA分析和Micro-CT成像检测。
1.5 ELISA分析
大鼠剖杀时,行腹主动脉采血,离心后取上清液,将收集的血清样本立即编号后放-80℃冰箱保存,用ELISA法检测SOST蛋白水平,所有操作根据试剂盒说明进行。
1.6 Western blot分析
大鼠剖杀后取左侧股骨,加入少量液氮于研钵中研磨,加入适量裂解液提取蛋白,将样本于-80℃冰箱储存。取蛋白进行SDS-PAGE,然后转移到PVDF膜上,室温下用5%脱脂乳在TBS封闭液中封闭1 h,与相应的一抗兔抗MEF2C抗体(1∶1 000)、兔b-actin抗体(1∶2 000)4℃孵育过夜。次日,回收一抗,洗膜后,将二抗稀释于TBS中,常温孵育1 h,洗涤液洗膜3次,显影。以b-actin作为内参照,对曝光条带进行蛋白定量分析。
1.7 骨组织形态学分析
大鼠剖杀后取右侧股骨,仔细剔除周围肌肉组织,放入4%多聚甲醛固定液中,分别编号后,置4℃冰箱保存以备Micro-CT成像系统检测。造模12周及最后剖杀大鼠测量方法一致。测量指标包括:皮质骨厚度(cortical bone thickness, Ct.Th)、骨体积(bone volume, BV)、骨体积分数(bone volume/ total volume, BV/TV)、骨密度(bone mineral density, BMD)、组织密度(tissue mineral density, TMD)、骨小梁厚度(trabecular thickness, Tb.Th)、骨小梁数量(trabecular number, Tb.N)、骨小梁分离度(trabecular separation, Tb.Sp)、结构造模指数(structural modeling index, SMI)。
1.8 统计学方法

2 结 果
2.1 大鼠骨质疏松动物模型验证
如表1所示,OVX组骨密度、骨小梁数量、骨小梁厚度、骨体积、骨体积分数均低于SHAM组,差异有统计学意义(P<0.05),其中骨密度减少36.7%;而骨小梁分离度高于SHAM组,差异有统计学意义(如图1,P<0.05)。结构模型指数、组织密度、皮质骨厚度差异无统计学意义(P>0.05)。SHAM组的骨小梁厚度变薄,数量明显减少(见图2)。

表1 造模12周后,SHAM组与OVX组的骨微结构的比较




图1 SHAM组和OVX组的骨密度和骨微结构比较(BMD为骨密度,TMD为组织密度)

A. SHAM组 B. OVX组
12周后OVX组大鼠骨小梁厚度变薄、数量明显减少)
2.2 MEF2C-AS1对SOST蛋白的影响
如表2所示,各组SOST蛋白相对表达量比较,差异有统计学意义(P<0.05)。进行两两间比较显示,OVX组较SHAM组SOST蛋白相对表达量高,差异有统计学意义(P<0.05)。SHAM组与SHAM+MEF2C-AS1组比较,差异无统计学意义(P>0.05)。SHAM+MEF2C-AS1组与OVX+MEF2C-AS1组比较,差异有统计学意义(P<0.05)。OVX+MEF2C-AS1组与OVX组比较,SOST蛋白相对表达量较去卵巢对照组减少(如图3),差异有统计学意义(P<0.05)。
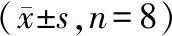
表2 各组MEP2C蛋白和SOST蛋白相对表达量比较

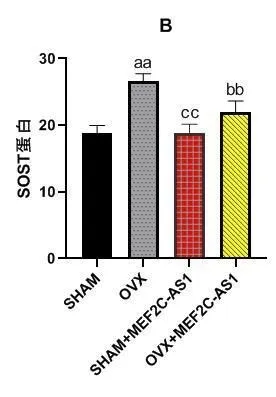
图3 各组MEF2C蛋白和SOST蛋白相对表达量比较 (aa为OVX组与SHAM组比较, P<0.05; bb为OVX组
2.3 MEF2C-AS1对MEF2C蛋白的影响
如表2所示,各组MEF2C蛋白相对表达量比较,差异有统计学意义(P<0.05)。进一步行两组间比较显示,OVX组较SHAM组MEF2C蛋白相对表达量高,差异有统计学意义(P<0.05)。SHAM组与SHAM+MEF2C-AS1组比较,差异无统计学意义(P>0.05)。SHAM+MEF2C-AS1组与OVX+MEF2C-AS1组比较,差异有统计学意义(P<0.05)。OVX+MEF2C-AS1组与OVX组比较,差异有统计学意义(P<0.05)。各组MEF2C蛋白的Western blot见图4。
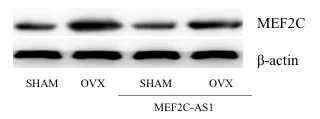
图4 各组MEF2C蛋白的Western blot

表3 各组骨微结构参数的比较
2.4 骨组织形态计量学分析
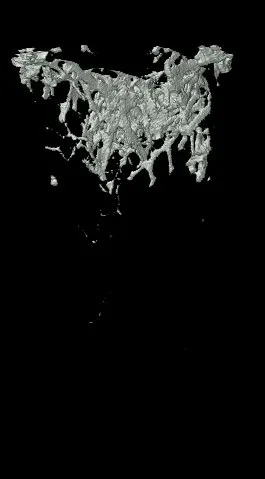
Micro-CT分析发现,OVX组大鼠Tb.Th、Tb.N均低于SHAM组(P<0.05),OVX+MEF2C-AS1组大鼠Tb.Th、Tb.N均高于OVX组,差异有统计学意义(P<0.05),结果表明MEF2C-AS1可以增加骨小梁数量,增加骨小梁之间连接。同时OVX+MEF2C-AS1组大鼠BV、Tb.Th、Tb.N、BMD、BV/TV基本恢复到SHAM组水平。而四组SMI比较,OVX组较SHAM组大鼠SMI增加,骨小梁形状从平板状变为棒状,表示去卵巢对照组骨质疏松大鼠骨小梁结构降解明显。而用MEF2C-AS1干预后,SMI减少,骨小梁结构改善,变成平板状结构,见图5,图6。

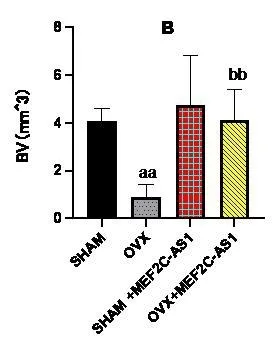

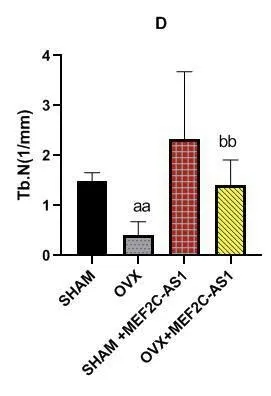
图5 各组骨微结构参数比较(aa为SHAM组与OVX组比较,P<0.05;bb为OVX组与OVX+MEF2C-AS1组比较,P<0.05)
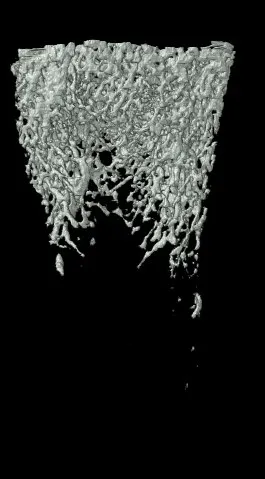

A. SHAM组
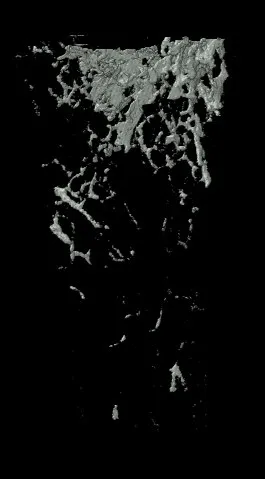
B. OVX组


C. SHAM+MEF2C-AS1
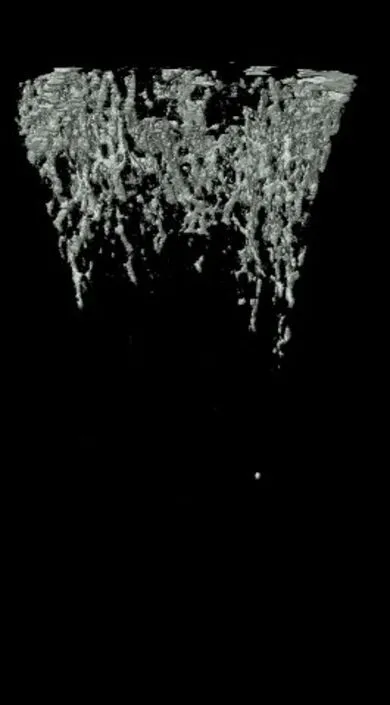

D. OVX+MEF2C-AS1
3 讨 论
去除大鼠双侧卵巢为复制骨质疏松动物模型的常用方法。但对于鼠龄、品种、时间并无统一标准,有文献报道6月龄雌性大鼠最为合适,造模时间持续6周~6月不等[6]。但国内多数认为3~6月龄雌性大鼠骨骼生长最活跃,造模持续时间3~4月多见[7]。大鼠去势以腹侧和背侧皮肤切口进行。然而,近年来对比研究发现腹部切口由于胃肠道容易受影响,且腹部与笼摩擦,易伤口感染或裂开,术后24 h大鼠死亡率高,而背侧切口,因不需要缝合肌肉、操作简便、创伤小、手术时间短、愈合快、伤口感染率低、造模安全系数高等优势而被推荐[6,8]。
本实验选用5月龄SD大鼠,并采用背侧双切口去卵巢。术后12周,发现OVX组骨密度(BMD)、骨体积(BV)、骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数量(Tb.N)较SHAM组下降,骨小梁分离度明显升高,且BMD减少约36.7%,研究表明去卵巢后BMD减少10%~20%表示造模成功[9]。因此,本研究首次证实5月龄SD大鼠通过切除双侧卵巢,造模12周也能成功复制骨质疏松模型。并通过骨形态计量学分析发现,骨小梁对雌激素变化反应比皮质骨要快。研究表明女性在围绝经期前、后几年骨量丢失最快,并以松质骨为主,约占松质骨丢失的20%~30%,这个过程称为快速骨丢失阶段,一般持续5~10年[10]。有趣的是,本实验还发现OVX对骨小梁和皮质骨之间变化矛盾结果,发现股骨松质骨骨小梁结构和BMD减少,而组织密度和皮质骨厚度却增加。有研究同样也发现相似结果,Rocabado等[11]通过去卵巢观察股骨骨组织形态学分析,发现远端松质骨和皮质骨变化不一致。分析可能与两种不同雌激素受体(ERα和ERβ)差异性表达有关[12]。
反义长链非编码RNA(anti-sense lncRNAs)是一种内源性RNA(endo-siRNA), 通过与正义链相同的转录因子竞争结合来调控正义链的转录表达,并在参与反义转录过程中导致RNA polⅡ停滞,介导附件染色质的组蛋白和DNA甲基化,从而发挥转录基因沉默作用[13]。因此,反义lncRNA参与的复杂生物学过程使学界对疾病发展和治疗有了新的认识:即反义lncRNA可以通过碱基互补配对方式与正义转录产物结合,提示如果某正义转录产物为某病致病基因产物,则可以利用该反义lncRNA通过抑制该疾病的致病基因功能,从而发挥治疗作用。在NCBI Blast比对中发现,MEF2C-AS1与MEF2C存在反向互补配对碱基序列[4], 提示lncRNA MEF2C-AS1可通过调控MEF2C基因发挥重要作用。
MEF2C是骨代谢中重要的转录调节因子。甲状旁腺激素对SOST表达的抑制是由MEF2C介导的[14],而SOST基因编码的SOST蛋白是成骨细胞骨形成的抑制剂。因此,可通过抑制SOST基因表达来刺激成骨细胞分化,从而达到促进骨合成作用。课题组在前期体外细胞实验中,通过MEF2C-AS1过表达或沉默表达及进一步行拯救实验来检测MEF2C和SOST基因及蛋白表达,发现过表达MEF2C-AS1组的MEF2C和SOST表达水平低于对照组,而沉默MEF2C-AS1表达组高于对照组;然而在拯救实验(同时过表达MEF2C-AS1和MEF2C基因)中检测到原本受抑制的SOST表达有所恢复。因此,前期实验发现MEF2C-AS1通过抑制MEF2C基因,从而抑制SOST基因和蛋白表达;并且在过表达MEF2C-AS1中检测成骨分化早期标志物碱性磷酸酶活性明显升高,表明能促进成骨细胞分化成熟[5],提示对促进机体骨量增加有积极作用。
本实验在前期细胞实验基础上进行体内实验,首先复制骨质疏松大鼠模型,通过注射MEF2C-AS1慢病毒载体后,用Western blot分析发现OVX+MEF2C-AS1组MEF2C蛋白相对表达水平较OVX组降低,这与前期细胞实验结果一致[5],进一步证实在体内MEF2C-AS1对MEF2C表达同样有抑制作用。本实验还进一步通过ELISA分析,发现OVX+MEF2C-AS1组SOST蛋白表达水平较OVX组明显降低。结合前期促进成骨细胞活化结论[5],表明在大鼠体内,MEF2C-AS1通过下调MEF2C表达,抑制SOST基因编码SOST蛋白表达,从而对成骨细胞分化起积极作用。同时本实验还发现OVX组SOST蛋白较SHAM组升高,表明去卵巢诱导雌激素缺乏使SOST蛋白表达增加。
本实验还做了骨形态计量学分析,以验证MEF2C-AS1是否有促进骨形成作用,发现OVX+MEF2C-AS1组大鼠BV、BV/TV、Tb.N、Tb.Th、BMD均高于去卵巢对照组,且BV、Tb.Th、Tb.N、BMD、BV/TV恢复假手术对照组水平,表明MEF2C-AS1可促进骨形成、增加骨体积、改善骨小梁为主的骨微结构,从而增加骨密度。同时本实验还意外发现,与空载体对照组比较,SHAM+MEF2C-AS1组和OVX+MEF2C-AS1组骨密度都有所升高,表明MEF2C-AS1可能对正常大鼠骨丢失有积极保护作用,但结果差异不明显,分析可能与干预时间短或不除外正常大鼠卵巢分泌雌激素与基因之间相互影响有关,仍需进一步研究证实。
SOST蛋白由骨细胞分泌,竞争性结合LRP5/6抑制成骨细胞中Wnt/b-catenin途径,从而抑制成骨细胞分化[15]。Romosozumab是SOST蛋白单抗隆抗体,研究表明其既能抑制SOST蛋白表达,诱导成骨细胞分化,从而促进骨形成,又能在一定程度上减少骨吸收[16]。本研究通过lncRNA MEF2C-AS1抑制SOST蛋白表达,可能促进Wnt/b-catenin信号通路表达,从而促进成骨细胞分化、成熟发挥成骨作用。因此,本研究从抑制SOST蛋白表达的LncRAN方向为骨代谢疾病中促骨形成提供新的治疗靶点。
随着研究的深入,骨质疏松症被认为是复杂性、多基因疾病。在全基因组关联研究中发现SOST中多个单核苷酸多态性(single nucleotide polymorphism,SNP)和MEF2C rs1366594基因与OP及BMD之间的关联[4,17]。有研究发现MEF2C-AS1基因上多个lncRNA SNP位点与股骨颈BMD显著相关[4],提示LncRNA MEF2C-AS1/MEF2C/SOST通路在人类骨代谢疾病中的重要性。本研究首次在体内证实lncRNA MEF2C-AS1通过下调MEF2C和SOST蛋白表达,来改善去卵巢骨质疏松大鼠骨小梁结构,促进骨形成、增加骨体积和骨密度。因此,通过研究骨损伤与人类年龄相关骨代谢疾病的基因改变,可为以骨丢失为主疾病的合成代谢治疗提供潜在基因治疗靶点。但本实验中未明确MEF2C-AS1在体内对成骨细胞的成骨能力的影响,通过何种信号途径来增加骨量的问题也仍需进一步研究证实。
