NU7026对人肝癌细胞HepG2生物学行为的影响
2021-06-01
(南华大学公共卫生学院,湖南省衡阳市 421001)
肝癌是世界上最常见的恶性肿瘤之一,2015年中国肝癌发病人数为37.0万人,发病率为26.92/10万,死亡人数32.6万,死亡率23.72/10万[1]。原发性肝癌发病隐匿,病程短,发展迅速,当前主要治疗手段有手术切除、放射治疗、药物治疗、肝移植等。但肝癌易复发、易转移,预后差,且对放化疗具有抵抗性,寻求治疗肝癌的药物具有重要意义。
原发性肝癌中最常见的肝癌组织类型是肝细胞癌[2]。本文探讨了NU7026抑制DNA-PKcs对肝癌细胞的增殖、迁移能力的影响,为治疗肝癌提供理论依据。
1 材料和方法
1.1 材料
肝癌细胞(HepG2)由军事科学医学院周平坤研究员惠赠。HepG2细胞在含10%胎牛血清(杭州四季青公司)的DMEM培养基(Gibco),37 ℃、5%CO2培养箱中培养。NU7026(LY293646,C17H15NO3)购于MCE公司,纯度为99.95%。细胞凋亡试剂盒、细胞周期试剂盒购于南京凯基公司。
1.2 CCK8实验
取处于指数生长期的 HepG2 细胞,用含 10%胎牛血清的培养液配成单个细胞悬液接种于 96 孔板中,加入适量的细胞悬液(约7 000~8 000个/孔),待细胞贴壁后,分别用5、10、15、20 μmol/L NU7026进行处理,设3个复孔,继续培养 24、48、72 h,每孔加入10 μL CCK8 溶液,孵育1 h,用酶联免疫检测仪测定 450 nm 波长处的光密度值(OD),计算细胞存活率。细胞存活率(%)=(实验组OD值-空白孔OD值)/(空白组OD值-空白孔OD值)×100%。
1.3 生长曲线实验
按2×104个/孔细胞接种于6孔细胞培养板,10 μmol/L NU7026处理细胞每组设3个复孔,每隔24 h计数1次,连续计数3天,以时间为横坐标,细胞数为纵坐标绘制生长曲线图。
1.4 克隆实验
将细胞接种于6 cm细胞培养皿,10 μmol/L NU7026处理细胞,10天后弃掉培养基,PBS洗2遍,加入固定液3 mL,固定30 min;再加入3 mL Giemsa染色30 min,最后用流水缓慢冲洗,晾干。计数含50个细胞以上的克隆数,克隆形成率(%)=克隆数/[实验组接种细胞数×(对照组克隆数/对照组接种细胞数)]×100%。
1.5 划痕实验
将细胞接种在6孔细胞培养板中,细胞贴壁后用200 μL无菌的枪头尖端在每孔相同位置做线性划痕,再用PBS轻轻冲洗2~3遍,10 μmol/L NU7026处理细胞,分别在0、24、48、72 h后于显微镜下拍照观察划痕,采用Image J 软件观察计算细胞划痕面积,面积愈合率(%)=(0 h划痕面积-培养后划痕面积)/0 h划痕面积×100%。
1.6 细胞凋亡与细胞周期试验
将细胞接种于6孔细胞培养板,10 μmol/L NU7026处理细胞,按照说明书步骤进行,1 h内用流式细胞仪检测细胞凋亡情况。取适量HepG2细胞接种于6 cm细胞培养皿中,用10 μmol/L NU7026处理0、4、8、12、24 h后收样。按照说明书步骤进行,用流式细胞仪检测细胞周期。
1.7 统计学分析
2 结 果
2.1 不同浓度NU7026对HepG2细胞活性的影响
随着NU7026浓度的增加,HepG2细胞存活率下降。与0 μmol/L组和DMSO组比较,15 μmol/L和20 μmol/L NU7026作用HepG2细胞后,细胞存活率下降(P<0.05;图1);10 μmol/L NU7026作用HepG2细胞24、48、72 h后,与DMSO组细胞存活率比较,差异有显著性(P<0.05),与0 μmol/L 组细胞存活率比较,差异无显著性(P>0.05);查阅文献[3]及根据前期研究[4],本研究中10 μmol/L NU7026对HepG2细胞没有明显的毒性作用,故选择10 μmol/L NU7026进行后续实验。将实验分为空白组、对照组(0.1%DMSO)和NU7026组(10 μmol/L NU7026)。
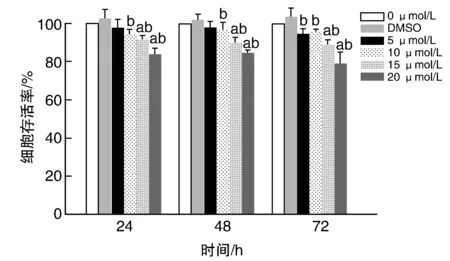
图1 CCK8检测不同浓度NU7026对HepG2细胞活性的影响a为P<0.05,与0 μmol/L组比较;b为P<0.05,与DMSO组比较。
2.2 各组HepG2细胞增殖能力比较
NU7026作用HepG2细胞72 h 后,NU7026组细胞数明显低于对照组(P<0.05;图2);NU7026组细胞克隆数少于对照组,克隆形成率明显降低(P<0.05;图2)。
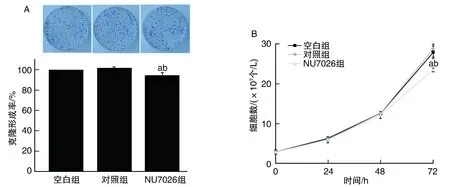
图2 各组HepG2细胞增殖能力的比较A为培养10天后克隆实验细胞分布图(Giemsa染色)和柱状图;B为细胞生长曲线图。 a为P<0.05,与空白组比较;b为P<0.05,与对照组比较。
2.3 各组HepG2细胞迁移能力
NU7026作用细胞24 h后,与对照组相比,面积愈合率无明显差异(P>0.05);NU7026作用细胞48 h后,划痕面积比对照组稍大,面积愈合率无明显差异(P>0.05);但在作用72 h后,NU7026组划痕面积大于对照组,面积愈合率明显降低(P<0.05;图3)。

图3 各组HepG2细胞迁移能力比较A为细胞划痕实验迁移(200×);B为细胞划痕愈合率折线图。a为P<0.05,与空白组比较;b为P<0.05,与对照组比较。
2.4 各组HepG2细胞的凋亡与周期
NU7026作用HepG2细胞24、48、72 h后,细胞凋亡率增加(P<0.05;图4)。随着NU7026作用时间增加,HepG2细胞凋亡率逐渐增加。NU7026作用HepG2细胞12 h后,出现了轻微的G2/M阻滞现象,但细胞周期未出现明显改变(图5)。

图4 各组HepG2细胞凋亡比较A为细胞凋亡图;B为细胞凋亡率柱状图。a为P<0.05,与空白组比较;b为P<0.05,与对照组比较。
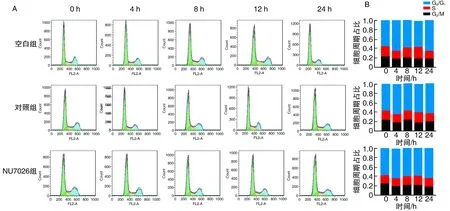
图5 各组HepG2细胞周期的比较A为流式细胞术检测细胞周期图;B为细胞周期占比图。
3 讨 论
肝癌在全球恶性肿瘤发病谱中排第六,其中中国肝癌新发病例数将近占全球发病的一半[5]。DNA-PKcs是一种相对分子质量约为470 kDa的丝氨酸/苏氨酸蛋白激酶,与共济失调毛细血管扩张症基因(Ataxia telangiectasia mutated,ATM)、RAD3相关蛋白(Ataxia telangiectasiaand Rad3-related protein,ATR)同属于磷酸酰肌醇3-激酶相关蛋白激酶(PIKK)家族。DNA-PKcs和ATM在DNA双链断裂修复中起着重要的作用,ATR主要参与DNA单链断裂修复。DNA-PKcs不仅参与淋巴细胞的V(D)J重组和类别转换重组,保护染色体末端,而且DNA-PKcs响应胰岛素信号传导,促进肝脏中碳水化合物转化为脂肪酸[6-7]。
DNA-PKcs抑制剂有渥曼青霉素、NU7441、NU7026、IC化合物等。NU7026对DNA-PKcs抑制性特异度高,能有效抑制DNA-PKcs Ser2056磷酸化[4]。本研究通过生长曲线实验和克隆实验检测细胞增殖能力,表明NU7026抑制DNA-PKcs将降低HepG2细胞增殖能力,与其他研究结果相一致。用siRNA介导肝癌HepG2细胞中DNA-PKcs沉默,细胞增殖速度减慢,且高表达DNA-PKcs可通过AKT/GSK3/c-myc信号通路调节肝癌细胞增殖[8]。同样用siDNA-PKcs转染肝癌耐药细胞Bel-7402/5-Fu后,细胞增殖能力降低,可能抑制DNA-PKcs后胸腺嘧啶合成酶(TS)表达下降,从而抑制DNA合成,细胞增殖生长变慢[9]。但也有研究表明NU7441抑制DNA-PKcs促进肺成纤维细胞中SSEA4+间充质祖细胞增殖[10]。沉默DNA-PKcs不仅抑制骨肉瘤MG-63细胞增殖,而且也抑制细胞迁移和侵袭[11]。
本文结果显示抑制DNA-PKcs能降低HepG2细胞迁移能力。有研究表明将沉默DNA-PKcs的HepG2细胞移植到裸鼠中,其肿瘤生成率明显降低[8]。DNA-PKcs通过RhoA/ROCk2通路调节基质金属蛋白酶-2和磷酸化肌球蛋白轻链 2表达,促进体内外骨肉瘤细胞迁移和侵袭[12]。也有研究发现ITGA5和SDC4基因与DNA-PKcs可能对细胞迁移侵袭运动具有互相调节作用[13]。
本研究用NU7026抑制DNA-PKcs 24、48、72 h,HepG2细胞凋亡增加,与其他研究结果一致。有研究表明沉默DNA-PKcs后,通过线粒体凋亡途径促进肝癌耐药细胞Bel-7402/5-Fu凋亡[14]。也有研究表明沉默DNA-PKcs后,有丝分裂细胞纺锤体异常,胞质分裂失败,有丝分裂延长等,最终导致细胞有丝分裂灾变而凋亡[15]。
用TDR将HeLa细胞同步化至G1期后释放,沉默DNA-PKcs的HeLa细胞在6 h出现明显的G2/M期阻滞,表明抑制DNA-PKcs会引起G2/M期阻滞[16]。用nocodazole同步化细胞后释放,抑制HeLa细胞DNA-PKcs,H3-pS10阳性细胞增加,表明细胞阻滞在有丝分裂期[17]。也有研究表明沉默MG-63细胞DNA-PKcs 48 h,细胞周期无明显改变[11]。在本研究中NU7026抑制DNA-PKcs对HepG2细胞周期无明显改变,可能是因为细胞DNA损伤不严重,DNA修复时间较短,细胞能较快地通过周期检查点,故未出现明显G2/M期阻滞。
综上所述,NU7026能抑制HepG2细胞增殖能力和迁移能力,其机制可能与促进细胞凋亡有关。
