二烯丙基二硫对CD44+人胃癌AGS细胞生长的影响
2021-06-01
(南华大学衡阳医学院 1.肿瘤研究所,2.2018级临床医学系,湖南省衡阳市 421001)
胃癌是一种常见的全球性癌症[1],人们一直在孜孜不倦地探寻其发病机理。肿瘤干细胞(cancer stem cell,CSC)假说认为,一群占比不高却具有干细胞特性的癌细胞驱动了肿瘤的发生发展,为癌症的深入阐明提供了新思路[2-6]。手术、放疗、化疗等传统的治疗策略以尽可能多清除癌细胞为目标,但肿瘤干细胞难以彻底杀死,导致癌症复发和转移,因此靶向消灭这类具有干细胞特性的胃癌细胞是胃癌治愈的切入点。
大蒜对肿瘤的有效杀灭作用主要依赖于其中所含的二烯丙基二硫(diallyl disulfide,DADS),DADS的作用效果涉及对多种恶性生物学行为的抑制,是一种很有潜力的癌症治疗候选物[7-8]。本研究首先运用免疫磁珠分选技术从AGS胃癌细胞中分选富集CD44+细胞;接着经肿瘤球形成检测其干样特性、Transwell实验评估细胞迁移与侵袭效果;最后经DADS处理,通过MTT、软琼脂培养、流式仪等观察CD44+亚群的生长与周期分布情况,初步阐明DADS抑制人胃癌干样细胞生长的能力,以便进一步理解DADS对抗胃癌的治疗潜力。
1 材料和方法
1.1 材料
二烯丙基二硫(DADS)由Fluka公司生产,纯度80%。DMEM/F12培养基(1∶1)为赛默飞世生物化学制品(北京)有限公司出品。CD44包被磁珠购于Miltenyi Biotec公司。表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)均为eBioscience公司产品。FITC标记的鼠抗人CD44抗体和FITC标记的鼠抗IgG2b同型对照抗体均购于Biolegend公司。B27培养基添加剂购于Invitrogen公司。Matrigel基质胶由美国BD公司生产,Transwell小室属于Corning产品。
1.2 细胞培养和分选
AGS细胞株来源于上海市中科院细胞库。采用磁激活细胞分选法(magneticallyactivated cell sorting,MACS)分选AGS细胞中CD44+亚群,为CD44+组;未分选细胞为AGS组。于含10%胎牛血清的DMEM培养基5%CO2、37 ℃恒温培养。
1.3 流式细胞仪检测CD44阳性率
首先用PBS洗涤未分选的AGS细胞和分选后的CD44+细胞,收集细胞,调整细胞为1×108个/L,加入FITC标记的CD44抗体,以锡箔纸包裹于4 ℃静置5 min。洗涤离心去除残液,2%多聚甲醛固定,4 ℃冰箱存放24 h,流式仪(Beckerman coulter EPICS-XL)测细胞CD44阳性率。
1.4 肿瘤球形成能力实验
成球培养基(DMEM/F12 培养基+1 mg/L EGF+1 mg/L bFGF)分别将未分选的AGS细胞和分选后的CD44+细胞配成1×105个/L单细胞悬液,96孔板中以100 μL/孔铺板,取10个复孔。培育14天后,在倒置显微镜下查看成球状态,拍照,实验重复3次。
1.5 Transwell迁移及侵袭实验
使用无血清DMEM培养基将Matrigell胶制成5倍稀释液,混匀后在Transwell上室中加40 μL/孔并于37 ℃恒温培养箱中待其凝固。将凝好的Matrigell胶以无血清DMEM培养基润洗1次,其上种2.0×104个细胞备用。在24孔板中加入含血清(10%FBS)的DMEM培养基500 μL/孔后放入小室,37 ℃恒温培养箱内24 h。取出小室,以PBS清洗、棉球拭去上室残液、干燥、固定(4%多聚甲醛)、染色(结晶紫)。镜下观察、拍照并计数统计,实验重复3次。迁移实验不用Matrigell胶,其余步骤同上。
1.6 MTT实验
取对数生长细胞,接种至96孔板,加入不同质量浓度(20、30、40、50、60 mg/L)DADS,每组6个复孔,设不加DADS的为对照组,置5%CO2、37 ℃细胞培养箱中48 h。每孔加20 μL MTT溶液,培养4 h后弃上清液,加150 μL/孔二甲基亚砜,摇匀。10 min后置酶标仪测定OD490。重复3次。抑制率(%)=(1-ODCD44+组/ODAGS组)×100%。
1.7 软琼脂集落形成实验
6孔板中铺底层琼脂凝胶(3%琼脂与含10%FBS DMEM培养基以1∶5混匀)1.5 mL/孔备用。收集CD44+细胞,不加DADS的为对照组;加入不同质量浓度(30、60 mg/L)DADS的为DADS组。将各组细胞制成1×108个/L单细胞悬液;铺上层胶(3%琼脂与含10%FBS DMEM培养基以1∶9配置,加入100 μL细胞悬液吹匀)1 mL/孔。37 ℃、5%CO2恒温培养箱中培养14天后,倒置显微镜下拍照,统计细胞成团数。实验重复3次。
1.8 流式细胞术分析细胞周期
CD44+细胞接种于两块6孔板,DADS组加入不同质量浓度(30、60 mg/L)DADS;不加DADS的为对照组。PBS、75%乙醇预冷备用。分别于DADS处理24 h、48 h后取出相应孔板收集各组细胞。75%乙醇充分悬浮细胞进行固定;离心去除残液,加50 μL RNA酶裂解30 min;加50 μL碘化丙啶(PI)混匀静置30 min(此过程需避光);用流式细胞仪计数1×104个细胞,分析细胞周期分布。
1.9 统计学处理
2 结 果
2.1 AGS细胞中分选CD44+细胞
胃癌细胞中CD44+细胞比例为2.8%,MACS分选后的CD44+比例为99.9%,表明MACS技术从AGS细胞中富集了纯度高的CD44+干样细胞(图1)。
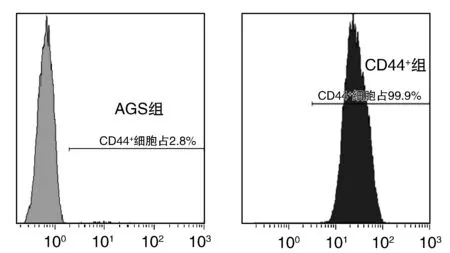
图1 流式细胞仪检测两组CD44+表达结果
2.2 CD44+细胞肿瘤球形成能力的比较
分选前后的胃癌细胞均接种于无血清培养基。CD44+细胞培养2周后可见典型的肿瘤球形成,同期未经分选的AGS细胞发生部分细胞崩解死亡,未见明显肿瘤球形成(图2)。以上结果提示CD44+细胞增殖能力明显增强。
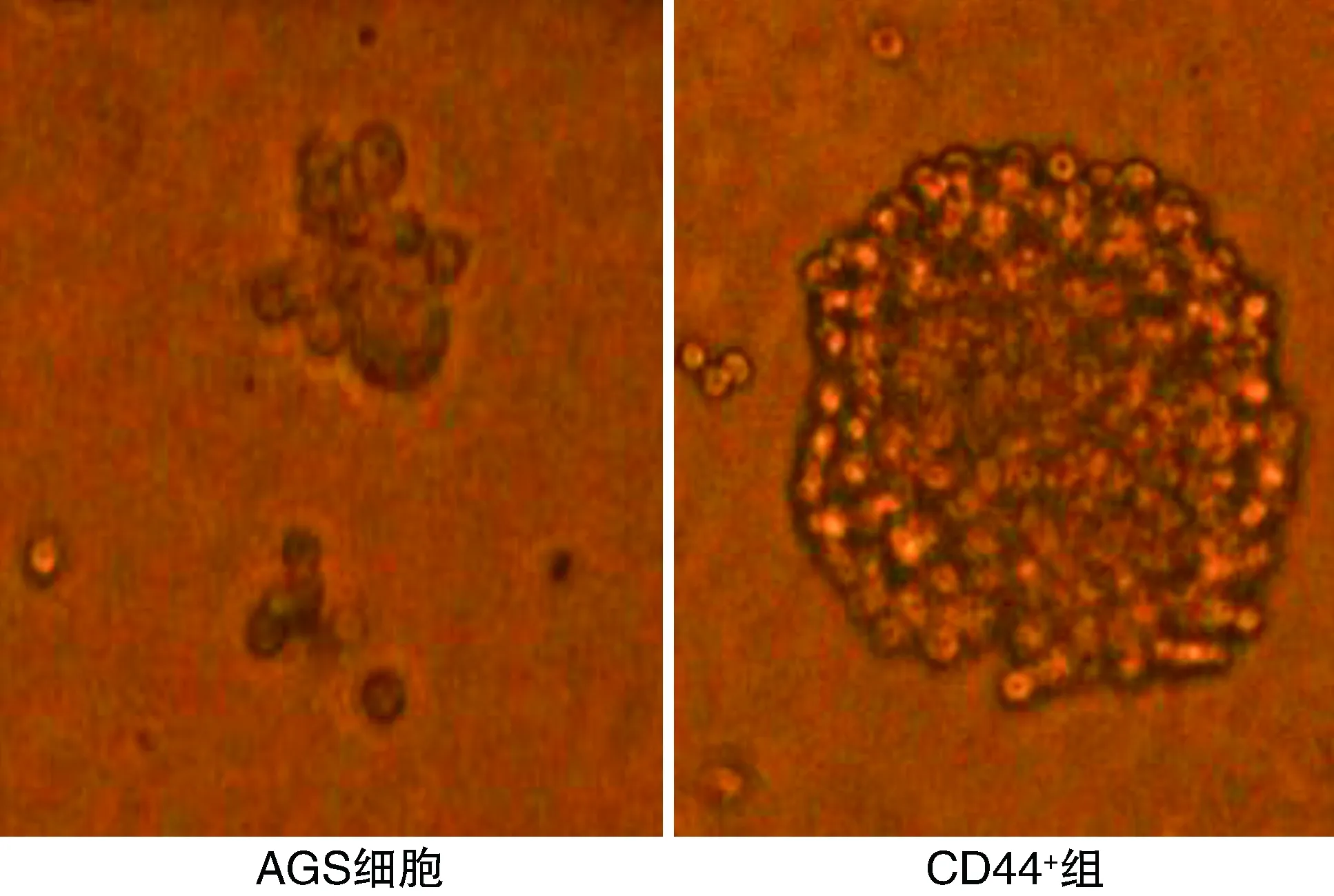
图2 AGS细胞分选前后肿瘤球形成情况的比较(100×)
2.3 CD44+细胞迁移能力的比较
与未分选的AGS细胞比较,分选后的CD44+细胞穿过微孔膜的细胞量明显增多(P<0.05;图3),说明CD44+干样细胞的迁移能力明显增强。
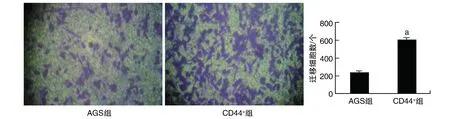
图3 两组细胞迁移能力的比较(结晶紫染色,100×)a为P<0.05,与AGS组比较。
2.4 CD44+细胞侵袭能力的比较
相较于未分选的AGS组,侵入微孔膜下层的CD44+干样细胞数明显增多(P<0.05;图4),CD44+干样细胞表现出更强的侵袭性。
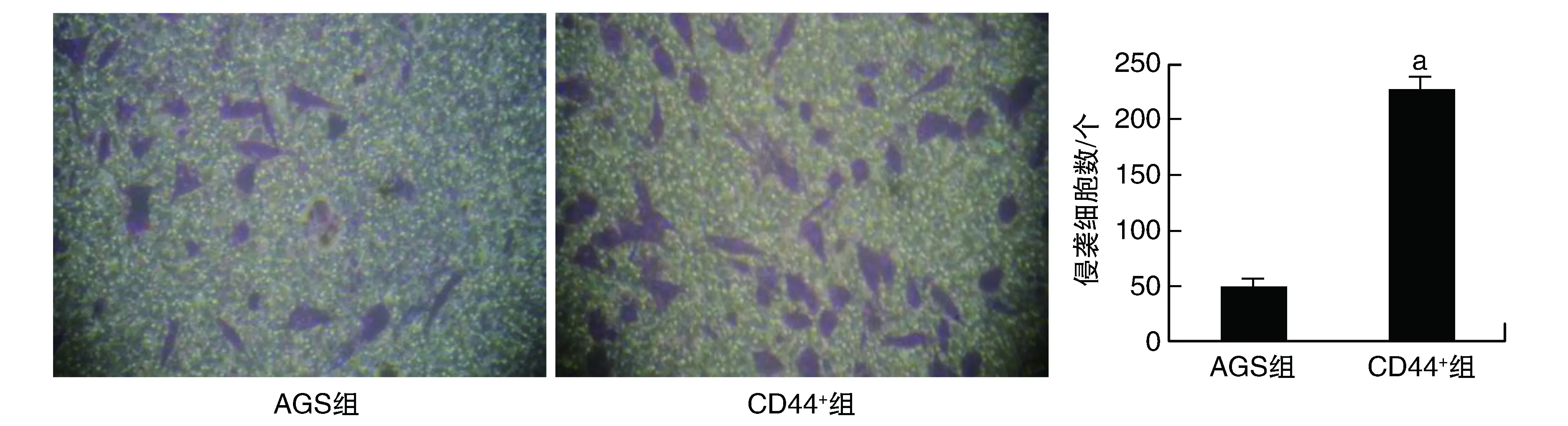
图4 两组细胞侵袭能力的比较(结晶紫染色,100×)a为P<0.05,与AGS组比较。
2.5 DADS对CD44+干样细胞增殖的影响
MTT结果显示,不同质量浓度(20、30、40、50、60 mg/L)DADS处理48 h后,CD44+细胞OD490比对照组低,且随着质量浓度增加OD490逐渐降低,抑制率明显上升(P<0.05;表1)。
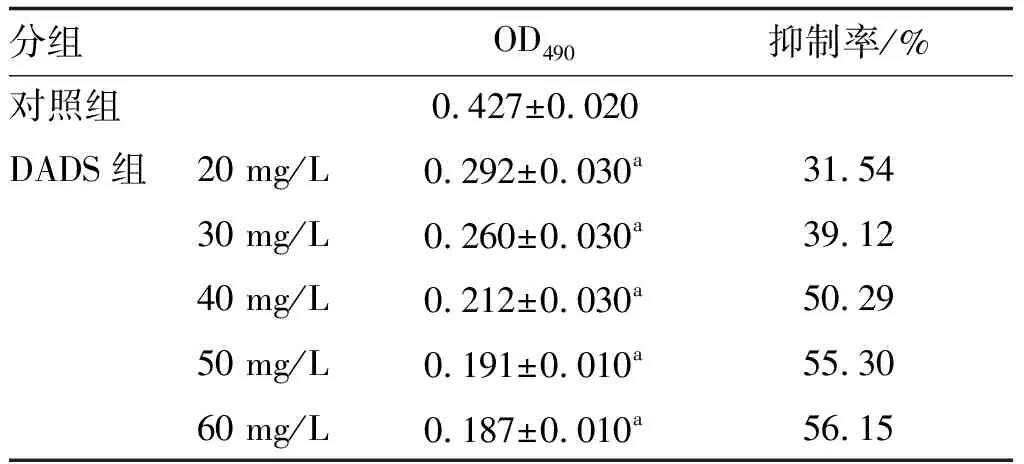
表1 不同质量浓度DADS对CD44+干样细胞增殖的影响
2.6 DADS对CD44+干样细胞集落形成能力的影响
与对照组比较,30 mg/L和60 mg/L DADS处理后集落形成数明显减少(P<0.05;表2)。在集落形态上,对照组集落大,集落数多,而30 mg/L和60 mg/L DADS处理后可见集落直径明显变小,集落数目减少(图5)。以上说明,DADS对CD44+细胞增殖具有明显抑制作用。
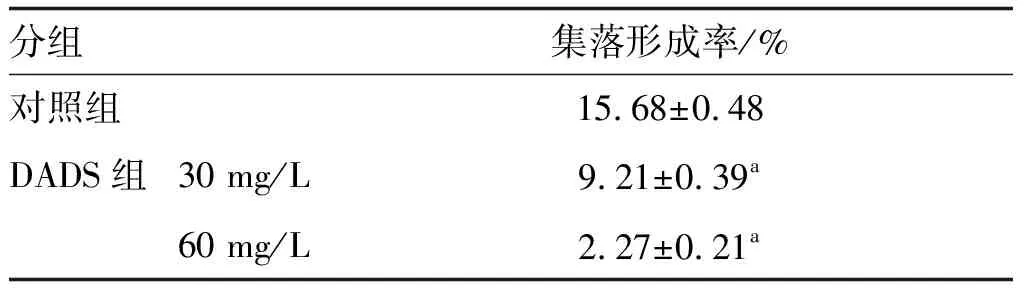
表2 不同质量浓度DADS对CD44+干样细胞集落形成的影响

图5 DADS对CD44+干样细胞集落形成能力的影响(40×)
2.7 DADS对CD44+干样细胞周期分布的影响
流式细胞术分析发现(图6和表3),DADS(30 mg/L和60 mg/L)分别加入CD44+细胞24 h和48 h后,细胞周期分布G2/M期百分比显著高于对照组(P<0.05),且同时段60 mg/L组高于30 mg/L组,同质量浓度处理48 h组高于24 h组,表明DADS处理可导致CD44+细胞发生G2/M期阻滞。
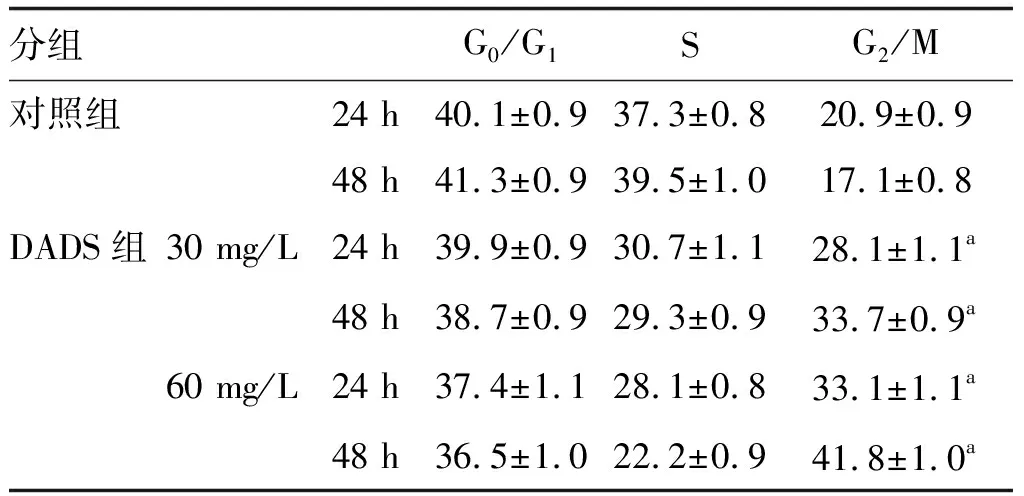
表3 不同质量浓度DADS对CD44+细胞周期的影响 单位:%
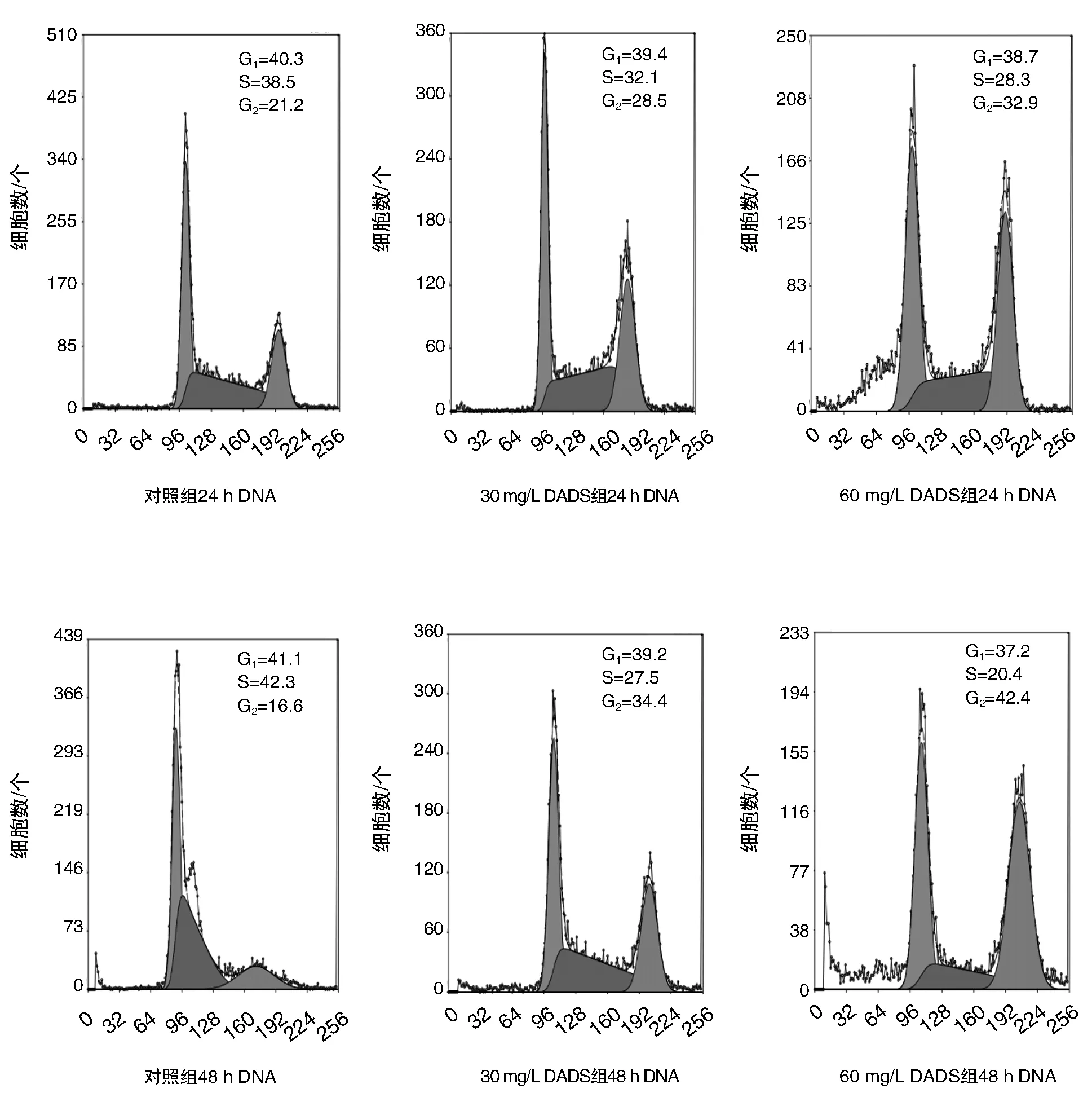
图6 DADS对CD44+细胞周期分布的影响
3 讨 论
“肿瘤干细胞学说”为恶性肿瘤的防治研究提供了新策略。上个世纪90年代有研究者首次分离出具有干细胞特点的CD34+/CD38-白血病细胞[9],后续包括胃癌在内的实体瘤中也找到了具有干细胞特性的细胞亚群[2-6,10]。据报道,CD44在多种胃癌细胞中可作为干样细胞的分选标志物[6]。
本研究发现,人胃癌AGS细胞中CD44+细胞占比2.8%。说明CD44+细胞是AGS细胞中含量较少的一个亚群,CD44包被磁珠进行免疫磁珠分选后CD44+细胞百分比提高至99.9%,提示免疫磁珠分选纯化后富集到了CD44+的胃癌干样细胞。为了证实CD44+细胞的干样特性,本研究采用了肿瘤球形成、Transwell迁移及侵袭实验进行验证。
细胞成球实验中,人胃癌AGS细胞生长缓慢,不形成肿瘤球,而分选富集的CD44+细胞持续增殖,在无血清培养条件下具有典型的球形集落,提示CD44+细胞具有很强的自我更新能力。
CD44是细胞表面一种重要的黏附分子,可参与细胞的增殖、迁移和侵袭能力调节,在恶性肿瘤进展和侵袭转移中起关键作用。研究发现来源于人胃癌SGC7901细胞的胃癌干细胞迁移侵袭能力明显增强[11]。本研究自人胃癌AGS细胞分选出的CD44+细胞也展现出了更强的迁移、侵袭能力。由此可见,人胃癌细胞CD44的表达有助于促进人胃癌细胞的恶性表型,赋予其“干样”特性。
本研究前期结果已经证实DADS可抑制人胃癌细胞恶性表型,但其对人胃癌干样细胞的作用不明确,因此本研究对此进行了探讨。结果发现,人胃癌细胞AGS在不同质量浓度DADS处理48 h后,其光密度比对照组显著下降,而抑制率明显升高,具有质量浓度依赖性。此外,30、60 mg/L DADS均可对CD44+细胞的集落形成能力产生显著抑制效应,且60 mg/L组高于30 mg/L组;与对照组比较,DADS组集落较小,且集落数目也减少。最后,本研究通过流式细胞仪分析表明,经DADS处理的细胞具有G2/M期阻滞效应。综上所述,DADS对胃癌干细胞具有明显生长抑制作用。
胃癌干细胞的来源之谜还未被彻底揭晓,有研究显示,胃肠道上皮组织处于快速自我更新状态,高分化的组织特异细胞很难发生基因突变,而干细胞维持长久的活力更易产生基因突变,因此胃成体干细胞发生基因突变可能是导致恶变的关键[12]。
本研究经免疫磁珠分选富集的CD44+细胞显示出干细胞特性,这些细胞可能驱动胃癌的发生发展。下一步需要阐明DADS作用于胃癌干细胞的作用机制,为开发靶向胃癌干细胞提供治疗策略,为DADS成为胃癌治疗候选药物提供实验依据。
