重组梅毒螺旋体黏附素在小鼠模型中的免疫原性及免疫保护性研究
2021-06-01
(1.南华大学衡阳医学院病原生物学研究所 特殊病原体防控湖南省重点实验室,湖南省衡阳市 421001;2.南岳生物制药有限公司,湖南省衡阳市 421007;3.南华大学衡阳医学院,湖南省衡阳市 421001)
梅毒是由梅毒螺旋体(Treponema pallidum,Tp)感染引起的一种性传播疾病,严重危害成人与新生儿身心健康并可增加艾滋病感染和传播的风险[1]。尽管青霉素可以有效地治疗梅毒,但梅毒发病人数在中国仍呈不断上升趋势[2]。疫苗是防控梅毒经济有效的措施,然而至今未获成功[3]。
Tp虽缺乏内毒素,也不产生明显外毒素,但具有突破神经系统和胎盘屏障的强大侵袭力[4],这与其表面黏附素密切相关[4-5]。黏附素不但可以介导对宿主细胞和(或)细胞外基质(extracellular matrix,ECM)如纤连蛋白、层粘连蛋白、纤维蛋白原等[6-8]的黏附,有些黏附素(如Tp0751)还具有裂解ECM的金属激酶活性[9],导致Tp通过循环系统或组织间隙播散。黏附素位于Tp表层,直接接触免疫系统,因此抗黏附成为研发梅毒疫苗的中心环节[3-4]。Tp0751、Tp0136和Tp0435是目前发现的重要Tp黏附素,三者在新西兰兔模型中的免疫保护性已有研究报道,但Tp0751的细胞定位和保护性具有明显争议[6,10-11];Tp0136全蛋白具有部分免疫保护性[8],但其氨基端(N端)保守区能否诱导免疫保护未见报道;Tp0435在新西兰兔体内未诱生出保护性[12]。新西兰兔是公认的梅毒疫苗模型,但目前仍缺乏公认的检测兔细胞因子的免疫试剂[13],Lu等[14]观察到Tp能在C57BL/6小鼠体内增殖和播散的实验结果为应用新的梅毒疫苗动物模型提供了依据。
本研究尝试以C57BL/6小鼠为动物模型,观察各黏附素免疫诱导小鼠的特异性体液免疫和细胞应答水平、Tp攻击后在免疫小鼠体内播散情况,为筛选梅毒疫苗侯选分子提供实验依据。
1 材料和方法
1.1 主要材料与仪器
Tp Nichols标准株、被转化重组质粒pET-30a-Tp0136N(Tp0136氨基端保守区,即第32~234位氨基酸)或pET-30a-Tp0435(Tp0435去信号肽后全长蛋白,即第23~156位氨基酸)的E.coli JM109重组表达菌、被转化pET-30a-Tp0751(Tp0751去信号肽后全长蛋白,即第24~237位氨基酸)的E.coli BL21表达菌为南华大学病原生物学研究所保存[15]。QIAamp DNA Mini Kit购自德国Qiagen公司,Talent荧光定量PCR试剂盒(SYBR Green)购自天根生化科技(北京)有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗鼠IgG购自美国Proteintech公司,Leuko Act Cktl With GolgiPlug、Cytofix/Cytoperm Soln Kit、Mouse BD Fc BlockTM、PE抗鼠CD4抗体、FITC抗鼠CD8a抗体、PerCPCy5.5抗鼠IL-4抗体、APC抗鼠IFN-γ抗体购自美国BD公司。C57BL/6小鼠购自湖南斯莱克景达实验动物有限公司。定量PCR仪(LightCycler96)购自美国Roche公司,流式细胞仪FACSCalibur购自美国BD公司。
1.2 重组蛋白的表达与纯化
以异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)诱导重组表达质粒pET-30a-Tp0136N、pET-30a-Tp0435在E.coli JM109中表达;pET-30a-Tp0751在E.coli BL21中表达;SDS-PAGE分析表达产物,镍柱纯化表达产物,纯化蛋白分装,-80 ℃保存备用。
1.3 重组蛋白免疫动物及血清采集
将5~6周龄的雄性C57BL/6小鼠40只随机分为4组(PBS对照组、rTp0751组、rTp0136N组、rTp0435组),每组10只。将蛋白与等体积弗氏佐剂混匀,以2周为间隔,按0、2、4周时间点分3次皮下注射,重组蛋白免疫剂量为每只30 μg/次。每次免疫前及末次免疫2周后采集小鼠尾静脉血,分离血清,保存于-80 ℃备用。
1.4 ELISA检测免疫血清特异性IgG抗体
分别以100 μL纯化rTp0751、rTp0136N及rTp0435(10 mg/L)包被96孔酶标板,以上述制备的各待测免疫鼠血清(1∶100稀释)(同时设阴性对照)为一抗,以HRP标记的羊抗鼠IgG(1∶10 000稀释)为二抗,四甲基联苯胺(tetramethylbenzidine,TMB)显色,酶标仪在450 nm波长下读数。
1.5 流式细胞术检测小鼠脾细胞内IFN-γ与IL-4
无菌取末次免疫2周后小鼠脾细胞(每组5只),调整细胞密度为2×104个/μL,按试剂盒使用说明用流式细胞仪检测小鼠脾细胞内干扰素-γ(interferon-γ,IFN-γ)与白细胞介素-4(interleukin-4,IL-4)含量。
1.6 Tp攻击感染与qPCR检测小鼠各组织中Tp载量
末次免疫后第3周,取来自新西兰兔睾丸的新鲜Tp,对各组小鼠(每组5只)皮下、直肠、阴茎海绵体3个部位攻击感染,每只小鼠攻击Tp总数为3×106个。攻击后6周,取小鼠心、脾、脑组织,QIAamp DNA Mini Kit提取各组织DNA。根据文献[10,16]合成Tp内鞭毛flaA与鼠β-actin基因引物,引物序列如下:flaA上游引物5′-AACGCAAACGCAATGATA AA-3′,下游引物5′-CCAGGAGTCGAACAGGAGAT AC-3′;β-actin上游引物5′-GTGACGTTGACATCCGTAAAGA-3′,下游引物5′-GCCGGACTCATCGTACT CC。按照SYBR green试剂盒说明,在20 μL反应体积(含2 μL DNA样本,10 μL 2×mix,1.2 μL的0.03 mmol/L正向和反向引物,6.8 μL双蒸水)中进行定量PCR。所有检测在LightCycle 96仪器上进行。扩增flaA和β-actin的qPCR条件如下:预变性,95 ℃孵育15 min;随后40个循环扩增,95 ℃ 10 s,58 ℃ 10 s,72 ℃ 20 s。熔解曲线分析1个循环:95 ℃ 10 s,65 ℃ 60 s,97 ℃ 1 s。线性质粒DNA从107~10拷贝数的连续10倍稀释,小鼠gDNA从150~1.17 mg/L的连续2倍稀释,分别构建flaA和β-actin的标准曲线,采用标准曲线法进行数据分析。
1.7 统计学分析
采用SPSS软件对数据进行统计学分析,每组标本均设置3个复孔,取平均值,应用T-Test检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 原核重组蛋白表达分析
SDS-PAGE结果显示,重组质粒pET-30a-Tp0751、pET-30a-Tp0136N与pET-30a-Tp0435经诱导分别表达相对分子质量约为26 kDa(可溶性)、23 kDa(包涵体形式)与17 kDa(可溶性)大小的重组蛋白(图1)。
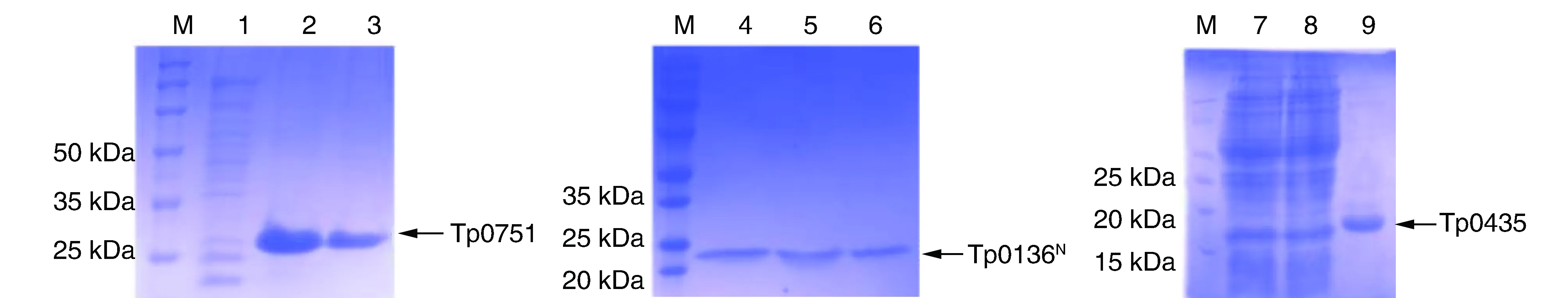
图1 各重组蛋白的SDS-PAGEM为Maker;1、7和8为全菌蛋白,其他为纯化蛋白。
2.2 血清特异性IgG抗体水平
各免疫组小鼠血清特异性IgG水平随免疫时间增加而逐渐升高,并于末次免疫后2周(即初次免疫后第6周)达到峰值,且均高于PBS对照组(P<0.01;图2)。
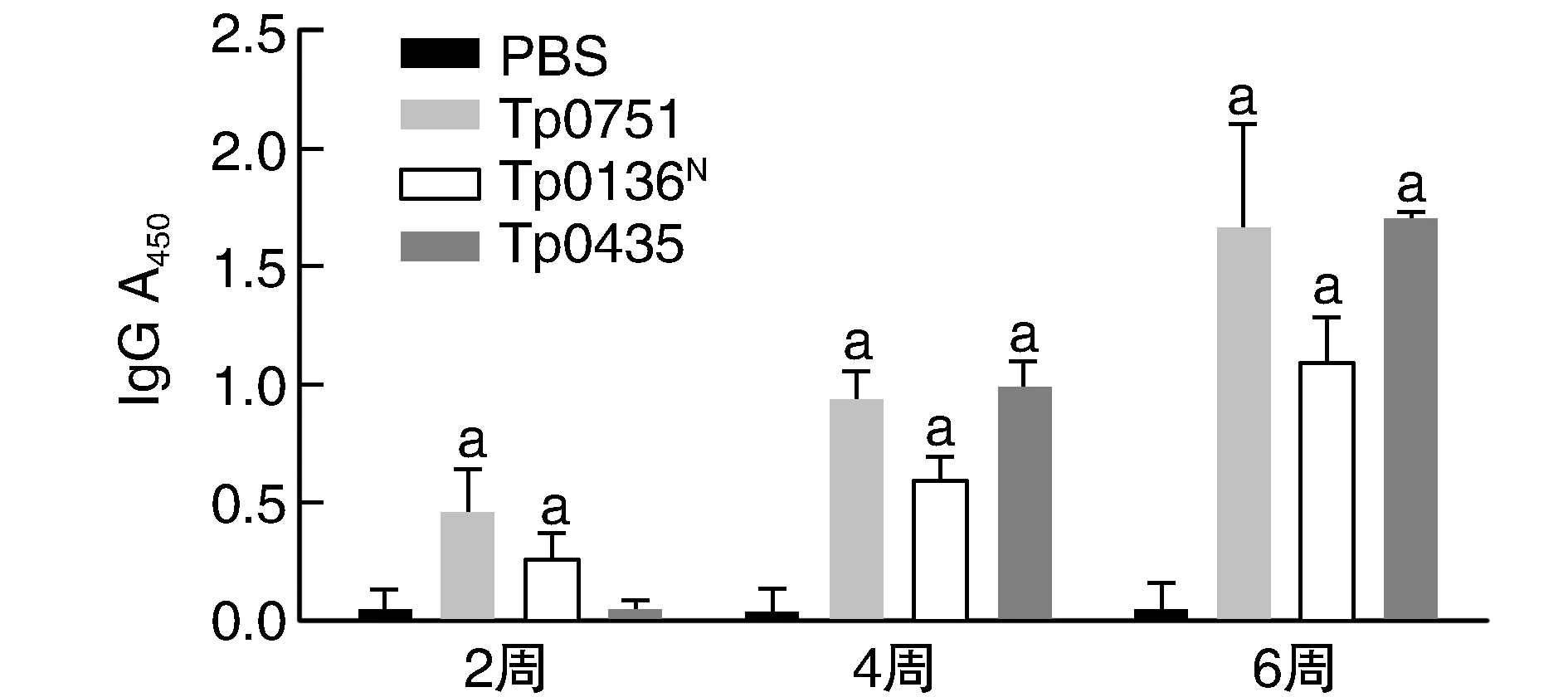
图2 各组小鼠不同时间点血清特异性IgG水平a为P<0.05,与PBS对照组比较。
2.3 免疫小鼠脾细胞内IFN-γ、IL-4水平含量
流式细胞术检测结果显示各免疫组CD4+IFN-γ+和CD8+IFN-γ+含量均高于PBS对照组(P<0.01;图3)。各组小鼠可检测到的CD4+T细胞产生IL-4水平均极低(图3)。
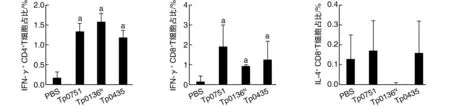
图3 各组小鼠脾细胞胞内IFN-γ及IL-4水平a为P<0.01,与PBS对照组比较。
2.4 攻击后各组小鼠不同组织内Tp载量
qPCR检测Tp攻击感染后小鼠不同组织Tp-DNA载量显示,在脾脏、心脏与脑组织中,rTp0751、rTp0136N组Tp载量明显低于PBS对照组(P<0.05),rTp0435组与PBS对照组差异无显著性(图4)。
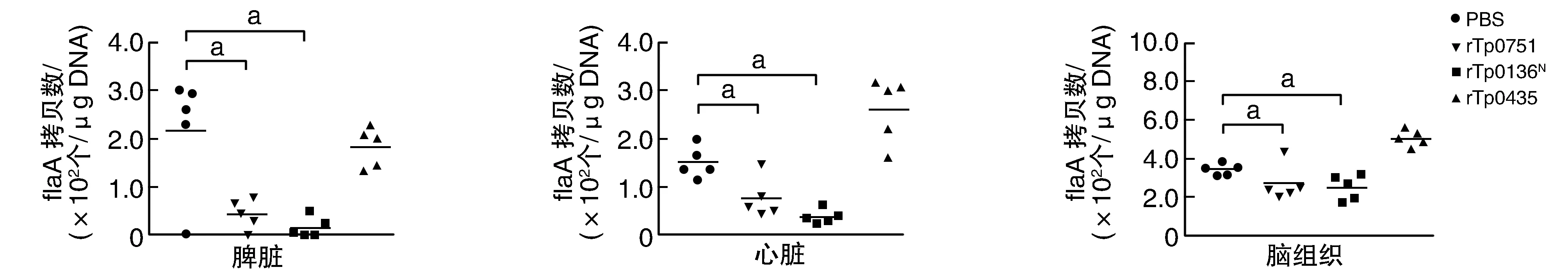
图4 Tp攻击后各组小鼠不同组织内Tp载量a为P<0.05,与PBS对照组比较。
3 讨 论
Tp不可体外人工培养和基因操作,外膜蛋白稀少,缺乏内毒素(脂多糖)和常见毒力因子,缺乏理想的疫苗动物模型是梅毒疫苗研究进展缓慢的主要限制因素[3-4,13]。Tp强大侵袭力这一特点使得抗黏附作用一直成为梅毒疫苗研究的焦点。一方面,抗黏附素抗体不但能阻止Tp对宿主细胞或ECM的黏附,使其失去组织定植能力而终止早期感染及播散,而且可调理巨噬细胞吞噬[17];另一方面,黏附素诱导的特异性细胞免疫应答,即通过黏附素特异性活化的CD4+Th1细胞、CD8+CTL等产生IFN-γ等细胞因子激活巨噬细胞,加强其吞噬杀伤Tp的活性,被认为是Tp早期感染后清除的主要机制[18]。因此,理想的梅毒疫苗应能同时诱生适应性体液免疫和细胞免疫的混合型免疫应答,以此共同清除Tp[3-4,13]。本研究显示,与PBS对照组比较,各重组蛋白免疫组小鼠的血清特异性IgG水平随免疫次数的增加逐渐升高,并于末次免疫后2周达到峰值,表明重组蛋白Tp0751、Tp0136N、Tp0435具有良好的免疫原性。小鼠末次免疫后2周,与PBS对照组相比,3种重组蛋白的免疫鼠脾细胞中的CD4+T细胞和CD8+T细胞均能产生了大量的IFN-γ,提示3种重组蛋白均可有效激发免疫小鼠产生细胞免疫应答。以上黏附素诱生的高水平的适应性体液免疫和细胞免疫应答为获得保护性免疫提供了基础。
既往评价动物体内Tp载量常用暗视野显微镜或镀银染色后镜检观察,此类方法灵敏度较低,主观因素影响大。qPCR检测动物感染后远端靶组织中Tp-DNA载量,具有灵敏、客观、定量、自动化等优点,被认为是梅毒疫苗方法学的一个重大进步[19]。本研究检测Tp攻击6周后小鼠脾脏、心脏、脑组织中Tp的DNA载量,发现Tp0751、Tp0136N小鼠免疫组的各组织中Tp载量均明显低于PBS对照组,而Tp0435免疫组与对照组无明显差异,表明Tp0751、Tp0136N免疫后能有效阻止Tp在小鼠体内播散。有关Tp0751在Tp的细胞定位和在新西兰兔模型中是否能诱导免疫保护性存在分歧,Parker等[6]认为Tp0751为Tp表层的黏附素并具有金属激酶活性,随后Lithgow等[10]观察到其免疫新西兰兔后宿主器官的Tp负荷明显减低;Luthra等[11]则认为Tp0751位于Tp的胞质,不能诱导调理素抗体产生,也不能在新西兰兔体内诱导免疫保护性。本研究结果支持Lithgow等[10]的结论,即Tp0751免疫后能延缓Tp在动物体内的播散,但具体免疫保护机制有待深入研究。Tp0136在Tp株间具有高度异质性[7],不适合以全蛋白作为疫苗分子,但其在氨基端(N端)存在一个能结合细胞纤连蛋白和血浆纤连蛋白的高度保守区,本研究中以该保守区免疫能诱导高水平抗体和细胞免疫应答,且免疫后明显延缓Tp在小鼠体内播散,这与前期报道Tp0136全长蛋白免疫后可延缓Tp攻击后新西兰兔皮损溃疡形成[7]具有一致性,表明该保守区可能为梅毒疫苗的重要候选分子。本研究中Tp0435免疫小鼠的远端组织Tp载量未明显减低,这与Parveen等[12]报道的Tp0435免疫兔的Tp攻击部位皮损直径和Tp载量未明显减低结果有一致性,再次证实了Tp0435尽管免疫原性强但不适宜作为候选疫苗分子。Tp0435属于强免疫原性的脂蛋白,最近发现其除了存在于Tp内膜,还可表达于Tp细胞表面,其未能诱导免疫保护性可能是Tp膜表面的Tp0435表达随机且有限,导致相应抗体不能有效调理吞噬细胞吞噬Tp的调理作用[12],同时也提示抗体在阻止Tp播散中具有重要作用,单独的细胞免疫不足以阻断Tp播散。
长期以来新西兰兔被公认为Tp感染和疫苗研究的动物模型,但存在诸多不足,如缺乏公认的用于ELISA或流式细胞技术检测的兔细胞因子和兔淋巴细胞表面标志分子(如CD4、CD8)的单克隆抗体的免疫检测试剂[13],难以评价免疫兔体内的细胞应答水平,且建立新西兰兔模型成本高。Tp感染鼠除不能观察到类似人类一期梅毒硬下疳的皮肤溃疡外,其他病程进展与新西兰兔相似[16],而且目前小鼠细胞因子检测试剂丰富成熟,构建小鼠模型成本低,可作为新西兰兔动物模型的补充用于研究抗原免疫原性和观察Tp体内播散[14]。
综上所述,本研究以C57BL/6小鼠为免疫和感染攻击模型,观察到Tp0751、Tp0136N与Tp0435能诱导小鼠高水平的细胞免疫与体液免疫应答,Tp0751与Tp0136N免疫小鼠后能有效阻止Tp向远端靶组织播散,具有部分免疫保护性,可望作为梅毒疫苗候选分子。
