血清脱-γ-羧基凝血酶原、磷脂酰基醇蛋白聚糖-3水平在原发性肝癌患者TACE治疗中的变化
2021-06-01许建华
许建华
(许昌医院 内五科,河南 许昌 461000)
原发性肝癌(primary hepatic carcinoma,PHC)早期症状不明显,就诊时多处于中晚期,失去外科手术治疗机会,而经肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)可阻断肿瘤血供,抑制肿瘤生长,进而加快肿瘤细胞凋亡,是作为无法行手术切除的PHC患者治疗的主要方式,但是TACE并非根治术,部分患者治疗效果不佳[1]。因而有效评估PHC患者TACE治疗效果具有必要性。目前,影像学是评估癌症治疗效果的常用方法,通过观察目标病灶的变化情况来评估疗效,但是影像学技术受到的干扰因素较多,有时疗效评估并不准确。血清肿瘤标志物对于恶性肿瘤的诊断、预后评估具有重要的作用,因而可反映近期治疗效果,血清脱-γ-羧基凝血酶原(des-γ-carboxy-prothrombin,DCP)、磷脂酰基醇蛋白聚糖-3(glypican-3,GPC3)属于肿瘤标志物,与肿瘤增殖、凋亡等相关[2]。因而,血清DCP、GPC3水平变化可能提示PHC患者TACE近期治疗效果。本研究选取120例PHC患者作为研究对象,分析血清DCP、GPC3水平在PHC患者TACE治疗中的变化。
1 资料与方法
1.1 一般资料选取2018年9月至2020年9月许昌医院收治的120例PHC患者作为研究对象,均签署知情同意书。本研究经许昌医院医学伦理委员会审批。
1.2 选取标准(1)纳入标准:①符合PHC相关诊断标准[3],且经肝组织活检、影像学等诊断确诊;②肝功能Child-Pugh A级或B级;③患者已失去手术机会或不同意行手术治疗;④美国东部肿瘤协作组(Estem cooperative oncology group,ECOG)[4]体能评分0~2分。(2)排除标准:①接受过射频消融、肝移植等治疗;②肝外转移;③弥漫性肝癌、失代偿期肝硬化;④预计生存期<6个月。
1.3 方法
1.3.1治疗方法 患者均接受TACE治疗:采用Seldinger技术穿刺患者右侧股动脉,成功后,置入5 F动脉短鞘,将导管送至腹腔干,行肝总动脉、肠系膜上动脉造影,查看患者肝内动脉情况,选择肝段或肝叶,在肝肿瘤供血动脉注入化疗药物:30~60 mg表阿霉素(OLON S.P.A,批准文号H20160268)、70~85 mg顺铂(Hospira Australia Pty Ltd,批准文号H20140372,规格 50 mL∶50 mg)及800~1 100 mg 5-氟尿嘧啶(悦康药业集团股份有限公司,国药准字H11020237,规格 10 mL∶0.25 g);根据病灶大小,将4~15 mL超液化碘油(GUERBET,批准文号H20171362,规格 10 mL)与6~10 mg丝裂霉素(瀚晖制药有限公司,国药准字H33020786,规格 2 mg)注入肿瘤血管,行栓塞治疗;完毕后行造影检查,若血流仍较快,可适量追加350~550 μm明胶海绵颗粒(杭州艾力康医药科技有限公司,国械注准20193131657)至血管呈残干样表现。术后4周进行复查判断是否需行进一步介入治疗。
1.3.2血清DCP、GPC3水平检测方法 于术前、术后4周于清晨采集患者空腹肘静脉血3 mL,3 500 r·min-1离心15 min,离心半径13.5 cm,取上清液,酶联免疫吸附法检测血清DCP、GPC3水平,试剂盒选自上海双赢生物科技有限公司。
1.3.3近期治疗效果评估方法 术后4周,患者复诊时,腹部增强CT扫描,测量所有目标病灶,参照美国RECIST标准[5]评估近期治疗效果:①完全缓解(complete remission,CR)为目标病灶均消失,且维持时间>4周;②部分缓解(partial remission,PR)为目前病灶最大直径之和缩小>30%且维持>4周;③疾病进展(progression disease,PD)为病灶最大直径之和增加≥20%或出现新病灶;④疾病稳定(stable disease,SD)为介于PR、PD之间。将CR、PR归为有效组,SD、PD归为无效组。
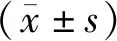
2 结果
2.1 近期治疗效果120例PHC患者TACE后,CR 20例,PR 48例,SD 34例,PD 18例,临床有效率为56.67%(68/120),无效率为43.33%(52/120)。
2.2 基线资料两组性别、年龄、Child-Pugh分级、TNM分期、肿瘤最大直径比较,差异无统计学意义(P>0.05)。见表1。

表1 不同疗效患者基线资料比较
2.3 血清DCP、GPC3水平变化术后4周,两组血清DCP、GPC3水平均降低,且无效组术前、术后4周血清DCP、GPC3水平均高于有效组,差异有统计学意义(P<0.05)。见表2。

表2 两组TACE前后血清DCP、GPC3水平变化比较
2.4 血清DCP、GPC3水平对PHC患者TACE近期治疗效果的影响将术前血清DCP、GPC3水平作为自变量,将近期治疗效果作为因变量(1=无效,0=有效),经logistic回归分析结果显示,血清DCP、GPC3水平高表达与PHC患者TACE短期治疗效果有关(P<0.05)。见表3。

表3 血清DCP、GPC3水平对PHC患者TACE近期治疗效果的影响分析结果
3 讨论
临床研究发现,TACE后可缩小PHC患者的肿瘤体积,改善临床症状,适用于无法切除的中晚期PHC[6]。但是反复TACE治疗可损伤肝功能,且肿瘤侧支循环血供情况可一定程度上影响介入治疗效果,因而PHC患者行TACE临床疗效有所差异,部分患者可能出现治疗失败或肿瘤转移、复发的风险。因此,需对PHC患者行TACE的早期疗效进行评估,以此调整临床干预方案,改善预后。
DCP是肝癌常用的筛查指标,是一种伴随肝细胞癌产生的异常凝血酶原,已经丧失了正常的凝血酶原功能,损伤的肝癌细胞γ-羧基凝血酶出现活化,导致机体维生素K代谢异常,凝血酶原前体出现过表达,导致在中晚期PHC患者中DCP呈高表达[7]。此外,大量研究[8-9]发现,通过检测DCP水平可评估肝癌患者的预后情况。因而血清DCP水平可一定程度提示PHC患者TACE近期治疗效果。GPC3可调节细胞的迁移、侵袭、黏附和肝癌细胞中的细胞骨架重组,在正常组织中无表达,但在PHC中呈高表达[10]。由此推测,借助于血清DCP、GPC3水平变化可评估PHC患者TACE治疗效果。本研究结果显示,120例PHC患者TACE后,临床无效率为43.33%,且术前、术后4周,无效组血清DCP、GPC3水平均高于有效组,初步提示了血清DCP、GPC3水平可反映PHC患者TACE近期治疗效果。分析其原因可能是,血清DCP、GPC3水平参与肝细胞的增殖、凋亡等过程,可评估恶性肿瘤的生存状态,且恶性程度越高,其表达越高,因而无效组血清DCP、GPC3水平相对较高。
经logistic回归分析结果显示,术前血清DCP、GPC3水平高表达与PHC患者TACE近期治疗效果有关,可能是由于细胞增殖可产生凝血酶原前体,过量表达可增加血清DCP水平;GPC3参与肿瘤的增殖与转移,当TACE治疗不佳时,目标病灶增殖或转移时可引起DCP、GPC3水平高表达,同时其水平的升高又将反作用导致病灶生长、转移,进而影响治疗效果。再次证实了检测血清DCP、GPC3水平有助于评估PHC患者TACE治疗效果。
综上所述,血清DCP、GPC3水平与PHC患者TACE治疗效果密切相关,血清DCP、GPC3水平越高,提示患者短期预后越差。
