卡托普利对肝纤维化大鼠肝功能及肝组织α-SMA、Ⅰ型胶原的影响*
2021-06-01王晓露曾庆鑫
王晓露,张 坤,曾庆鑫,胡 海,孙 洁
(1.内蒙古科技大学包头医学院2017级研究生,内蒙古 包头 014060;2.内蒙古科技大学包头医学院病理生理学教研室;3.内蒙古包钢医院)
肝纤维化是肝组织在多种损伤因素作用下发生细胞外基质(Extracellular matrix,ECM)的慢性增生,随着时间的推移,逐渐形成慢性肝损伤[1],如果任其发展,可导致肝功能衰竭、门静脉高压征和肝癌等。肝纤维化发生机制包括激活的肝星状细胞(hepatic stellate cell,HSC)产生ECM、氧化损伤和凋亡、炎症等。静止的HSC在受到大量生长因子和缺氧产生的促炎性介质刺激后,将转变为成纤维细胞,成纤维细胞能够产生大量Ⅰ型胶原(collagen Ⅰ)等ECM成分[2]。因此,抑制HSC的激活和collagen Ⅰ的合成是治疗肝纤维化的方向之一。
已有文献报道,血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)能够激活HSC并增加转化生长因子β(Transforming growth factor beta,TGF-β)所有亚型的mRNA表达水平,提示抑制Ang Ⅱ的合成可能成为治疗肝纤维化的一个研究切入点[3]。作为血管紧张素转换酶抑制剂(Angiotensin-converting enzyme inhibitor,ACEI)的药物卡托普利,具有抑制Ang Ⅱ合成的作用,但是其能否通过抑制HSC的活化,进而改善肝功能,目前还未见报道。
本研究对肝纤维化大鼠进行卡托普利治疗,旨在探讨卡托普利在肝纤维化的治疗中的作用及其机制,为临床上肝纤维化的治疗提供新思路。
1 对象与方法
1.1实验动物 5~6周龄SPF级SD雄性大鼠40只,体重180~220 g,由北京市斯贝福生物技术有限公司提供[SCXK(京)2016-0002]。
1.2主要试剂 四氯化碳(CCl4)购自上海柏榕生物科技有限公司,橄榄油购自北京中企华业食品有限公司,兔抗Collagen Ⅰ多克隆抗体、兔抗α-SMA多克隆抗体购自武汉博士德生物工程有限公司,谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)检测试剂盒购自武汉纯度生物科技有限公司,卡托普利购自上海华源安徽仁济制药有限公司。
1.3方法
1.3.1动物分组、肝纤维化模型复制及给药方法 采用皮下注射CCl4法复制肝纤维化动物模型:将40只SD大鼠随机分为5组,分别为对照组、模型组、卡托普利(ACEI)高、中、低剂量组,每组8只。所有大鼠可自由饮水,同时给予标准饲料喂养。除对照组外,其余各组大鼠皮下注射以橄榄油稀释的10%CCl4(5 mL/kg),对照组大鼠注射等体积的橄榄油,每周2次,共20周;从注射造模第5周开始,ACEI组分别每日给予卡托普利(20 mg/kg、15 mg/kg和10 mg/kg)灌胃治疗,同时对照组与模型组给予等量生理盐水直至造模结束。
1.3.2标本获取及保存 (1)血清标本采集:造模结束后大鼠禁食不禁水8 h,称重,麻醉后开腹,于腹主动脉取血8~10 mL,静置2 h后离心(4 000rpm,4℃)15 min后取上清液,分装后于-80 ℃冰箱冻存。(2)肝组织标本收集:完整切离肝脏,分别于各肝叶处取1块肝脏(厚约4mm),于4 %多聚甲醛固定液中固定至少24 h、常规脱水、石蜡包埋,将剩余肝脏组织切块,分装于冻存管中,于-80 ℃冰箱冻存。(3)肝组织RNA提取:采用Trizol法提取RNA,反转录为cDNA,于-80 ℃冰箱冻存。
1.3.3RT-PCR 使用TRIzol法提取肝组织总RNA,经琼脂糖凝胶电泳和Nanodrop分光光度计测定RNA的质量和浓度,A260/A280为1.18~2.10。使用RT-PCR两步法试剂盒将RNA逆转录成cDNA后进行扩增反应。将PCR反应产物分别在2 %琼脂糖凝胶上电泳,用Tanon1600凝胶成像系统对DNA条带进行吸光度扫描,与相应GAPDH吸光度的比值为Collagen Ⅰ和α-SMA的相对表达水平。实验重复3次以上,取均值。PCR引物序列见表1。

表1 RT-PCR引物序列
1.3.4免疫组化分析 取肝组织石蜡切片,采用SP法免疫组织化学染色检测Collagen Ⅰ和α-SMA蛋白表达,DAB显色后,镜下观察,视野中呈棕黄色的细胞为阳性细胞。每张切片随机选取5个视野拍照,应用图像分析软件Image-Pro-Plus6.0测定目的蛋白的平均光密度值[积分光密度(IOD SUM)/组织面积(Area SUM)],检测目的蛋白相对表达水平。

2 结果
2.1各组大鼠肝功能比较
2.1.1血清谷丙转氨酶水平比较 对照组、模型组与ACEI各治疗组5组间比较,差异有统计学意义(F=20.014,P=0.000);进一步进行两组间比较,与对照组比较,模型组血清ALT表达水平升高(P=0.000),与模型组比较,ACEI高、中、低剂量组血清ALT表达水平降低(P均为0.000)。
2.1.2血清谷草转氨酶水平比较 对照组、模型组与ACEI治疗组5组间比较,差异有统计学意义(F=47.825,P=0.000);进一步进行两组间比较,与对照组比较,模型组血清AST表达水平升高(P=0.000),与模型组比较,ACEI治疗高剂量组血清AST表达降低(P=0.000),见图1。
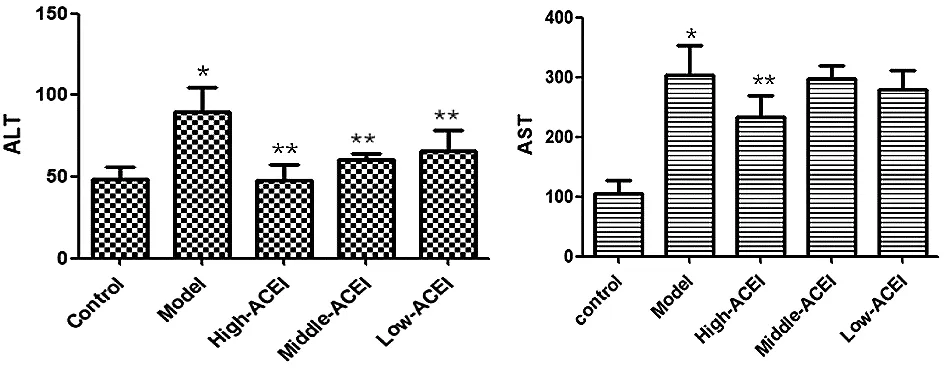
图1 各组大鼠肝功能比较
2.2各组大鼠肝组织Collagen I表达水平比较
2.2.1大鼠肝组织Collagen I mRNA的表达情况 RT-PCR结果显示,对照组、模型组与ACEI各治疗组5组间比较,差异有统计学意义(F=16.687,P=0.000);与对照组比较,模型组大鼠肝组织Collagen I mRNA 表达水平升高(P=0.000),与模型组比较,ACEI高、中、低剂量组 Collagen I mRNA水平均降低(P均为0.000),见图2。
2.2.2大鼠肝组织Collagen I蛋白的表达情况 免疫组化切片结果中,棕黄色染色颗粒为阳性,主要着色部位在细胞间隙。在对照组大鼠肝组织中,仅在中央静脉及汇管区周围可见极少量Collagen I沉积,而模型组肝组织有Collagen I大量表达,尤其在中央静脉及汇管区周围、纤维间隔周围,在ACEI治疗组,Collagen I的表达集中在中央静脉及汇管区周围。对照组、模型组与ACEI治疗组5组间比较,差异有统计学意义(F=491.464,P=0.000);进一步进行两组间比较,与对照组相比,模型组Collagen-Ⅰ表达量增加(P=0.000),与模型组相比,ACEI各治疗组Collagen Ⅰ表达量均减少(P均为0.000),见图3。
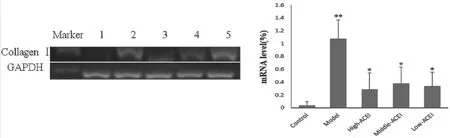
图2 大鼠肝组织 Collagen I mRNA水平比较
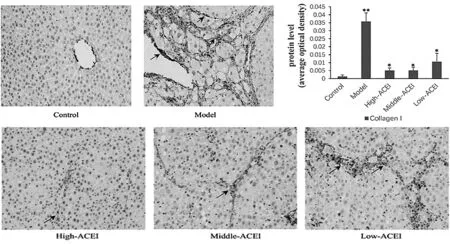
图3 大鼠肝组织 Collagen Ⅰ蛋白水平比较(×200)
2.3各组大鼠肝组织α-SMA表达水平比较
2.3.1大鼠肝组织α-SMA mRNA的表达情况 RT-PCR结果显示,对照组、模型组与ACEI各治疗组5组间α-SMA mRNA表达比较,差异有统计学意义(F=142.234,P=0.000);与对照组比较,模型组大鼠肝组织α-SMA mRNA表达水平升高(P=0.000);与模型组比较,ACEI高、中、低剂量组α-SMA mRNA水平均降低(P均为0.000),见图4。
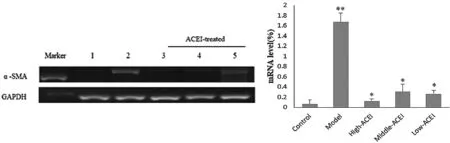
图4 大鼠肝组织α-SMA mRNA水平比较
2.3.2大鼠肝组织α-SMA蛋白的表达情况 免疫组化切片中,棕黄色染色颗粒为阳性,主要着色部位在细胞间隙。在对照组大鼠肝组织中,仅在中央静脉壁和汇管区动、静脉壁有少量表达,与对照组相比,模型组α-SMA大量表达,尤其在纤维增生的汇管区,中央静脉及汇管区周围、纤维间隔周围,在ACEI治疗组中,α-SMA的表达集中在中央静脉及汇管区周围,纤维间隔伴有少量增生。对照组、模型组与ACEI治疗组五组间比较,差异有统计学意义(F=107.382,P=0.000);进一步进行两组间比较,与对照组比较,模型组α-SMA的表达量增多(P=0.000),与模型组相比,ACEI高、中、低剂量组α-SMA表达量减少(P均为0.000),见图5。

图5 大鼠肝组织α-SMA蛋白水平比较
3 讨论
越来越多的证据表明,肾素-血管紧张素系统(Renin angiotensin system,RAS)与HSC活化、肝纤维化的发生发展密切相关。Ang Ⅱ作为RAS的效应分子,可以诱导炎症反应和激活HSC,促进肝纤维化的发生、发展[4]。然而,拮抗RAS的作用,是否对肝纤维化有治疗作用,仍需进一步研究。因此,本实验采用RAS拮抗剂(ACEI类药物)卡托普利进行治疗,旨在探讨RAS与肝纤维化的相关性,为临床上肝纤维化的治疗提供新的思路。
ALT主要分布于肝细胞胞浆,AST主要分布于肝细胞线粒体,少数分布于胞浆。由于肝细胞和血液中转氨酶水平相差较大,肝细胞内转氨酶的表达水平约为血液中的100倍,因此,临床上通常用这两种指标来反应肝细胞的损伤程度[5]。本研究结果中,模型组大鼠血清AST和ALT的表达量均升高,提示肝纤维化大鼠肝功能受损,而卡托普利治疗后有下调AST和ALT的作用,结果表明卡托普利对肝纤维化大鼠肝功能具有保护作用。
研究表明,在除去肝损伤因素后,肝纤维化是可以逆转的[6]。然而,反复肝损伤会导致肝细胞再生失败,并且肝细胞会被异源细胞(如胶原)替代。在慢性肝纤维化中,Collagen I含量明显增多,从而导致肝组织发生结构、功能紊乱[7]。因此,Collagen I的增生也可以作为判断肝纤维化发生的指标之一。本结果中,模型组大鼠肝组织Collagen I mRNA和蛋白表达量均增多,说明本实验肝纤维化动物模型复制成功,而应用卡托普利治疗后,Collagen I的mRNA和蛋白表达量减少,说明卡托普利在一定程度上能够缓解肝纤维化程度。
α-SMA通常表达于血管平滑肌细胞中,具有收缩性,有助于血管运动和收缩。在正常肝脏中,HSC呈静止状态,而肝损伤后,HSC受到多种因素刺激的作用而表现为活化状态,合成并分泌α-SMA等细胞因子增多。因此,α-SMA可作为HSC激活的标志分子,在一定程度上反映HSC的激活程度[8]。本研究发现,模型组大鼠肝组织α-SMA mRNA和蛋白水平均有升高,而ACEI治疗后α-SMA mRNA和蛋白水平有所降低,提示模型组大鼠体内有HSC的激活,而卡托普利治疗能够下调HSC的激活程度。因此,卡托普利缓解肝纤维化的机制与其抑制HSC的激活、干预α-SMA的表达有关。
综上所述,本研究结果提示,ACEI类药物卡托普利作为RAS的拮抗剂,可以保护肝纤维化大鼠的肝功能,缓解其肝纤维化程度,该作用与其抑制HSC的激活并下调肝组织Collagen I和α-SMA的表达水平有关。
