蜂蜜黄酮提取工艺优化及抑菌性分析
2021-06-01段鹏蒋玉梅李熠李霁昕冯丽丹陈永浩
段鹏,蒋玉梅,李熠,李霁昕,冯丽丹,陈永浩
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.中国农业科学院蜜蜂研究所,北京 100093)
蜂蜜是由蜜蜂蜂蜜科昆虫中华蜜蜂或意大利蜂在蜜蜂唾液腺作用下,把从蜜源植物中采集的花蜜、露蜜或甘露等在蜂巢内经一系列复杂酝酿、贮藏作用,形成具有较高糖分和营养价值的天然物质[1].目前研究表明,蜂蜜中的生物活性成分可有效清除人体内氧自由基、延缓细胞衰老、退化,降低癌症发生概率,主要包括黄酮(醇)、异黄酮(醇)、二氢黄酮(醇)、查尔酮、二氢查尔酮、橙酮等黄酮类及其衍生物构成的黄酮类物质[2].蜂蜜中黄酮种类及数量受蜜蜂品种、蜜源植物种类、产地、加工技术、贮存条件等因素影响,含量差异较大[3].液液萃取、超声波辅助提取技术、超临界萃取技术、树脂提取、固相提取技术常被用作蜂蜜中黄酮类物质的提取.黄东萍[4]以正丁醇+苯(8∶2)溶液溶解蜂蜜样品,进行蜂蜜中黄酮类化合物的提取;沈葹等[5]利用超声波辅助提取技术结合固相萃取对蜂蜜中20种黄酮类物质进行测定;韩玉谦等[6]应用超临界流体萃取技术从蜂胶中提取有效成分;Miriam[7]使用XAD-4型树脂提取蜂蜜中黄酮物质,确定了蜂蜜、树脂、洗脱体积对黄酮提取效率的影响.
蜂蜜黄酮种类及数量存在较大差异,从而导致蜂蜜的抑菌效果存在巨大差异[8-9].Kwakman等[10]研究表明,桉树蜜对幽门螺杆菌抑制能力较强可能与其具有较高的黄酮含量有关.沈敏等[11]利用琼脂井扩散法研究发现黑小蜜蜂蜂蜜对金黄色葡萄球菌、大肠杆菌和紫色杆菌具有良好抑菌效果.欧爱群等[12]采用平板菌落计数法对大肠杆菌、金黄色葡萄球菌及白色念珠菌进行抑菌试验,结果表明成熟蜂蜜具有较强的抑菌能力.王晶波等[13]采用96微孔板改良法测定18种单花蜜对金黄色葡萄球菌、沙门氏菌和大肠埃希氏菌的生长均具有抑制效果.
甘肃自然环境和气候条件独特,主要蜜源植物超过30种,被称为“西北蜜库”[14-15].目前,国内外已报道的蜂蜜研究主要集中于常见的枣花蜜、槐花蜜、南方地区的荔枝蜜、油菜蜜、枇杷蜜以及新西兰麦卢卡蜂蜜,对于西北地区特色的土蜂蜜、狼牙蜜、苜蓿蜜、枸杞蜜以及以甘肃地道中药材为蜜源植物的黄芪蜜、党参蜜等相关研究较少.研究通过单因素和响应面设计优化树脂静态吸附提取蜂蜜总黄酮的工艺参数,以优化后的参数提取并测定14种蜂蜜的总黄酮含量,同时用牛津杯法比较分析其抑菌性能,探讨其对金黄色葡萄球菌、单增李斯特氏菌、藤黄微球菌、铜绿假单胞菌的抑菌效果.结果可为蜂蜜总黄酮提取及其抑菌应用提供科学参考,为甘肃特色蜂蜜推广提供依据.
1 材料与方法
1.1 材料与试剂
蜂蜜:分别购自于甘肃省境内蜂蜜生产企业,包括山丹县2019年7月花期所产的油菜花蜜、两当县2019年4~5月花期所产的狼牙蜜、陇南市2019年6~8月花期所产的黄芪蜜,景泰县2019年6月花期所产的枣花蜜、兰州市2019年6月花期所产的枸杞花蜜、会宁县2019年6~7月花期所产的苜蓿蜜、陇南市2019年7~8月花期所产的党参蜜、天水市2019年9月花期所产的茴香蜜、天水市2019年5月花期所产的洋槐蜜、成县2019年7~9月花期所产的土蜂蜜.
试剂:硝酸铝、醋酸钾、无水乙醇,试剂均为分析纯购于中国国药;生理盐水管、营养琼脂购买于北京陆桥公司,XAD-4树脂购于杜邦中国集团有限公司.
菌种:金黄色葡萄球菌(ATCC 6538)、铜绿假单胞菌(ATCC 9027)、单增李斯特氏菌(ATCC 19115)、藤黄微球菌(ATCC 49732),购于广东省食品微生物安全工程技术开发中心.
1.2 仪器与设备
T9紫外分光光度计,北京普析通用仪器有限责任公司;分析天平,梅特勒-托利多国际贸易上海有限公司公司;培养箱,德国Memmert公司;多样品平行蒸发定量浓缩仪,瑞士BUCHI Syncore Analyst公司.
1.3 试验方法
1.3.1 蜂蜜黄酮提取单因素试验 称取土蜂蜜20 g,200 mL盐酸溶解蜂蜜为吸附液,加入XAD-4树脂,于30 ℃恒温吸附24 h,用100 mL乙醇溶液解析、旋蒸后约1 mL用纯水定容至5 mL进行黄酮含量的测定.分别以吸附液盐酸pH值、XAD-4树脂添加量和解析液乙醇浓度为试验因素,以黄酮提取量为指标进行单因素试验,优化吸附液盐酸pH值、XAD-4树脂添加量和解析液乙醇浓度.盐酸吸附液pH值单因素试验水平1.0、1.5、2.0、2.5、3.0,XAD-4树脂添加量单因素试验水平15、20、25、30、35 g,解析液乙醇浓度单因素试验水平75%、80%、85%、90%、95%.
1.3.2 响应面试验 参照韩鋆[16]试验设计进行响应面试验,在单因素试验基础上,以A(吸附液pH值)、B(树脂添加量)、C(解析液浓度)为自变量,蜂蜜黄酮含量为响应值;进行三因素三水平响应面试验设计(表1).
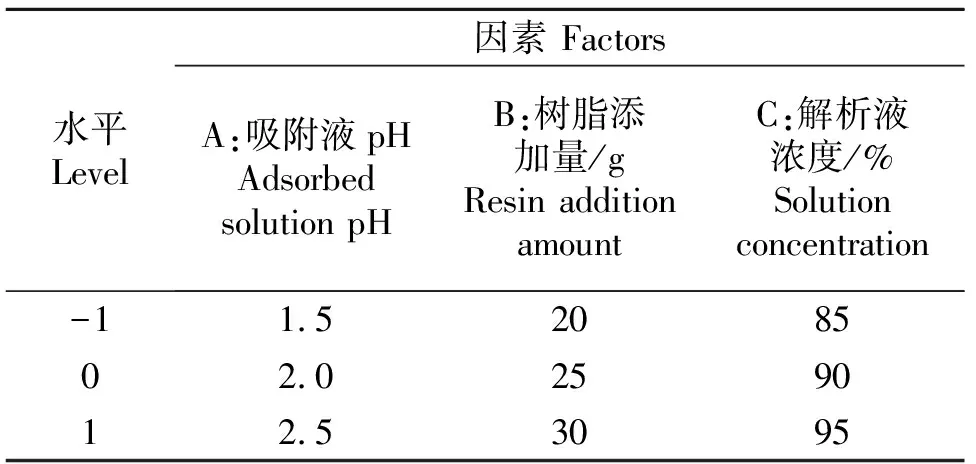
表1 试验因素及水平
1.3.3 蜂蜜黄酮提取液制备 分别称取14种试验蜂蜜各20 g,以响应面试验优化提取工艺参数,提取黄酮,35 ℃旋转蒸发浓缩至约1 mL,蒸馏水定容至5 mL,涡旋混匀,待测.
1.3.4 蜂蜜提取液黄酮测定 蜂蜜黄酮含量参照樊旭的硝酸铝-醋酸钾法[17]略作修改,进行测定.1 mL蜂蜜黄酮提取液,加无水乙醇至总体积为15 mL,依次加入100 g/L硝酸铝溶液、98 g/L醋酸钾溶液各1 mL,摇匀,加水至刻度,定容至25 mL容量瓶.摇匀,静置1 h,在420 nm处测定吸光度值.
芦丁标准品配制成浓度为1 mg/mL的标准溶液,分别吸取1、2、3、4、5 mL分别置于50 mL容量瓶中定容,按照上述方法检测绘制标准曲线.回归方程为y=0.663 018 2x,R2=0.999 2,曲线线性关系良好.
黄酮含量:x=m/(W×d),m:标准曲线上查取或由直线回归方程求得样品芦丁标准液质量浓度,单位mg;W:蜂蜜样品的质量,单位g;d:稀释比例.
1.3.5 蜂蜜黄酮提取液抑菌试验 牛津杯抑菌试验,以青霉素G标准溶液为阳性对照.比较蜂蜜黄酮提取液与青霉素标准溶液在同一致病菌平板上产生抑菌圈直径大小,确定其抑菌能力.
1.3.5.1 青霉素G标准溶液的制备 称取10.0 mg青霉素G标准品,用pH=6的磷酸盐缓冲溶液定容至100.0 mL,配置浓度为0.1 mg/mL的青霉素标准溶液.
1.3.5.2 菌悬液的制备 挑取金黄色葡萄球菌、单增李斯特氏菌、藤黄微球菌、铜绿假单胞菌的二代斜面培养物,在生物安全柜无菌条件下,由接种环挑取菌苔,伸入无菌生理盐水管,稀释制成105~108CFU/mL之间的菌悬液.
1.3.5.3 蜂蜜黄酮提取物抑菌性能测定 在生物安全二级实验室条件下,将4种菌悬液分别吸取0.5 mL注入培养皿中,每个培养皿中加入约20 mL营养琼脂,充分摇匀,使其静置凝固.用无菌镊子夹取干燥无菌的不锈钢小管(即牛津杯)正置于含菌的营养琼脂平板上,吸取0.1 mL蜂蜜黄酮提取液、阳性对照的青霉素标准溶液分别加入至牛津杯中.室温下静置5~10 min,正置平板于恒温培养箱中,于36 ℃培养24~48 h,测量抑菌圈直径并记录结果.每个试验重复3次,记录平均值.
1.4 数据处理
MyDesign-Design-Expert 8.0.6和IBM SPSS Statistics 25软件进行数据处理分析,根据Box-Behnken试验设计原理进行响应面和方差分析,采用邓肯法、LSD法对数据进行显著性分析,Origin 2018 64Bit作图.
2 结果与分析
2.1 单因素试验结果
2.1.1 吸附液pH值对蜂蜜黄酮提取量的影响 吸附液pH值会影响吸附液的极性和溶解度,从而改变了目标成分与XAD-4树脂的分子间作用力[18].随着吸附液pH值升高,蜂蜜黄酮提取量呈现先升高后降低的单峰变化(图2),当吸附液pH=2时,黄酮提取量最高,达到0.077 0 mg/g,蜂蜜黄酮类化合物在酸性条件下以分子态形式存在,形成共价结构,以氢键的方式被吸附,当酸性过强或过弱时,黄酮类物质的共价结构被破坏,与树脂的结合程度减小[19-20].根据试验结果选取吸附液pH=2为响应面试验中吸附液盐酸pH值的0水平.
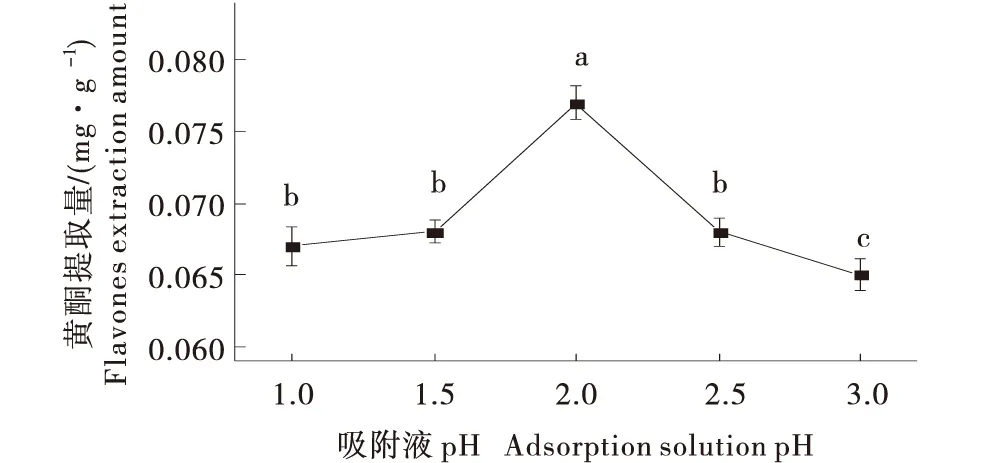
图1 吸附液pH值对蜂蜜黄酮提取量的影响Figure 1 Effect of adsorbed solution pH on the flavones extraction amount from honey
2.1.2 树脂添加量对提取蜂蜜黄酮提取量的影响 目标组分的吸附量在一定范围内会随树脂添加量增加而增加.试验选取树脂添加量范围内提取蜂蜜黄酮提取量随树脂添加量先逐渐增加后急剧下降(图3).树脂添加量接近或者稍大于蜂蜜质量时,其对黄酮的吸附率较高,添加量为25 g时达到峰值,树脂添加量继续增大,树脂之间发生竞争,导致其吸附能量下降[21].因此响应面设计选取树脂添加量25 g为XAD-4树脂添加量0水平.
2.1.3 解析液浓度对提取蜂蜜黄酮提取量的影响 黄酮类物质因带有酚羟基易溶于甲醇、乙醇、水等极性溶剂.不同浓度的乙醇溶液极性不同,其洗脱效果也不同.试验提取蜂蜜黄酮含量随解析液乙醇浓度增加呈现单峰型变化(图4),当乙醇溶液浓度为90%时,黄酮提取量最高.故响应面试验设计选取90%作为解析液乙醇浓度的0水平.
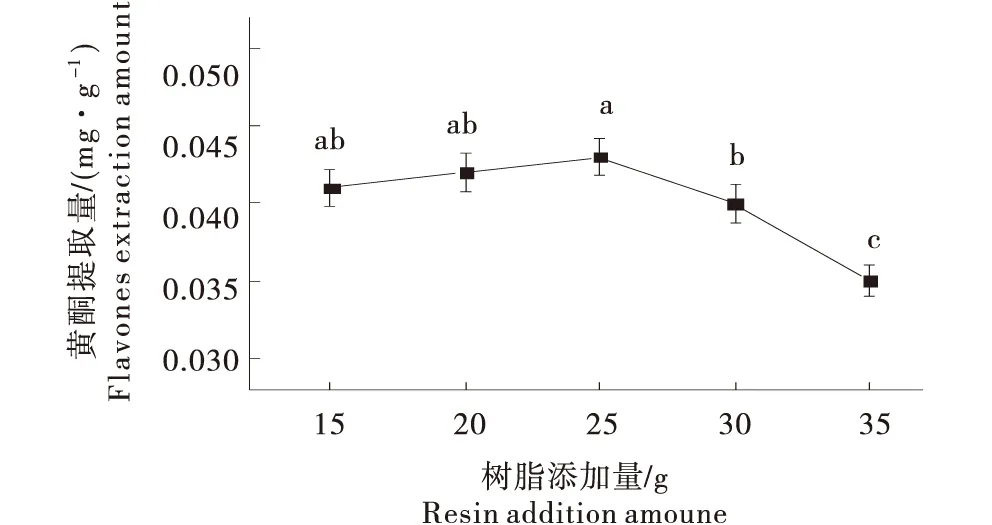
图2 树脂添加量对蜂蜜黄酮提取量的影响Figure 2 Effect of the resin addition amount on the flavones extraction amount from honey
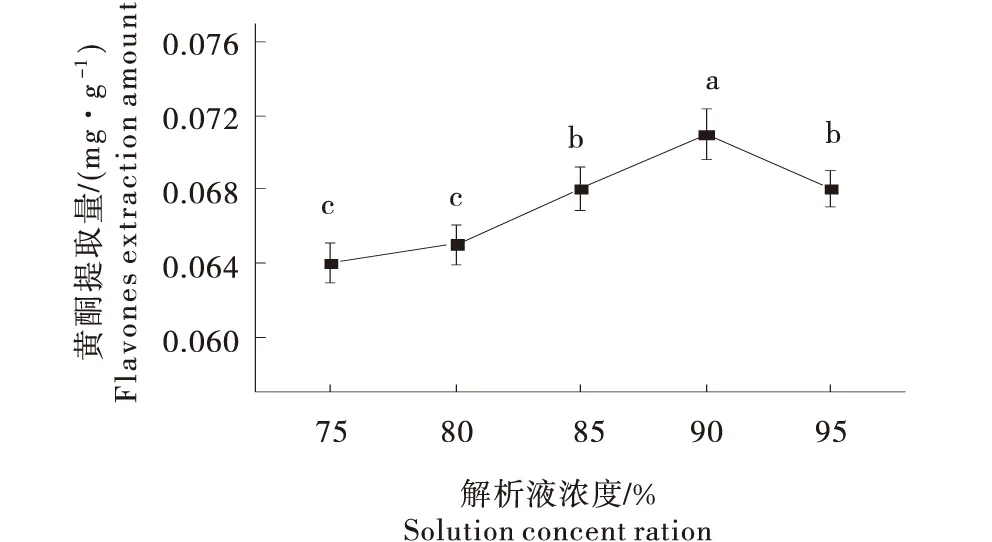
图3 解析液浓度对蜂蜜黄酮提取量的影响Figure 3 Effect of the solution concentration on the flavones extraction amount from honey
2.2 响应面试验结果

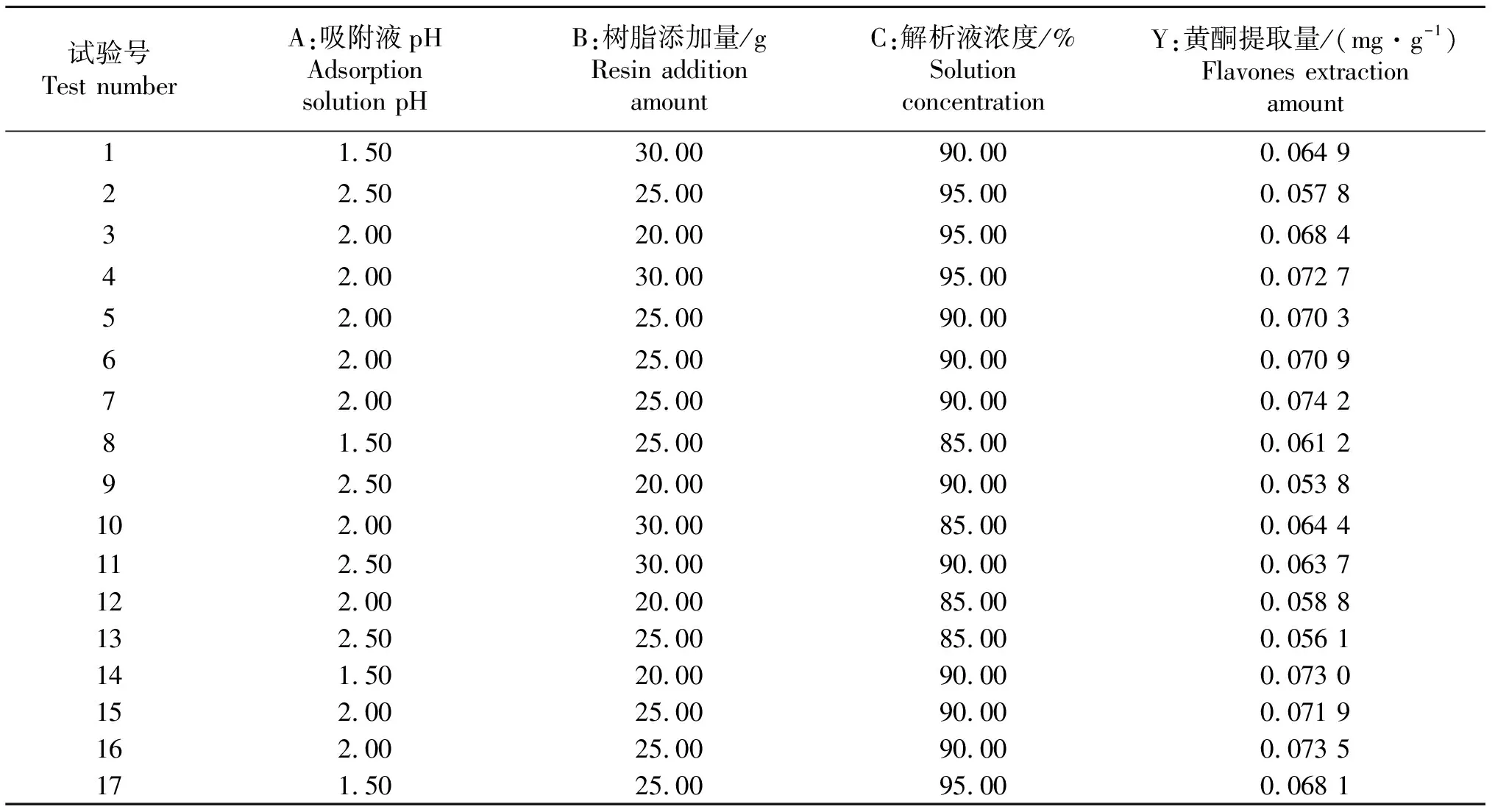
表2 响应面试验设计与结果

表3 回归模型方差分析表
2.2.2 响应面分析 响应面曲面的弧度显示各因素对提取黄酮提取量的交互影响程度.A(吸附液pH值)B(树脂添加量)曲面最陡(图4-A),交互作用最强.与表2中的方差分析结果一致.A(吸附液pH值)C(解析液乙醇浓度),B(树脂添加量)C(解析液乙醇浓度)每2个因素的交互作用对蜂蜜黄酮提取量的影响程度先高后低,响应值呈现抛物线形状的变化,因此各因素交互关系对蜂蜜黄酮提取量存在着极大值,与表3方差分析结果一致.

A:吸附液pH值与树脂添加量交互作用;B:解析液浓度与吸附液pH值交互作用;C:解析液浓度与树脂添加量交互作用.A:Interaction between the adsorption solution pH and the resin addition amount;B:Interaction between the solution concentration and the adsorption solution pH;C:Interaction between the solution concentration and the resin addition amount.图4 各因素交互作用对蜂蜜黄酮提取量的响应面图Figure 4 Response surface graph of the interaction of various factors on the flavones extraction amount from honey
2.2.3 最佳提取工艺参数的确定 Design Expert 8.0.6软件根据模型分析、计算,确定蜂蜜黄酮提取最佳工艺参数为:蜂蜜20 g,盐酸吸附液pH值为1.78,XAD-4树脂添加量为23.88 g,解析液乙醇浓度92.2%.此条件下进行验证试验,测得蜂蜜黄酮含量为0.075 0 mg/g;与理论预测值 0.073 7 mg/g基本一致,因此该试验模型能够较好地预测蜂蜜中黄酮的实际提取效果.
2.3 不同蜂蜜黄酮含量的分析比较
试验分析比较了14种甘肃蜂蜜黄酮提取量(表4),其中土蜂蜜黄酮提取量最高0.075 0 mg/g,板蓝根蜜黄酮提取量最低0.013 6 mg/g.枣花蜜、槐花蜜黄酮提取量分别为0.049 4、0.021 5 mg/g,高于薛茗阁[22]测定的淮安枣花蜜0.017 2 mg/g和槐花蜜0.011 1 mg/g,荞麦蜜为0.049 6 mg/g高于赵宏玉[23]测定的内蒙古荞麦蜜0.023 5 mg/g.蜂蜜中黄酮类化合物种类繁多,来自不同植物的花蜜含量差距较大[24].张文霁等[25]研究发现云南苕子蜜黄酮含量在0.008 4~0.022 9 mg/g之间,王笑笑等[26]研究表明浙江枣花蜜黄酮较高,含量为0.087 1 mg/g,本试验进一步证明了蜂蜜黄酮含量受蜜源植物种类、产地等多种因素影响,不同蜜源植物蜂蜜中黄酮含量存在较大差距.

表4 甘肃蜂蜜黄酮提取量
2.4 蜂蜜黄酮提取液抑菌能力的测定
14种甘肃蜂蜜的黄酮提取液对4种致病菌的抑菌性分析比较显示(表5),所有蜂蜜黄酮提取液对金黄色葡萄球菌、单增李斯特氏菌、藤黄微球菌、铜绿假单胞菌4种致病菌均具有一定的抑菌效果.与对照青霉素G的抑菌效果相比,黄芪蜂蜜黄酮提取液对金黄色葡萄球菌抑菌效果最差,为对照的39.08%,荞麦蜜黄酮提取液对金黄色葡萄球菌抑菌效果最好,为对照的60.55%;槐花蜜黄酮提取液对单增李斯特氏菌抑菌效果最差,为对照的26.30%,茴香蜜黄酮提取液对单增李斯特氏菌抑菌效果最好,为对照的37.93%;油菜蜜黄酮提取液对藤黄微球菌抑菌效果最差,为对照的30.63%,板蓝根蜜黄酮提取液对藤黄微球菌抑菌效果最好,为对照的44.74%;山花蜜黄酮提取液对铜绿假单胞菌抑菌效果最差,为对照的41.41%,油菜蜜黄酮提取液对铜绿假单胞菌抑菌效果最好,为对照的70.52%.
SPSS显著性分析显示荞麦蜜黄酮提取液对金黄色葡萄球菌,油菜蜜黄酮提取液对铜绿假单胞菌的抑菌效果具有显著性;抑菌率分别是青霉素G标准溶液的60.55%,70.52%;14种蜂蜜提取物对藤黄微球菌都具有抑菌性,之间没有显著差异.
3 讨论
已有研究表明,植物体内黄酮合成代谢复杂,存在以苯丙氨酸解氨酶催化苯丙氨酸脱氢反应的多种合成途径[27-28],表现为蜂蜜颜色越深,黄酮含量越高,抗氧化抑菌能力越强.本试验先选取颜色最深的土蜂蜜进行单因素及响应面的测定,然后再以最优条件对其余蜂蜜样品进行提取,可以较为科学地表征黄酮含量较低的蜂蜜.王殷[29]测定新疆黑蜂百花蜜黄酮含量为0.013 2 mg/g,王淳[30]测定不同蜂蜜经炼制后总黄酮种类、含量均有所增加,孙丽萍[31]测定新疆红花蜜黄酮含量均值为0.016 6 mg/g,表明14种蜂蜜提取液黄酮含量存在较大差异原因可能与蜂蜜种类、加工蜜炼工艺、产地环境多种因素有关.
相较于纸片法,牛津杯法抑菌现象直观,抑菌效果评价科学[32],此次试验选用4种常见人体致病菌进行抑菌试验,烧伤病房最常见且耐药率极高的铜绿假单胞菌[33],试验结果进一步佐证了蜂蜜可用于烫伤、烧伤的辅助治疗;试验显示甘肃土蜂蜜黄酮含量为0.075 0 mg/g,板蓝根蜜黄酮含量为0.013 6 mg/g,但在对金黄色葡萄球菌、藤黄微球菌和铜绿假单胞菌抑菌试验中,板蓝根蜜黄酮提取液的抑菌效果要优于土蜂蜜,可能是由于板蓝根蜜中除黄酮外,还含有生物碱、木质素、苯丙素、神经酰胺、有机酸、蒽醌类、芥子苷类等多种活性化合物[34].杨智颖发现紫珠中的苯丙素,对金黄色葡萄球菌、大肠杆菌和铜绿假单胞菌具有抑菌性,抗病毒效果显著[35-36],板蓝根蜂蜜提取液黄酮含量较低,但可能包含有苯丙素或其他多种抑菌物质,所以具有较好的抑菌能力.
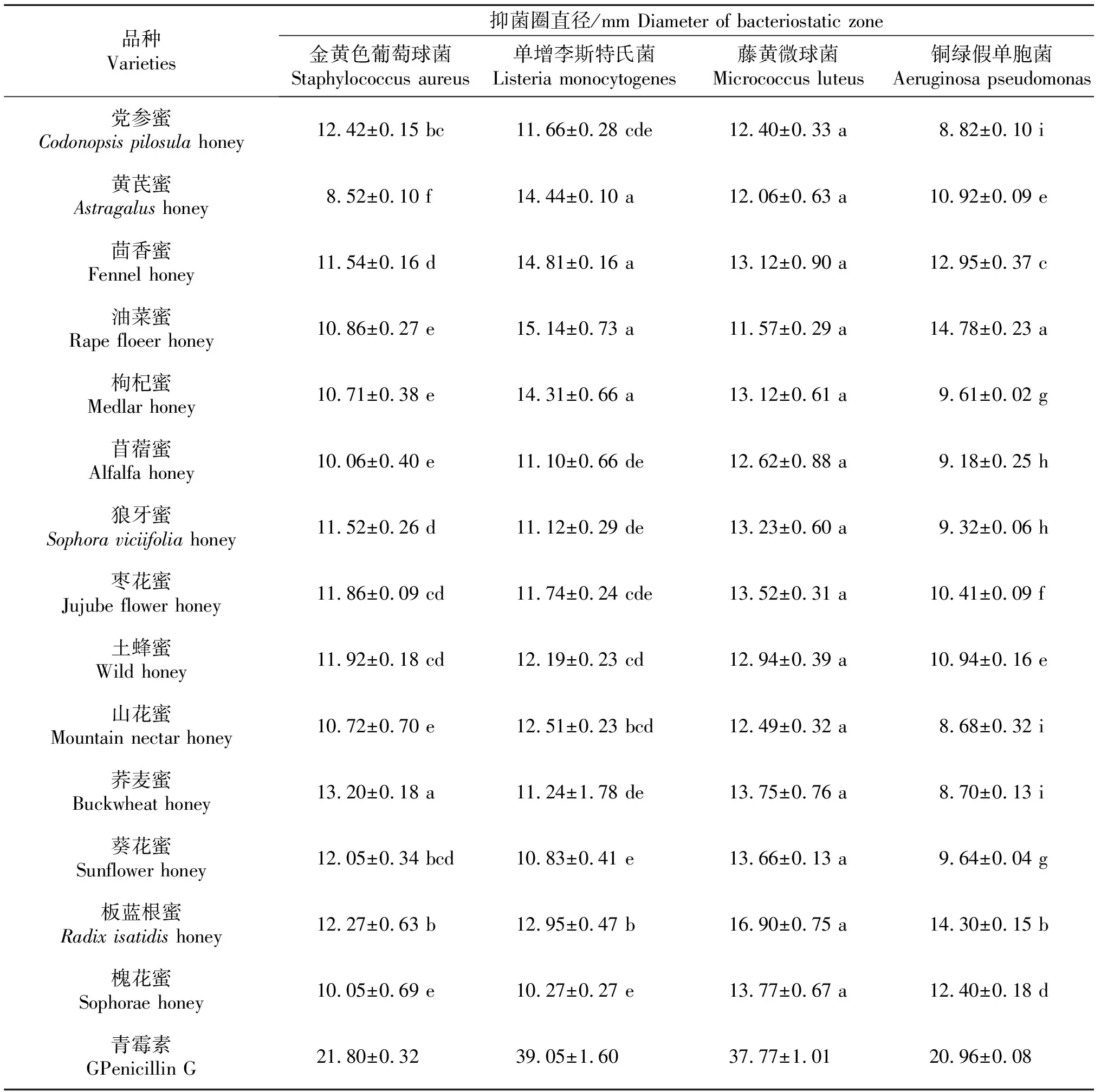
表5 甘肃蜂蜜黄酮提取液抑菌效果
4 结论
本试验在单因素的基础上,以蜂蜜中黄酮提取量为判定指标,Box-Behnken响应面优化蜂蜜黄酮提取工艺优化确定参数为:蜂蜜20 g,吸附液盐酸pH值为1.78,XAD-4树脂添加量23.88 g,解析液乙醇浓度为92.2%.在此提取工艺条件下,优化参数验证试验测定确定土蜂蜜黄酮提取量为0.075 0 mg/g;与理论预测值0.073 7 mg/g基本一致.通过比较14种蜂蜜黄酮提取量发现不同蜂蜜之间黄酮含量存在较大差距.土蜂蜜黄酮提取量最高为0.075 0 mg/g,板蓝根蜜黄酮提取量最低为0.013 6 mg/g.14种蜂蜜黄酮提取量平均值为0.036 3 mg/g.
14种蜂蜜黄酮提取物对金黄色葡萄球菌、单增李斯特氏菌、藤黄微球菌、铜绿假单胞菌均具有抑制效果,但存在差异,对藤黄微球菌的抑菌性没有显著差异.荞麦蜜、油菜蜜、板蓝根蜜和油菜蜜黄酮提取液分别对金黄色葡萄球菌、单增李斯特氏菌、藤黄微球菌、铜绿假单胞菌抑菌效果最好,分别达到了对照组青霉素G抑菌效果的60.55%、38.77%、44.74%和70.52%.蜂蜜的抑菌能力与黄酮含量高低无直接关系,蜂蜜抑菌机制仍待研究.
