交通相关PM2.5对人外周血淋巴细胞凋亡的影响
2021-05-31田家瑜郭丽丽乔果果张志红
田家瑜, 郭丽丽,2, 邱 勇,3, 乔果果,4, 张志红*
(1.山西医科大学公共卫生学院环境卫生学教研室, 太原 030001; 2.太原市疾病预防控制中心科教科, 太原 030001; 3.成都市龙泉驿区龙泉平安社区卫生服务中心, 成都 610100; 4.山西医科大学公共卫生学院教学实验中心, 太原 030001)
随着经济全球化和城市化的快速发展,大气颗粒物特别是空气动力学直径小于等于2.5 μm的颗粒物(PM2.5)污染问题越来越严重,由于其含有大量有毒有害的化学物质,对人体健康具有严重不利影响,已逐渐成为公众关注的主要环境问题。在交通发达的大中型城市,机动车尾气的大量排放是PM2.5的一个主要来源。
大量研究表明,细颗粒物污染与呼吸系统疾病、心血管疾病、癌症等多种疾病的发病率和死亡率呈正相关[1]。PM2.5每增加10 μg/m3,呼吸系统疾病和肺癌死亡的风险分别增加约6%和8%[2],心血管疾病住院人数约增加0.96%[95%置信区间(confidence internals, CI)0.1%~1.83%][3]。此外,PM2.5还可损伤免疫系统,颗粒物经肺间质进入淋巴系统,导致机体免疫功能紊乱,抵抗力降低,进而使得患感染性疾病的风险增高[4]。研究表明,脾脏是机体最大的免疫器官,PM2.5暴露可抑制脾细胞的增殖,上调凋亡基因的表达[5]。PM2.5还可对人淋巴细胞产生细胞遗传学毒性[6]。冯欲静等[7]发现PM2.5可诱导外周血淋巴细胞凋亡,可能与自由基产生并造成DNA损伤有关。前期学龄儿童的流行病学调查表明,重交通污染区儿童细胞免疫功能低于轻交通污染区,并且儿童外周血淋巴细胞早期凋亡率也高于轻污染区,表明细胞凋亡在机动车尾气抑制儿童免疫功能中起到了一定的作用[8]。尽管PM2.5可造成免疫毒性,但PM2.5尤其是交通相关PM2.5对免疫细胞的影响及具体机制尚不明确。
外周血淋巴细胞是机体进行免疫应答的一种重要细胞,当机体免疫功能降低时,淋巴细胞数量就会减少[7],淋巴细胞凋亡参与了免疫抑制的形成。因此,为进一步探讨交通相关PM2.5对免疫细胞毒性作用机制,选用人外周血淋巴细胞作为受试细胞开展实验,观察交通相关PM2.5对淋巴细胞凋亡以及细胞内凋亡相关分子的影响,探讨交通相关细颗粒物促进淋巴细胞凋亡及其可能的机制。
1 材料与方法
1.1 仪器与试剂
实验仪器TH-1000CII型智能大容量无碳刷空气总悬浮颗粒物采样器(武汉天虹), PM2.5切割器(武汉天虹),玻璃纤维滤膜(武汉天虹),酶标仪(美国Bio-Rad公司),FACS Calibur型流式细胞仪(美国BD公司)。
实验试剂:人淋巴细胞分离液(天津灏洋公司),二甲基亚砜(天津红岩公司),1640(美国Gibco),小牛血清(四季青),Annexin V-FITC/PI(上海美季公司),cAMP ELISA试剂盒(南京建成公司),β-actin一抗(鼠抗人、北京中山),β-actin二抗(羊抗鼠、北京中杉金桥),Caspase-3、CREB一抗(兔抗人、博士德),二抗(羊抗兔、博士德),ECL发光液(碧云天)。
1.2 交通相关PM2.5的采集与收集
使用大容量总悬浮颗粒物采样器于山西省太原市某污染严重的交通路口采集PM2.5。采样前,空白滤膜先于450 ℃马弗炉中烘烤1 h,冷却后置于恒温恒湿干燥器中平衡24 h,然后再称重直到恒重。采样时,采样高度为1.5 m,采样流量设置为1.05 m3/min,采样时长为11~12 h/d,持续1个月,其中滤膜每隔3~4 h更换一次。采样后,再次将滤膜置于干燥器中平衡24 h后称重。
采样后将滤膜剪成2 cm×2 cm的小块并浸入去离子水中,经超声振荡20 min×3次对PM2.5进行洗脱,后再用6层纱布过滤振荡液,使用高速冷冻离心机于4 ℃下离心滤液30 min(转速14 000 r/min),真空冷冻干燥下层悬液,低温保存。临用前取出用生理盐水配制,超声振荡15 min,混匀灭菌后即可使用。
1.3 人外周血淋巴细胞的提取
抽取志愿者外周血(已获知情同意)于肝素抗凝管中,用冷PBS倍比稀释肝素抗凝血。在一离心管中先加入等量淋巴细胞分离液,再沿管壁缓缓加入稀释后的血液,离心化,淋巴细胞停留在分离层与血浆层的交界面。吸出淋巴细胞层于另一离心管,用冷PBS再作倍比稀释,混匀离心,弃上清液,之后再用PBS洗2次,待用。
1.4 人外周血淋巴细胞的培养
向提取的外周血淋巴细胞中加入完全培养液(细胞密度为1 ×106个/mL),于37 ℃、5% CO2培养箱中培养48 h后,用不同浓度的PM2.5染毒不同时间,染毒结束后测定相关指标。根据前期细胞增殖功能测定结果[9],为保持80%的细胞增殖功能,选用0~320 μg/mL PM2.5浓度作为后续实验的染毒剂量范围。
1.5 人外周血淋巴细胞早期凋亡和坏死的测定
提取淋巴细胞于完全培养液37 ℃、5% CO2培养48 h后,用0(生理盐水)、50、100、200 μg/mL浓度的PM2.5染毒细胞24 h和48 h。PBS洗涤收集的淋巴细胞1 500 r/min离心5 min两次,分别加入Binding Buffer 500 μL悬浮细胞,Annexin-FITC 5 μL避光反应30 min,Propidium Iodide(PI) 10 μL避光反应10 min,随后全部样品立即用流式细胞仪检测。上机测定时绿色荧光通过FITC通道检测,红色荧光通过PI通道检测(Ex=488 nm,Em=530 nm)。
1.6 Caspase-3和CREB蛋白表达的测定
提取的淋巴细胞于完全培养液37 ℃、5% CO2培养48 h后,用0(生理盐水)、20、80、320 μg/mL浓度的PM2.5染毒24、48和72 h,收集淋巴细胞。先提取细胞总蛋白,并用BCA试剂盒对蛋白含量进行测定,蛋白印迹法检测人外周血淋巴细胞中Caspase-3和CREB的表达情况,随后用Image J软件对目的条带和内参条带进行测定,对各组目的和内参条带的比值进行比较分析。
1.7 细胞内cAMP含量的测定
用0、20、80、320 μg/mL浓度的PM2.5染毒培养24、48、72 h后收集淋巴细胞。细胞内cAMP的浓度根据ELISA试剂盒说明书进行测定,标准曲线法计算各组cAMP含量。
1.8 统计学方法

2 结果
2.1 PM2.5对人外周血淋巴细胞早期凋亡和坏死的影响
如表1所示,不同剂量的PM2.5染毒人外周血淋巴细胞24 h和48 h后,细胞均出现了早期凋亡和坏死的情况,并且有一定的剂量-效应关系,各剂量组与生理盐水组相比,差异具有统计学意义(P<0.01)。此外,早期凋亡的发生还具有一定的时间-效应关系。
2.2 PM2.5染毒人外周血淋巴细胞Caspase-3蛋白的表达
如图1所示,PM2.5染毒细胞24、48、72 h后,各剂量组Caspase-3蛋白表达水平均高于对照组,除80 μg/mL PM2.5染毒72 h外,差异均具有统计学意义(F24 h=26 250.228,P<0.001;F48 h=3 867.136,P<0.001;F72 h=701.278,P<0.001)。并且0、20、320 μg/mL浓度组随着细胞培养时间的延长,Caspase-3蛋白表达水平增高。
2.3 细胞内cAMP含量的变化
如表2所示,320 μg/mL PM2.5染毒细胞24、48、72 h后,细胞内cAMP含量均比生理盐水组升高,差异具有统计学意义(P<0.01)。且各剂量组细胞内cAMP含量在48 h最高。
表1 PM2.5对人外周血淋巴细胞早期凋亡和坏死的影响Table 1 Effects of PM2.5 on early apoptosis and necrosis of human peripheral blood
表2 PM2.5染毒人外周血淋巴细胞24 h、48 h和72 h细胞内cAMP含量的变化Table 2 Changes of cAMP content after human peripheral blood lymphocytes were exposed to PM2.5 for 24 h, 48 h and 72 h
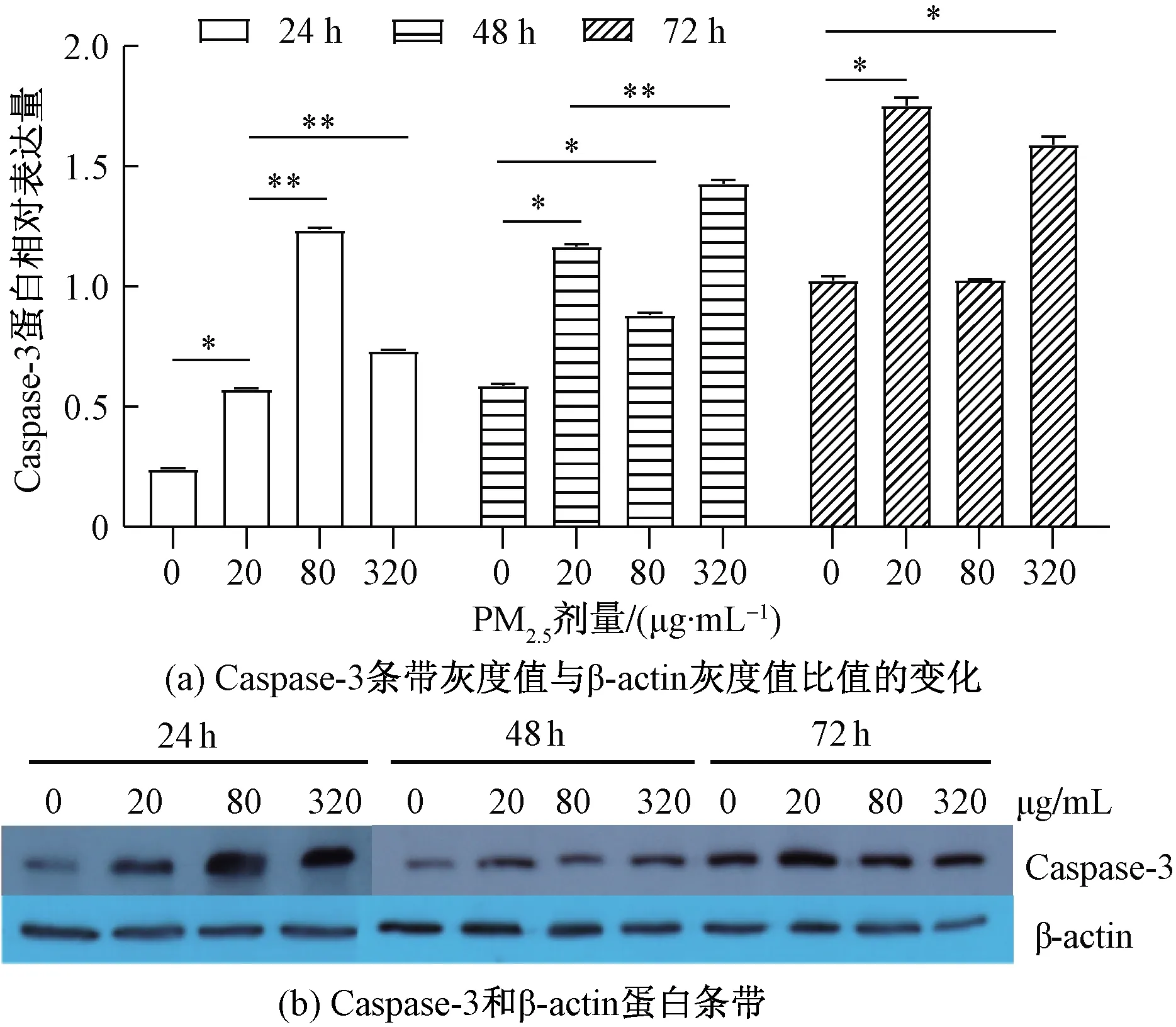
*表示与0 μg/mL组比较,P<0.01;**表示与20 μg/mL组比较,P<0.01图1 PM2.5染毒淋巴细胞24 h、48 h和72 h后 Caspase-3蛋白表达水平的变化Fig.1 Changes of Caspase-3 protein expression after lymphocytes were exposed to PM2.5 for 24 h, 48 h and 72 h
2.4 PM2.5染毒人外周血淋巴细胞CREB蛋白的表达
如图2所示,染毒细胞72 h后,随着PM2.5浓度的升高CREB蛋白表达量下降,各剂量组染毒72 h后均比生理盐水组明显降低(F72 h=6 219.570,P<0.001)。20、80、320 μg/mL剂量组染毒48 h后CREB蛋白表达量最高,但随着染毒时间的延长,染毒72 h后达到最低。
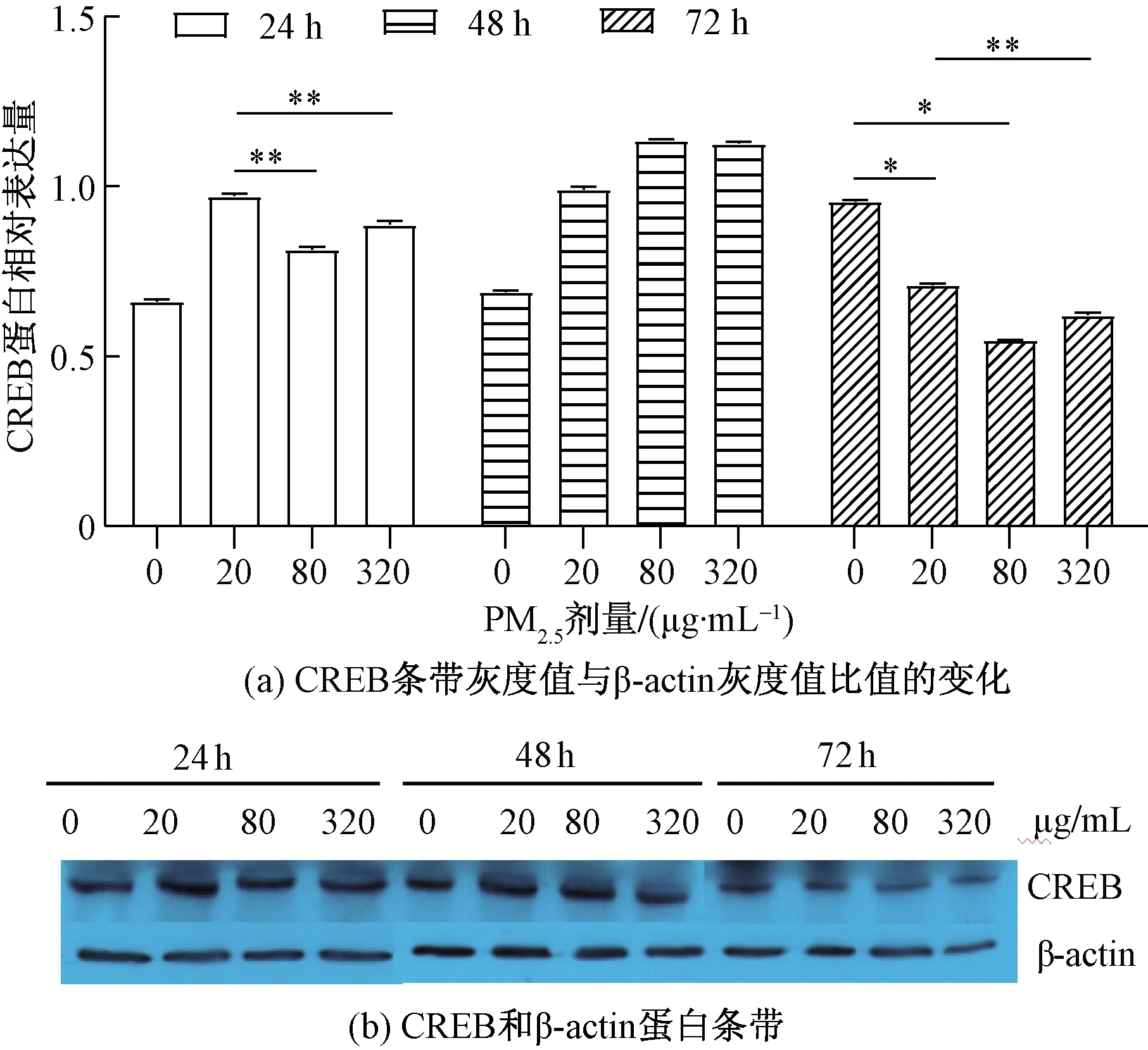
*表示与0 μg/mL组比较,P<0.01;**表示与20 μg/mL组比较,P<0.01图2 PM2.5染毒淋巴细胞24、48、72 h后 CREB蛋白表达水平的变化Fig.2 Changes of CREB protein expression in lymphocytes exposed to PM2.5 for 24 h, 48 h and 72 h
3 讨论
细胞凋亡是指为维持机体内环境稳定,由基因调控的自主且有序的1种细胞死亡方式,也称程序性细胞死亡。细胞凋亡过程的紊乱参与了许多疾病的发生发展,如自身免疫性疾病、肿瘤等,然而能够诱发细胞凋亡的因素也有很多,如环境、药物、射线等都可以导致机体细胞产生凋亡[10]。
实验发现,人外周血淋巴细胞在不同剂量的交通相关PM2.5染毒24 h和48 h后,早期凋亡和坏死的发生均有剂量-效应关系,早期凋亡还有一定的时间-效应关系,说明交通相关PM2.5可诱导人外周血淋巴细胞凋亡,并且与浓度和接触时间均有关。前期人群研究表明,交通污染严重区域学龄儿童外周血淋巴细胞早期凋亡的发生率高于轻污染区,这表明汽车排放的污染物诱导了淋巴细胞的早期凋亡[8],与本次体外细胞研究结果一致。冯欲静等[7]也发现PM2.5可使细胞内自由基增多,造成DNA氧化损伤,最终导致外周血淋巴细胞凋亡。董洁等[11]研究也表明,交通相关PM2.5可导致6T-CEM细胞凋亡的发生,并可能通过线粒体途径诱导凋亡。
Caspase-3被认为是Caspase依赖性凋亡通路的最终标志分子。实验结果表明,在染毒细胞24、48、72 h后,各浓度组Caspase-3蛋白表达水平均高于对照组,提示PM2.5暴露可诱导人外周血淋巴细胞发生凋亡,外周血淋巴细胞凋亡则会导致机体免疫功能降低。PM2.5致淋巴细胞凋亡可能是因为其携带多种有毒有害的物质,例如PM2.5中含有大量的多环芳烃和非烃组分,可诱导小鼠肺泡巨噬细胞凋亡[12]。高浓度的多环芳烃和元素镍与高细胞凋亡率和IL-1β的高表达密切相关[13]。张英英[14]研究结果显示,PM2.5上负载有大量的重金属,能够诱导心肌细胞产生大量的活性氧,进而引发细胞炎症,最终导致细胞凋亡。
PM2.5可诱导人外周血淋巴细胞凋亡,但其具体机制尚未完全明确。cAMP作为第二信使,可在正常机体细胞内直接参与各种生理功能活动的调控,例如细胞的代谢、增殖、分裂和凋亡以及激活离子通道、基因表达等多种生命活动,同时其在机体内产生和降解速率也受到各种胞内和胞外信号的影响。研究显示,提高细胞内cAMP水平能诱导多种淋巴瘤细胞增殖阻滞和凋亡[15]。细胞内cAMP含量的增加与淋巴细胞凋亡密切相关,AlCl3通过增加cAMP含量以及蛋白激酶A(protein kinase A, PKA)基因表达诱导淋巴细胞凋亡[16]。Gong等[17]研究发现,大剂量X射线可诱导胸腺细胞凋亡,在此过程中cAMP、蛋白激酶C(protein kinase C, PKC)以及Ca2+起到了促进作用。同时也有研究发现,CoCl2可降低平滑肌细胞cAMP含量,增加细胞凋亡[18]。cAMP的增加可以促进凋亡,也可以抑制凋亡,因细胞类型的不同发挥不同的作用[15]。本研究结果显示,在320 μg/mL PM2.5染毒人外周血淋巴细胞24、48、72 h后,细胞内cAMP含量均比生理盐水组升高,差异有统计学意义,表明PM2.5可导致细胞内cAMP含量增加,进而造成淋巴细胞凋亡。
CREB是真核细胞内核转录调节因子,受多种因素的激活调控靶基因,参与细胞的增殖、分化、能量代谢以及凋亡。研究显示,CREB可通过H2O2酶减轻ROS对细胞的损伤,CREB沉默可导致氧化应激后细胞凋亡的增加[19]。研究发现,使用CREB抑制剂抑制CREB的转录活性,通过下调Bcl-2显著增强了PC12细胞凋亡[20]。而CREB的过表达能抑制SH-SY5Y细胞的氧化应激和凋亡[21]。研究结果显示,染毒细胞72 h后,CREB的表达量随着PM2.5浓度的升高而降低,且各剂量组染毒72 h后CREB的表达量均比生理盐水组明显降低(P<0.01),结合染毒72 h后Caspase-3凋亡蛋白表达最高,促进了淋巴细胞凋亡,表明CREB可能负调控细胞凋亡形成,与前面相关研究基本一致。
4 结论
(1)交通相关PM2.5可诱导人外周血淋巴细胞产生凋亡,并且与PM2.5浓度以及接触时间有关。
(2)细胞内cAMP和CREB参与了交通相关PM2.5诱导人外周血淋巴细胞凋亡的调控。
