白僵蚕多糖的含量测定方法
2021-05-31洪佳青但彩云崔诗遥李文乐时连根
洪佳青,但彩云,崔诗遥,刘 雪,李文乐,金 洁,时连根
(浙江大学 动物科学学院,浙江 杭州 310058)
多糖(Polysaccharides)是由醛糖或酮糖通过糖苷键相连接的一类天然大分子聚合物,广泛存在于植物、动物、微生物、地衣、海藻等中,是构成生命的分子基础之一。20世纪60年代以后,多糖作为一种理想的生物效应调节剂(Biological Response Modifi⁃ers,BRM)引起了人们的极大兴趣[1];80年代以后,多糖被认为在细胞识别、控制细胞的分裂和分化等分子生物学方面起着极其重要的决定作用[2]。越来越多的研究表明,多糖具有提高免疫能力[3,4]、抗肿瘤[5~7]、抗氧化、抗感染[8~10]、抗辐射和降血糖、降血脂[11]等多种生物活性,而对正常细胞的毒副作用却很小[12]。因此,多糖的应用为恶性肿瘤、艾滋病和其他多种疾病的治疗开辟了新的方向,也吸引越来越多的研究者期望从天然产物中寻找活性更高、更为有效的多糖。
白僵蚕(Bombyxbatryticatus)是家蚕(Bombyx mori)幼虫感染病原白僵菌(Beauveriabassiana)而僵死的干燥菌虫复合体,为我国传统的名贵中药材,始载于《神农本草经》中,味咸辛,性平,用于治疗癫痫、高热惊厥、流行性腮腺炎、上呼吸道感染、遗尿等疾病[13,14]。现代药理学研究表明,白僵蚕富含多糖、白僵菌素、草酸铵、黄酮类化合物、活性蛋白质、酶、氨基酸、维生素、微量元素、有机酸等多种活性成分,具有镇定、退热、止咳化痰、消肿、松弛肌肉、调节神经系统及脂肪代谢等多种药理作用[15,16]。但有关白僵蚕中多糖含量的检测方法,未见有国内外文献报道。本研究采用正交实验法进行白僵蚕中多糖提取条件的优化,建立白僵蚕多糖含量测定的分光光度法。
1 材料与方法
1.1 仪器
Ultrospec 3100 Pro分光光度计,美国Amersh⁃ampharmacia Biotech公司产品;Mettler Toledo B-N天平,梅特勒-托利多仪器上海有限公司产品;DL-180超声波破碎仪,上海申波超声公司产品;AP-02B真空泵,天津奥特赛恩斯仪器有限公司产品;电热恒温水浴锅,上海医疗器械五厂产品;中药粉碎机,上海淀久中药机械制造有限公司产品。
1.2 试剂
葡萄糖、蒽酮、氯仿、正丁醇、浓硫酸、甲醇和乙醇均为分析纯,购自中国医药上海化学试剂公司。水为双蒸馏水。
1.3 白僵蚕粉
家蚕品种为“秋丰×白玉”,常规条件下桑叶饲育至5龄起蚕,在蚕体表面喷洒白僵菌分生孢子液(107个/mL),然后置温度25℃、湿度90%环境下继续饲养,收集感染白僵菌致死蚕体,置25℃、90%湿度条件下保护,直至蚕体覆满白色的白僵菌分生孢子,于-70℃冷冻保存。使用时冷冻干燥,低温超微粉碎,过筛制得不同粗细的白僵蚕粉。
1.4 对照品溶液的制备
精密称取105℃烘干至恒重的葡萄糖对照品25 mg,置于100 mL容量瓶中,加入双蒸馏水,溶解并稀释至刻度,配成质量浓度为0.25 mg/mL的对照品溶液。
1.5 样品溶液的配制
精密称取0.2 g白僵蚕粉,置于烧瓶中,加入50 mL 80%乙醇,100℃水浴锅中回流1 h,抽滤,用热80%乙醇洗涤2次。滤渣挥发干后,加入20 mL双重蒸馏水,超声波处理50 min,100℃水浴中提取60 min,抽滤,滤渣再重复提取1次。合并2次滤液,放在常温下冷却,然后转移到100 mL的容量瓶中,用双蒸馏水定容,即为样品溶液。
1.6 蒽酮-硫酸试剂的配制
准确称取0.33 g蒽酮,加入100 mL浓硫酸,混合摇匀,置于冰箱中,现配先用。
1.7 最大吸收波长的选择
分别吸取上述对照品溶液和样品溶液,与蒽酮-硫酸试液显色后,于400 nm~700 nm全波长扫描,结果均在620 nm处有最大吸收,故选择620 nm为测定波长。
1.8 多糖含量的测定
精密吸取样品溶液1 mL,置于10 mL有塞试管中,冰水浴5 min,加入0.2%蒽酮硫酸试液4 mL,摇匀,立即置于沸水浴中15 min,取出用冷水冷却至室温,室温放置10 min左右,于620 nm处测吸光度,以同样处理的双蒸水进行空白校正。对照标准曲线的回归方程,求出多糖含量。
1.9 统计分析
实验数据用平均数±标准差(Mean±SD)表示,采用SPSS(version 12.0)统计软件进行t检验,Excel 2007绘图工具进行绘图。
2 结果与分析
2.1 标准曲线的绘制
分别吸取对照品溶液 1、2、3、4、5、6、7、8、9、10 mL,置于25 mL的容量瓶中,以双蒸馏水稀释均匀,得系列对照品溶液。精密吸取上述系列对照品溶液1 mL,以双蒸馏水为空白对照,按1.8的方法操作,与蒽酮-硫酸试剂显色后,于620 nm处测定吸光度值。以吸光度值为纵坐标,以葡萄糖浓度为横坐标,绘制多糖的标准吸收曲线(图1)。以吸光度值(Y)对葡萄糖浓度(X)进行回归分析,得出其回归方程为:Y=9.743X+0.010,相关系数R2=0.998。结果表明,葡萄糖浓度在0.01 mg/mL~0.10 mg/mL范围内,其浓度与对应的吸光度呈现良好的线性关系,符合Lambert-Beer定律,根据吸光度值来计算其含量是可靠的。
2.2 最佳实验条件的确立
由于水提温度、超声波处理时间和水提时间对实验结果影响较大,所以对这三个因素进行正交试验,以确定最佳试验条件,结果如表1所示。结果表明,此三因素对白僵蚕多糖含量测定的影响大小是水提时间(c)>水提温度(a)>超声波处理时间(b),比较各因素不同水平的效果,分别是 Īa100℃>Īa80℃>Īa60℃,Īb50min>Īb40min>Īb30min和 Īc60min>Īb90min>Īb30min。为此,在超声波处理50 min、100℃水提取60 min为白僵蚕多糖提取的理想条件。考察提取次数对白僵蚕多糖提取的影响,结果多糖提取量随着提取次数的增加而增大,而第4次提取液的吸光度为0。如果将第1-3次多糖提取量的指数定为100%,则第1次、第2次和第3次的多糖提取率分别为91.12%、7.91%和0.97%,即提取2次的多糖提取率已达99%以上。因此,选择提取2次。
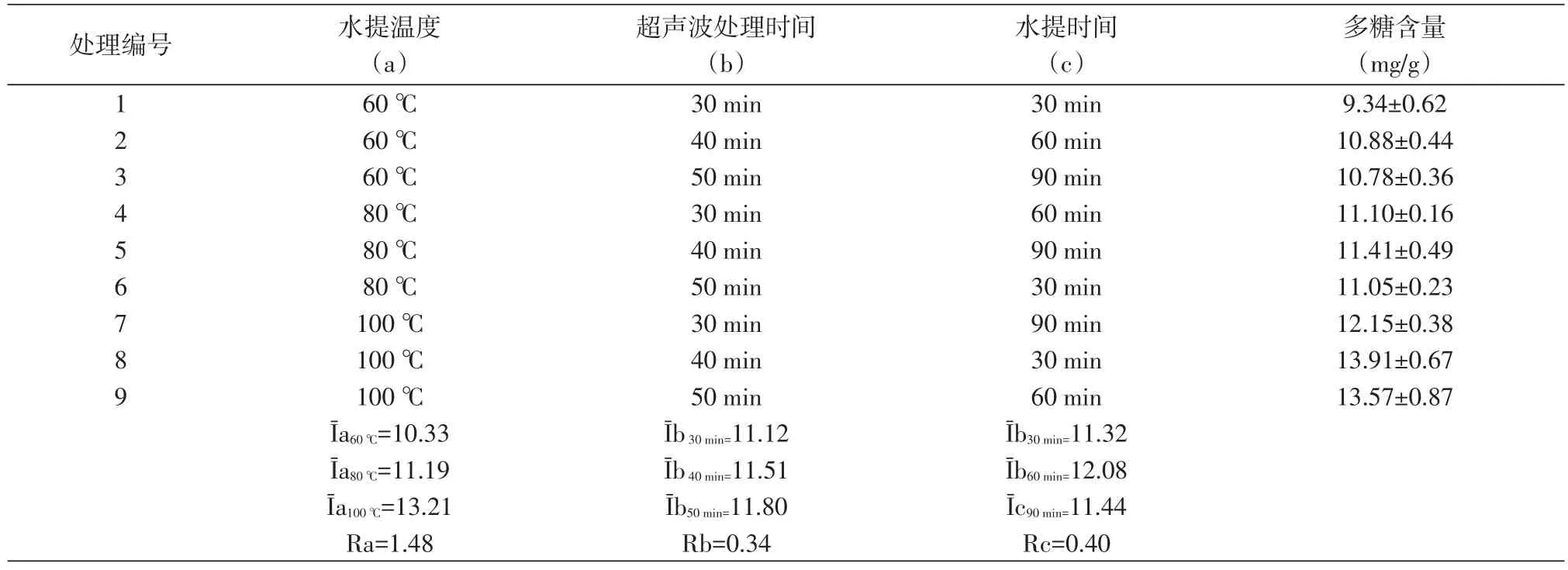
表1 白僵蚕多糖含量测定的正交试验结果Table 1 The Orthogonal Experimental Result of Polysaccharides Determination
分别用粗磨、过80目筛、过120目筛、160目筛和过200目筛的白僵蚕粉制备样品液,调查试样的不同粉碎程度对白僵蚕多糖提取的影响,结果如表2所示。结果表明,白僵蚕的不同粉碎程度在多糖提取效果间存在明显的差异,其中过160目筛的提取效果最好。

表2 不同粉碎程度对白僵蚕多糖提取效果的影响Table 2 The Effect of Polysaccharides Determination with the Different Crushed Sample
2.3 重现性实验结果
精密称取白僵蚕粉5份,每份约0.2 g,按最佳提取条件制备样品液,分别按1.8的方法进行测定,结果多糖平均含量为11.54 mg/g,RSD=1.02。结果表明测定方法重复性好。
2.4 稳定性实验结果
取同一批样品液,分别于0、2、4、6、8、12、24 h按1.8的方法进行测定,结果在24 h内测定多糖的平均含量为11.68 mg/g,RSD=0.89,结果表明多糖提取液在24 h内稳定。
2.5 加样回收率实验结果
精密称取已知含量的白僵蚕粉5份,每份约0.2 g,分别加入一定量的标准多糖,按最佳提取条件制备样品液,再分别按1.8的方法进行测定,计算平均加样回收率为99.27%,RSD=2.5,结果表明本测定方法符合加样回收率的要求。
3 讨论
蒽酮-硫酸法测定多糖含量,是利用多糖在浓硫酸作用下,水解成单糖,并迅速脱水生成羟甲基糠醛,羟甲基糠醛与蒽酮综合成蓝色化合物,比色该化合物颜色的深浅来计算多糖浓度的高低[17]。本实验选用80%乙醇回流除去苷类、生物碱等干扰成分,建立了用蒽酮-硫酸试剂显色、分光光度法来测定白僵蚕中多糖含量的方法,该方法的稳定性、重现性和回收率均符合要求,得出的结果稳定可靠,可作为检测白僵蚕多糖含量的有效方法之一。
多糖存在于细胞膜或细胞壁中,不同物体中的多糖具有不同的溶解特性。多糖提取有水提、酸提、碱提、酶提等方法,但多糖在热水中溶解度更大、稳定性更好,所以热水浸提法是生物多糖最广泛采用的提取方法[18]。本实验验就水提温度、超声波处理时间、水提时间、样品粉碎程度和提取次数等对白僵蚕多糖提取效果的影响进行了比较,结果表明白僵蚕粉过160目筛,超声波处理50 min后于100℃水回流60 min,重复提取2次,可高效地提取白僵蚕中多糖,研究结果可为白僵蚕多糖的药理学研究奠定基础。
