促微管聚合蛋白3在人胃癌组织中的表达及其临床意义
2021-05-31钱晓兰陈志鹏卢玮冬朱惠平
钱晓兰,陈志鹏,卢玮冬,朱惠平
(苏州大学附属张家港医院肿瘤科,江苏 张家港 215600)
促微管聚合蛋白3(TPPP3)是促微管聚合蛋白家族(TPPPs)成员之一,又称为TPPP/p20、p20或p25-7,包含有176 个氨基酸,由TPPP3基因唯一编码,定位在第16号染色体上(16q22.1)。TPPPs能与微管蛋白结合,促使微管聚集,维持微管系统的稳定性和完整性。TPPP3的功能区主要在其羧基段的一个保守的p25-α结构域[1-2],具有促进微管蛋白聚合和组装的能力。
最近研究表明,TPPP3和肿瘤的发生发展有密切联系。Zhou等[3]研究发现TPPP3在宫颈癌HeLa细胞中高表达,随后,Zhou等[4]证实在裸鼠移植瘤模型中抑制TPPP3表达能干扰细胞有丝分裂和细胞周期的进程,从而阻遏肿瘤细胞的增殖。Pastor等[5]发现肺癌患者中TPPP3含量明显增加。李建华等[6]研究发现肝癌中TPPP3过表达,并通过凋亡依赖的方式调控细胞增殖。此外,TPPP3还可调控癌细胞转移和体内肿瘤生长。Li等[7]通过对非小细胞肺癌(non-small cell lung cancer, NSCLC)患者进行组织芯片检测发现,TPPP3在肺癌组织中的表达较癌旁组织高,且与患者总体生存率呈负相关。体内外实验表明TPPP3可能在NSCLC中起癌基因的作用。Li等[8]发现TPPP3的上调与NSCLC的转移能力增加相关。异位表达TPPP3可显著增强体外细胞增殖能力,促进体内肿瘤生长。此外,过表达TPPP3显著促进NSCLC细胞迁移和侵袭,同时在体内外上调Twist1。Ye等[9]发现敲低TPPP3可抑制结直肠癌细胞的增殖、迁移和侵袭,并诱导细胞凋亡,Shen等[10]发现抑制TPPP3可抑制子宫内膜癌细胞的增殖、侵袭和迁移,Ren等[11]发现TPPP3沉默可抑制NF-κB/COX2信号通路,从而抑制乳腺癌细胞的增殖、侵袭和迁移,表明TPPP3在结直肠癌、子宫内膜癌、乳腺癌等恶性肿瘤的发生进展中起重要作用。
以上研究报道表明,TPPP3在肝癌、结直肠癌、NSCLC等肿瘤组织中的表达水平高于正常组织,可能与这些肿瘤的发生发展相关,但是TPPP3在其他肿瘤上的表达及TPPP3导致肿瘤的分子机制、靶向作用机制等,目前仍不明确,需要进一步的研究和探讨。基于以上研究背景和目前TPPP3在胃癌研究中的空白,本课题组将通过检测胃癌组织、癌旁正常组织中TPPP3的表达水平,探讨TPPP3基因在胃癌组织中的表达情况及其与临床生物学行为和患者生存期的关系。
1 材料与方法
1.1 病例收集 本研究选取2014年07月—2017年01月在苏州大学附属张家港医院接受胃癌手术的患者,共收集102 例胃癌组织及其匹配的癌旁组织(界定为癌灶外5 cm以上)。病例纳入标准为:(1)胃癌根治术后(R0切除);(2)组织病理学证实为胃腺癌;(3)手术前未接受过抗肿瘤治疗;(4)患者以及家属对该研究均知情,且签署知情同意书。排除标准为:(1)手术前接受过抗肿瘤治疗者;(2)哺乳期及妊娠期女性;(3)合并其他尚未治愈的恶性肿瘤;(4)合并有内分泌、代谢性、血液系统、免疫系统疾病者。所有病例术后病理均应确诊为胃癌,并记录其完整的临床病理资料。术中取得标本后常规固定包埋切片。所有患者术前均未行任何形式新辅助治疗或转化治疗。本研究符合医学伦理,并经医院伦理委员会审查后批准进行。
1.2 实验方法 所有胃癌组织标本收集后常规固定、石蜡包埋后,4 μm连续切片。石蜡切片在二甲苯中分离,在分级乙醇中再水化,使用EDTA抗原修复液修复抗原,使用Dako试剂盒中提供的过氧化物酶阻断剂(SM801)阻断内源性过氧化物酶活性。随后使用兔抗人TPPP3多克隆抗体(Abcam)、EnVision™ FLEX/HRP(Dako)孵育,再经DAB显色、苏木素复染、脱水封片,最后在显微镜下观察结果。
1.3 免疫组化结果判定 结果判定由两名研究者在病理医师指导下独立阅片完成,以染色阳性强度作为TPPP3表达的主要判定指标,染色阳性强度评分=染色强度评分×染色阳性率评分。染色强度判定依次为无色(0 分,阴性),淡黄色(1 分,1+),棕黄色(2 分,2+);染色阳性率判定:在正置光学显微镜下(200×)随机选取5 个染色不同的视野,每个视野随机计数出的100 个细胞,然后计算100 个细胞中阳性细胞占的百分率,最终取5个阳性率的平均值。将其换算为评分:0 分(阴性),1 分(1%~25%),2 分(26%~50%),3分(51%~75%),4 分(76%~100%)。癌组织和癌旁组织分别判读。染色阳性强度判断及对应的评分标准为:≤ 2 分(-),3~5 分(+),6~8分(++)。根据TPPP3表达的中位值,总评分>2 分为高表达组。
1.4 统计分析 采用SPSS 23.0对所有数据进行统计学分析,计数资料用率(%)表示,分类变量的组间差异采用χ2检验或Fisher确切概率法检验,来判断TPPP3在人胃癌组织中的表达与胃癌临床病理特征的相关性。而其与预后的相关性采用Kaplan-Meier法进行单因素生存分析,Log-rank检验评估生存差异,COX比例风险回归模型进行多因素分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 病例一般情况 本研究共收集102 例胃癌患者,其中男性79 例,女性23 例;年龄31~83 岁,中位年龄66.5 岁,按年龄分为高龄组(≥60 岁)69例,低龄组(<60 岁)33 例;病理类型:102 例均为腺癌;组织分化:中/高分化29 例,低分化73例;肿块大小≥5 cm者65 例,<5 cm者37 例;有区域淋巴结转移76 例,无区域淋巴结转移26 例。按浸润深度分两组,T1/T2(未侵及浆膜层者)14 例,T3/T4(侵及浆膜和浆膜外者)88 例。根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)/国际抗癌联盟(Union for International Cancer Control, UICC)2016年10月颁布的第八版胃癌TNM分期标准统计,Ⅰ+Ⅱ期42例,Ⅲ期60 例。
2.2 TPPP3在胃癌组织及癌旁组织的表达 经免疫组化检测,结果显示,TPPP3在胃癌癌细胞的胞浆中有表达,呈棕黄色颗粒染色(图1A),在胃癌癌旁上皮细胞中也有表达,但染色较浅,呈淡黄色颗粒染色(图1B),具体染色评分判定见图2。102 例胃癌组织中,79 例(77.5%)表达阳性,23例(22.5%)表达阴性,而在癌旁组织中,35 例(34.3%)表达阳性,67 例(65.7%)表达阴性,TPPP3在胃癌癌组织与癌旁组织中的表达差异具有统计学意义(χ2=38.494,P<0.001)。

图1 TPPP3在胃癌组织及癌旁组织中的表达情况(IHC,200×)

图2 TPPP3在胃癌组织中的染色情况(IHC,200×)
2.3 TPPP3的表达与临床病理特征的关系 肿块<5 cm的胃癌组织中的TPPP3阳性表达率为59.5%,肿块≥5 cm的胃癌组织中的TPPP3阳性表达率为87.7%,两组之间差异具有统计学意义(P=0.001);无区域淋巴结转移的胃癌组织中的TPPP3阳性表达率为53.8%,有区域淋巴结转移的胃癌组织中的TPPP3阳性表达率为85.5%,两组之间差异具有统计学意义(P=0.001);浸润深度为T1/T2的胃癌组织中的TPPP3阳性表达率为42.9%,浸润深度为T3/T4的胃癌组织中的TPPP3阳性表达率为83.0%,两组之间差异具有统计学意义(P=0.003);TNM分期为Ⅰ/Ⅱ期的胃癌组织中的TPPP3阳性表达率为61.9%,TNM分期为Ⅲ期的胃癌组织中的TPPP3阳性表达率为88.3%,两组之间差异具有统计学意义(P=0.002)。而TPPP3的阳性表达与性别、年龄及组织分化程度无关(P>0.05)(见表1)。
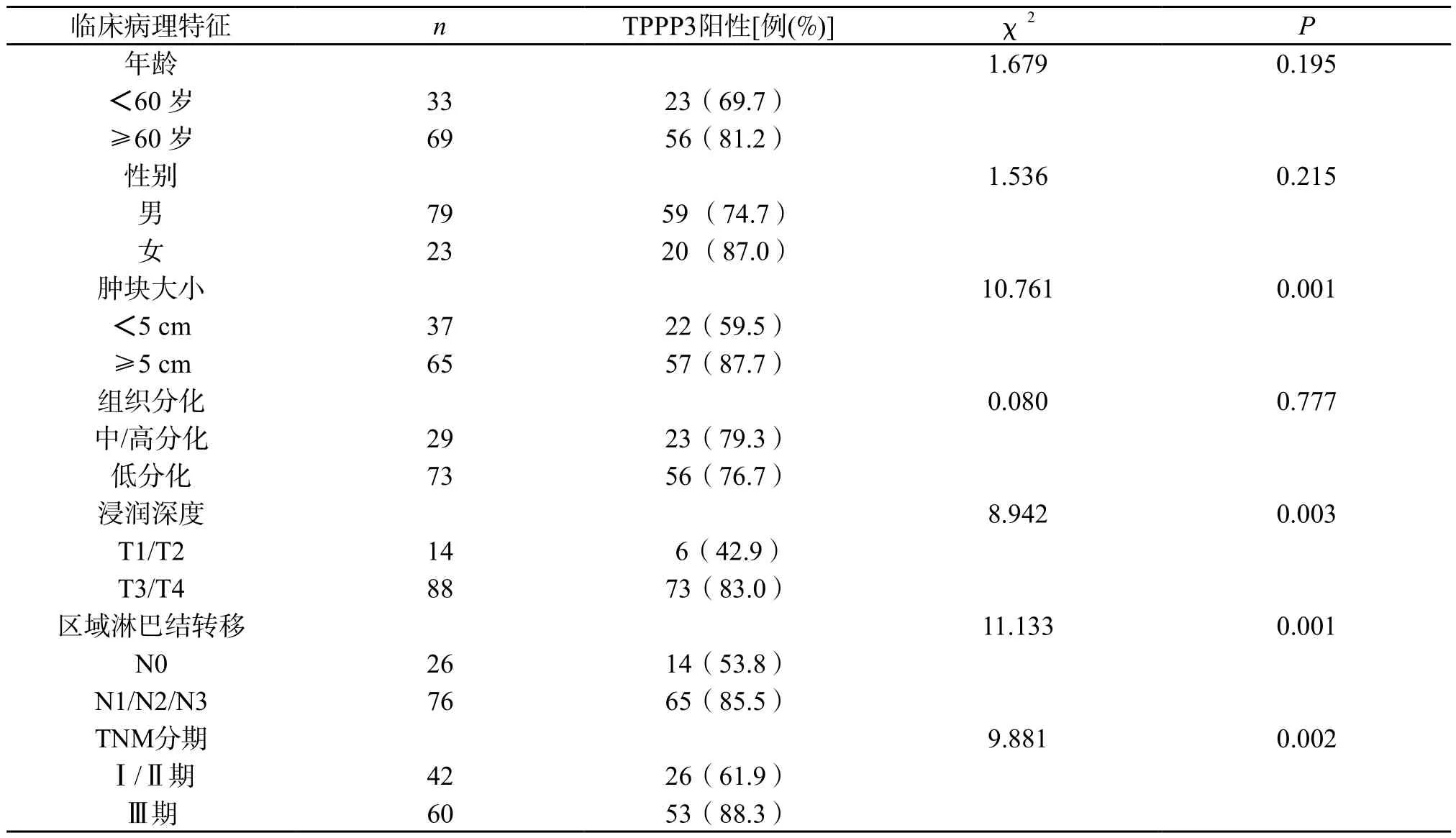
表1 102 例胃癌患者TPPP3的表达与临床病理特征的关系
2.4 TPPP3在胃癌组织中的表达与胃癌生存期的关系 对102 例胃癌患者进行后期随访,从2014年08月开始随访至2019年08月,中位随访时间33.3 个月,通过门诊和电话随访,定期复查CT和胃镜,其中85例患者随访资料完整,失访患者17 例。随访截止时,所有患者的1 年、2 年和3 年的总生存率分别是78.8%、64.7%和45.9%,共有46 例患者死亡,其中有41 例的死因与胃癌或者治疗相关,另有5 例死于心脑血管疾病、肺炎等非胃癌、治疗相关疾病。
采用Kaplan-Meier法分析胃癌组织中TPPP3表达对患者总生存期(overall survival, OS)的影响,得出结果:胃癌组织中TPPP3表达阳性的患者术后1 年、2 年和3 年的总生存率分别是78.5%、60.0%和38.5%,而 TPPP3表达阴性的患者术后1 年、2 年和3 年的总生存率分别是78.9%、73.7%和67.5%,生存曲线看出第3年的存活率两组差异具有统计学意义。两组的生存结果采用Log-rank时序检验进行生存分析结果显示TPPP3在胃癌组织中表达阳性有降低患者OS的趋势,但差异无统计学意义(χ2=3.589,P=0.058)(见图3A)。采用Kaplan-Meier法进一步分析胃癌组织中TPPP3表达对患者无病生存期(disease-free survival, DFS)的影响,结果显示胃癌组织中TPPP3表达阳性的患者术后1 年、2 年和3 年的无病生存率分别是42.6%、23.3%和23.3%,而 TPPP3表达阴性的患者术后1 年、2 年和3 年的无病生存率分别是79.2%、67.7%和67.7%。两组的生存结果采用Log-rank时序检验进行生存分析结果发现TPPP3表达阳性的患者DFS明显低于TPPP3蛋白表达阴性的患者,差异具有统计学意义(χ2=9.006,P=0.003)(见图3B)。

图3 TPPP3阳性与阴性表达胃癌患者的OS(A)和DFS(B)生存曲线图,其中绿线代表阳性表达组,蓝线代表阴性表达组,菱形代表删失数据
应用COX比例风险回归模型进行多因素分析,结果发现TPPP3的表达水平(P=0.035)、浸润深度(P=0.046)和区域淋巴结转移(P=0.044)可能是影响胃癌患者DFS的独立因素(见表2)。

表2 影响胃癌患者DFS的多因素生存分析
3 讨论
根据既往文献报道,TPPP3在宫颈癌HeLa细胞、Lewis肺癌细胞中高表达,在人肝癌、结直肠癌、NSCLC组织中的表达水平亦高于正常组织,且后续研究表明,TPPP3高表达与肝癌、肺癌等肿瘤细胞的增殖、侵袭及迁移相关。然而,迄今尚未有文献报道TPPP3在胃癌组织中的表达情况及临床意义。本研究通过免疫组化方法发现TPPP3在胃癌组织、癌旁组织均有表达,其中TPPP3在胃癌组织中主要表达在癌细胞的胞浆中,呈棕黄色颗粒染色,而TPPP3在癌旁上皮细胞中也表达,但染色较浅。102 例胃癌癌组织中,肿瘤组织阳性表达率为77.5%(79/102),癌旁组织中的阳性表达率为34.3%(35/102),两者阳性表达率差异具有统计学意义(P<0.05)。
以往的部分研究显示,肿瘤细胞中TPPP3的表达水平可能与肿瘤的临床病理特征及患者预后相关。NSCLC细胞中TPPP3表达水平与肿瘤大小、淋巴结转移及临床分期呈显著正相关性,而与年龄、性别、肿瘤位置等无关[7]。结直肠癌细胞中TPPP3表达水平与肿瘤大小、TNM分期及淋巴结转移呈正相关[9]。在本研究中:在胃癌病灶≥5 cm、有区域淋巴结转移、肿瘤浸润深度为T3/T4及TNM分期为Ⅲ期的病例中,TPPP3阳性表达率较高,提示TPPP3高表达可能促进胃癌细胞的增殖、侵袭及转移,该结果与既往其他瘤种的研究结果一致。
本研究同时探究了胃癌组织中TPPP3表达情况与患者预后的关系,结果显示TPPP3表达阳性患者与阴性患者的术后1 年、2 年和3 年的总生存率差异无统计学意义;而TPPP3表达阳性患者与阴性患者术后1 年、2 年和3 年的无病生存率差异具有统计学意义。两组的生存结果采用Kaplan-Meier生存分析法进行生存期单因素分析,结果显示胃癌中TPPP3表达阳性的患者DFS明显低于TPPP3表达阴性的患者,而TPPP3表达阳性有降低患者生存的趋势,但差异无统计学意义。2~3 年DFS完全相同说明所有患者的复发发生在2 年内,在第3年的复发人数为0。复发都发生在2 年内,意味着复发的患者在第3年有较大的概率死亡,从OS的生存曲线看出,第3年的存活率两组差异具有统计学意义。应用COX比例风险回归模型进行多因素分析,结果发现TPPP3的表达水平(P=0.035)、浸润深度(P=0.046)和区域淋巴结转移(P=0.044)可能是影响胃癌患者DFS的独立因素。TNM分期与胃癌患者DFS无关可能与统计病例数偏少有关。在其他相关文献报道中,NSCLC细胞中TPPP3高表达与患者OS短相关,提示TPPP3高表达与NSCLC的预后不良有关[7];结直肠癌细胞中TPPP3高表达与较短的OS及DFS相关[9]。然而,在本研究中并未发现TPPP3高表达与胃癌患者OS的统计学相关性,考虑可能与以下因素有关:1.本研究中位随访时间为33.3 个月,故仅统计了3 年以内的生存结果,而延长随访时间可能得到更确切的长期生存结果;2.出现术后复发或者转移后,部分患者选择了挽救治疗、姑息治疗,包括手术、放疗、化疗及靶向治疗,另有小部分患者因各种原因放弃了后续治疗,故复发后的治疗情形复杂,可能对总体的生存期造成影响,引起结果的偏倚,将来可增加入组患者的病例数并依据术后复发治疗策略进行分层分析得出更可靠的结果。
综上所述,本研究的结果显示,胃癌组织中TPPP3的表达水平与肿块大小、区域淋巴结转移、肿瘤浸润深度及TNM分期呈正相关,而与患者性别、年龄、组织分化程度并无统计学相关性。另外,TPPP3高表达导致了胃癌患者DFS的明显下降,差异具有统计学意义(P<0.05),但两组OS差异无统计学意义(P>0.05)。TPPP3的表达水平、浸润深度和区域淋巴结转移可能是影响胃癌患者DFS的独立因素。因此,我们认为TPPP3可能参与了胃癌的发生,并可促进肿瘤组织生长,而TPPP3高表达有导致术后疾病复发的趋势。但目前TPPP3在胃癌发生发展过程及生物学行为中的具体作用机制尚不完全清楚,今后有待进一步进行分子水平、细胞水平及动物实验予以探究及证实。
