青年缺血性卒中患者脑小血管病总负荷的危险因素分析
2021-05-29秦伟胡红梅李譞婷王韵杨淑娜胡文立
秦伟,胡红梅,李譞婷,王韵,杨淑娜,胡文立
脑小血管病(cerebral small vessel disease,CSVD)是指由多种病因影响脑小动脉及其远端分支、微动脉、毛细血管、微静脉所导致的一系列临床、影像学和病理综合征[1]。CSVD临床表现缺乏特异性,主要依据神经影像学检查结果进行诊断。CSVD的MRI影像学表现包括近期皮质下梗死、脑白质高信号(white matter hyperintensities,WMH)、扩大的血管周围间隙(enlarged perivascular spaces,EPVS)、腔隙及脑微出血(cerebral microbleed,CMB)等。此外,脑萎缩也被认为与CSVD有关[2]。青年缺血性卒中指发生于18~45岁的卒中,占所有缺血性卒中的10%~15%。研究表明,CSVD在青年缺血性卒中患者的发病过程中具有重要作用[3-4]。目前关于青年缺血性卒中CSVD的相关研究较少,且现已发表的研究多集中于无症状性脑梗死、WMH、CMB等单独的影像学指标分析[5-6]。Staals等[7]根据CSVD不同的头颅MRI影像学特征总结获得“CSVD总负荷评分”,可准确评估CSVD对整体脑功能的损害。本研究探讨青年缺血性卒中患者CSVD总负荷的危险因素。
1 对象与方法
1.1 研究对象 回顾性纳入2016年1月-2020年10月于首都医科大学附属北京朝阳医院神经内科连续收治的青年急性缺血性卒中患者。本研究经首都医科大学附属北京朝阳医院伦理委员会批准(批准文号:2021-科-241)。纳入标准:①年龄18~45岁;②患者为首次卒中,发病72 h内入院;③诊断标准参照《中国急性缺血性脑卒中诊治指南2014》[8],并经头颅MRI检查证实。排除标准:①未行头颅MRI检查或MRI影像学资料不可获得;②脑出血、TIA、静脉性脑梗死;③脑肿瘤、脑外伤史,严重心、肝、肾等疾病;④精神系统疾病或其他神经系统病变;⑤非血管性脑白质病变。
1.2 临床资料收集 收集患者的人口学信息(年龄、性别)、血管危险因素(高血压、糖尿病、高脂血症、冠心病、吸烟和饮酒史)、入院时NIHSS评分、入院次日实验室检查(血肌酐、糖化血红蛋白、Hcy)及TOAST分型[9]。吸烟定义为平均每天吸烟1支及以上,且至少持续1年;饮酒定义为平均每天饮酒>30 g及以上,且至少持续6个月。
1.3 CSVD总负荷评估及分组 头颅MRI检查结果评估均由1名对临床资料不知情的CSVD神经影像科专家独立完成,患者的MRI影像学特征定义如下。①WMH:脑白质异常信号,在T2或FLAIR上显示高信号,T1显示等信号或低信号。根据Fazekas量表对深部和室周WMH分别进行评分(0~3分)。深部WMH:0为无异常信号,1为散在点状异常信号,2为开始融合的白质病灶,3为大片状融合的白质病灶;室周WMH:0为无异常信号,1为帽状或薄线样异常信号,2为光滑晕圈,3为延伸至深部白质区[2]。②EPVS:脑实质的小动、静脉周围被软脑膜围绕的扩张间隙,在MRI上呈圆形、椭圆形或线形,其信号与脑脊液一致。对基底节区的EPVS严重程度进行评分(0~4分)[10]。③腔隙:位于基底节、内囊、半卵圆中心脑干等部位的圆形或卵圆形,直径3~20 mm的空腔,T2和FLAIR上显示脑脊液信号,FLAIR上显示边缘高信号且DWI信号无增强[11]。④CMB:SWI图像上显示点状(一般直径为2~5 mm,最大直径可达10 mm)低信号的均匀灶,可见晕染反应[11]。
患者头颅MRI上CSVD总负荷评分参考Staals等[7]研究结果评估,每符合以下标准中的一项,则记1分。①中重度WMH,Fazekas量表评定室周脑白质病变3分和(或)深部脑白质病变2~3分;②中重度EPVS,基底节水平中至重度EPVS(2~4级);③腔隙,存在至少一个腔隙;④CMB,大脑深部或幕下存在至少一个CMB。将上述评分相加获得CSVD总负荷评分(0~4分)。根据CSVD总负荷评分将患者分为四组,即0分组、1分组、2分组及3~4分组。
1.4 统计学方法 采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析;不符合正态分布的计量资料以M(P25~P75)表示,多组间比较采用Kruskal-Wallis H检验。计数资料以率(%)表示,多组间比较采用χ2检验或Fisher精确检验。将单因素分析中P<0.1的变量及临床认为潜在的影响因素作为自变量,以CSVD总负荷评分分层为因变量,采用有序logistic回归分析CSVD总负荷评分的危险因素。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 不同CSVD总负荷评分组的表型及构成比情况 共纳入272例患者,年龄18~45岁,平均39.55±5.19岁,男性230例(84.6%)。其中,105例(38.6%)患者存在至少一个腔隙;52例(19.1%)患者存在中重度WMH;26例(9.6%)患者存在一个以上CMB;15例(5.5%)患者存在中重度EPVS。根据CSVD总负荷分为0分组146例(53.7%),1分组71例(26.1%),2分组40例(14.7%),3~4分组15例(5.5%),其中4分2例。不同CSVD总负荷评分组的表型及构成比见图1。
2.2 不同CSVD总负荷评分组的基线资料比较不同CSVD总负荷评分组年龄、高血压、肌酐水平差异均有统计学意义,其余基线资料差异无统计学意义(表1)。
2.3 CSVD总负荷危险因素分析 有序logistic回归分析结果显示,增龄(OR1.110,95%CI1.048~1.175)和高血压(OR2.649,95%CI1.537~4.559)是CSVD总负荷评分的独立危险因素(表2)。
3 讨论
卒中是世界范围内致死、致残的主要原因。近年来,中老年卒中的发病率有降低趋势,而青年卒中的发病率逐年升高[12]。与普通人群相比,青年卒中患者发生死亡和残疾的风险更高,更易出现认知障碍、情感障碍及卒中后疲劳等症状,给社会和家庭造成沉重负担[12]。约25%的卒中由CSVD导致,并且CSVD可使卒中复发的风险增加两倍[2]。相对于WMH、CMB等单一的影像学指标,CSVD总负荷评分可更精确地评估CSVD对卒中患者整体脑功能的影响[7],并且CSVD总负荷可预测缺血性卒中患者复发及功能转归[13-14]。
本研究中,CSVD总负荷评分1分组各表型均存在,以腔隙检出率最高,2分组和3~4分组均有构成比为0的表型。而在一项以老年卒中患者为主要观察对象的研究中,CSVD表型的构成比与本研究相似,但在高分组各表型的分布更均匀[15-16]。推测该结果可能与本研究对象为青年患者,合并高血压等血管危险因素的比例低于老年患者有关。
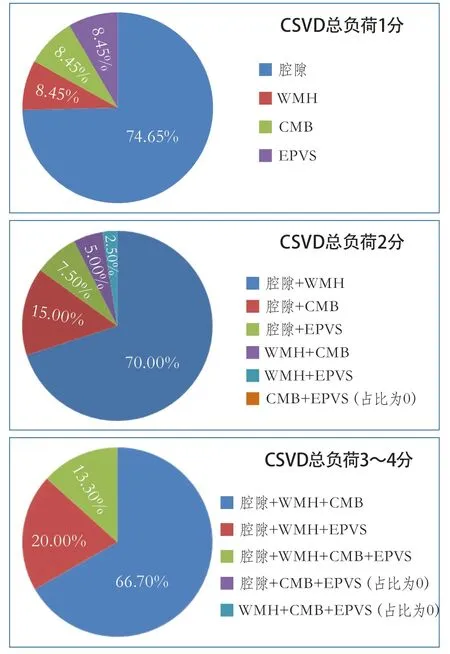
图1 不同CSVD总负荷评分组表型及构成比
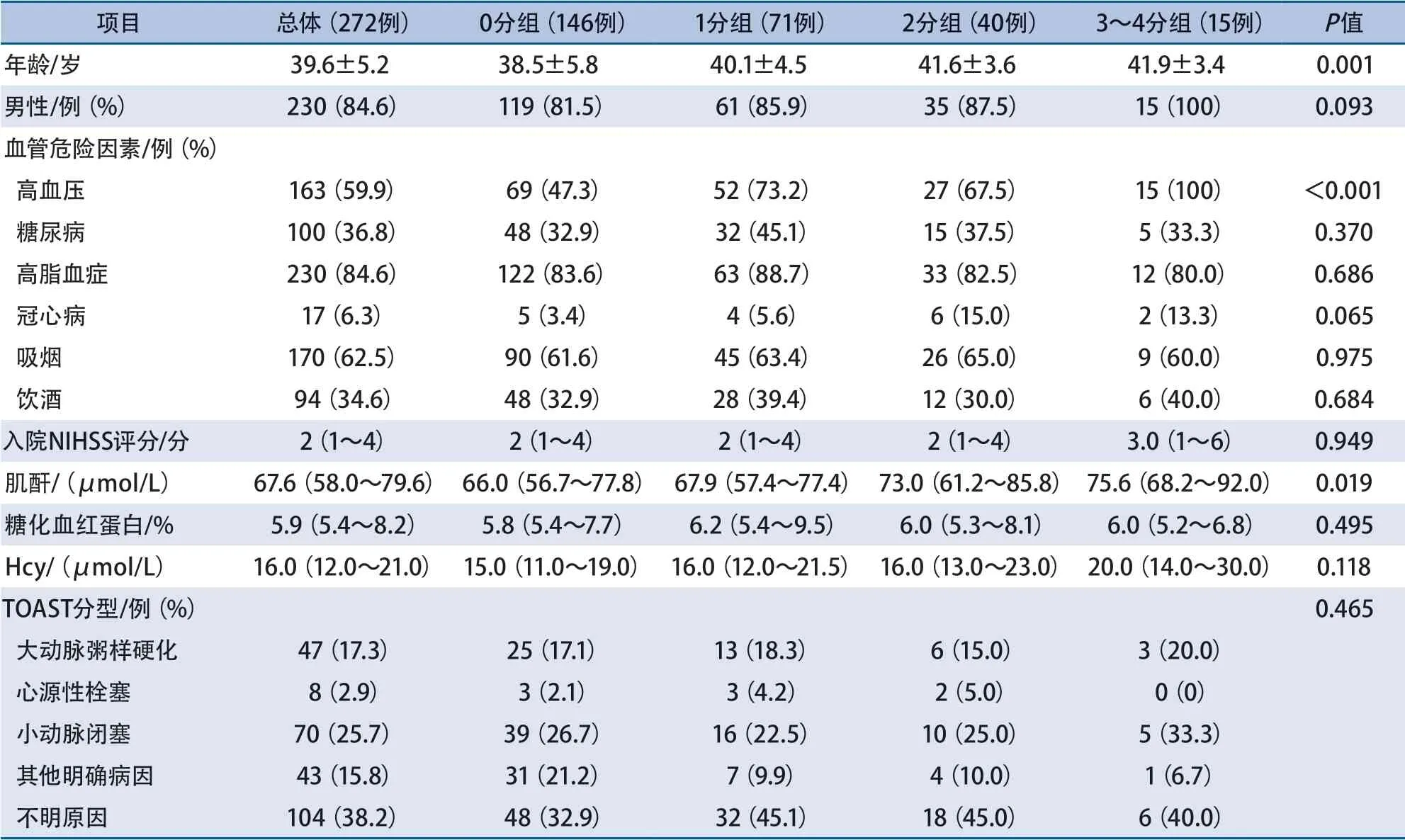
表1 不同脑小血管病总负荷评分组的基线资料比较
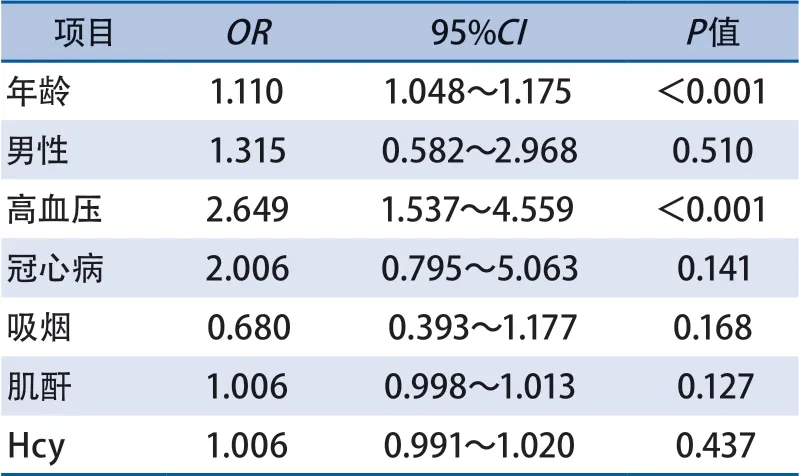
表2 脑小血管病总负荷评分的有序logistic回归分析
本研究有序logistic回归分析结果显示,增龄和高血压是CSVD总负荷评分的独立危险因素。既往研究主要探索青年缺血性卒中患者单一CSVD影像学标志物的危险因素,Fan等[5]研究发现高血压是青年首次缺血性卒中患者腔隙和WMH的危险因素,Shoamanesh等[6]发现高血压是青年卒中CMB的危险因素。另外有研究以健康成人为研究对象,探究CSVD总负荷的危险因素,结果发现年龄、高血压病史、血压水平与CSVD总负荷有关,该结果与本研究以青年卒中患者为研究对象的结果相似[17]。
目前CSVD的发病机制主要有内皮细胞损害学说、血脑屏障破坏学说、缺血低灌注学说、炎症反应学说和基因多态性学说[18],而高血压、年龄增长导致CSVD发生的可能机制分析如下。高血压、年龄增长等血管危险因素作用于脑小血管内膜导致脑血管内皮细胞损伤,发生炎症反应,小血管进而发生透明样变和纤维素样坏死,使管壁增生硬化、管腔狭窄,引起动脉供血区慢性缺血,在头颅MRI上可表现为WMH;另外,血管管腔狭窄和血管闭塞可引起腔隙性脑梗死;高血压等血管危险因素作用于脑小血管也可导致微血管瘤形成,血管壁破裂、血液外溢形成微出血灶,在头颅MRI上可表现为CMB[11,18]。CSVD内皮细胞出现功能损伤,血管壁通透性增加,血管内物质过量漏出至血管周围间隙,引起血管周围间隙的扩大,形成EPVS;脑内小血管内皮细胞间的紧密连接破坏,导致血脑屏障通透性增加,血管内物质漏出至血管周围间隙[19]。血管内漏出的物质在血管周围间隙积蓄,一方面可以直接使血管周围间隙扩张,另一方面还可以对血管周围组织造成损伤,导致神经细胞减少和脑实质萎缩,从而引起血管周围间隙扩大[19]。因此,高血压、年龄因素通过以上几种机制相互作用共同导致患者发生脑小血管病变,这也合理解释了CSVD的几种影像学表现同时存在的原因。
本研究还存在一些局限性。如本研究为回顾性研究,样本量较小,未对患者进行复发及功能转归的随访,可能使本研究结果存在一定偏倚,故未来还需多中心、前瞻性、大样本,以复发和功能转归为主要观察指标的研究,以期为临床提供理论依据。
【点睛】本研究发现增龄和高血压是青年缺血性卒中患者CSVD总负荷评分的独立危险因素。
