抗非洲猪瘟病毒单链抗体的构建、表达及活性鉴定
2021-05-28王丽娟石正旺罗俊聪郑海学
王丽娟,石正旺,杨 波,麻 园,罗俊聪,万 颖,宋 锐,田 宏,郑海学
(中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室 OIE/国家口蹄疫参考实验室,兰州 730046)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的一种高度致死性出血性疾病,病程短,死亡率高。世界动物卫生组织将其列为必须报告类疾病,我国将其列为一类动物疫病[1]。20世纪中叶之前,该病一直局限于非洲,之后逐步向欧洲蔓延[2]。2007年,随着Ⅱ型ASFV进入高加索地区,疫情逐渐扩散至俄罗斯及东欧地区[3-4],2018年8月,在我国辽宁省沈阳市首次发现该病,在1年时间内传播至我国32个省份,对我国养猪业造成重创[5-7]。除我国外,蒙古、越南、柬埔寨、老挝、朝鲜、菲律宾等国家也陆续出现非洲猪瘟疫情[8],该病毒几乎造成了全球性蔓延。
ASFV是一种具有囊膜的双链DNA病毒[9],其传染性和稳定性强,可通过受感染的猪肉制品和一些污染品进行传播,具有显著的接触传播特性[10-12]。目前国内外无有效的商品化疫苗防控ASFV[13],短期内依靠早期诊断与区域化防控管理来进行防治,中国农业科学院哈尔滨兽医研究所研制了该病毒的基因缺失苗,但该疫苗目前只取得了实验室阶段成果[14],因此,建立该病的快速准确诊断方法是控制该病的重要前提,而诊断方法的建立则与抗体的研发密不可分。
抗体是机体免疫系统中重要的免疫分子,也是疫苗和诊断试剂中的核心成分。传统的抗体多为单克隆抗体,产量高、特异性强,一度成为生物制剂中的重要组成部分[15]。ASFV具有庞大的基因组,约编码150多个蛋白质[16],依据主要衣壳蛋白P72,又分为24种基因型[17-18],传统的单克隆抗体已不足以应对此病毒,因此迫切需要一种安全有效的新型抗体。单链抗体(ScFv)是近些年生物领域里发展快速的一种新型抗体,只含有重链可变区与轻链可变区,由一段Linker序列连接,因此比常规抗体分子量小很多,是一种具有巨大治疗和诊断潜力的分子[19-20]。1996年,Mason等[21]首次报道了A12型口蹄疫病毒ScFv,自此,开启了ScFv的发展历程,后续研制出了ScFv多聚体、双特异性ScFv等多种形式抗体[22]。ScFv因其独特的分子结构而具有广泛的应用价值:较小的分子量使其具有很好的穿透性,易携带靶向药物进入细胞内部,从而为肿瘤诊断与治疗开辟了新的途径[23-24];双特异性ScFv是一类可以同时特异性结合两种不同抗原的人工改造抗体,将其应用到诊断技术上,可以拓展检测宽度,提高检测灵敏度;ScFv作为一种人工合成的基因工程抗体,一方面易于进行分子的改造,可直接对靶细胞产生杀伤作用[25-26];另一方面可以在原核表达系统中大量生产,极大地缩短抗体制备周期。ScFv最突出的特点是克服了传统单克隆抗体鼠源性强的特点,消除了抗体应用上的异源性反应,扩宽了抗体的应用范围。综上所述,它独特的生物学特性与广泛的应用前景,使其有望成为科研攻坚上的新型利器。
本研究通过分离ASFV感染康复猪外周血淋巴细胞,扩增猪源ScFv基因,制备了一种分子量小、灵敏度高的抗ASFV单链抗体,为ASFV诊断提供新型原材料。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 LTS1110猪外周血淋巴细胞分离液Kit购自天津灏洋生物制品公司;pMDTM20-T载体、E.coliJM109感受态、PrimeSTAR®HS DNA Polymerase、RNase-free Water、DL2000 DNA Marker、6×Loading Buffer均购自宝生物公司;Unstained protein MW marker(26610)、Unstained protein MW marker(26616)、6×His Tag Monoclonal Antibody(HIS.H8),HRP、6x-His Tag Monoclonal Antibody (HIS.H8),Alexa Fluor 555均购自Thermo Fisher Scientific公司;Goat Anti-Pig IgG H&L (HRP) (ab6915)购自Abcam公司;BL21(DE3)感受态购自北京全式金;Trizol、镍柱亲和层析树脂、DNA片段回收试剂盒和质粒提取试剂盒为OMEGA产品;分子生物学试剂来自Sigma公司;其他生化试剂均为国产分析纯;ASFV感染康复猪、ASFV阴阳性血清及ASFV CN/GS/2018分离株均由国家非洲猪瘟区域实验室(兰州)提供。
1.1.2 引物设计 根据GenBank上收录的猪IgG重链(AK405798)、轻链Kappa链(EU683881)、轻链Lamda链(AF345512)基因序列,参考文献设计扩增猪IgG可变区的引物。引物序列如表1所示,其中 VH-F1、VH-R1,VLκ-F1、VLκ-R11、VLκ-R12、VLκ-R13,VLλ-F1、VLλ-R1用于第1轮扩增;VH-F1、VH-R2,VLκ-F2、VLκ-R11、VLκ-R12、VLκ-R13,VLλ-F2、VLλ-R1用于第2轮扩增;VH-F1、VLλ-R1、VLκ-R11、VLκ-R12、VLκ-R13用于第3轮扩增。引物由大连宝生物有限公司合成。

表1 重链及轻链目的片段扩增引物Table 1 Primers set used for heavy and light chain variable genes amplification
1.2 模板的制备
1.2.1 猪外周血淋巴细胞提取 采集ASFV感染康复猪的外周血,用LTS1110猪外周血淋巴细胞试剂盒进行猪外周血淋巴细胞的分离:①向外周血中加入等量全血稀释液,混匀。②离心管中量取与稀释后血液等量的分离液,将稀释后血液缓慢加入,使其平铺于分离液液面,1 800 r·min-1,水平离心30 min。③小心吸取第二层白色淋巴细胞,加入10 mL 清洗液,1 500 r·min-1水平离心10 min。④弃 上清,以5 mL清洗液重悬,1 500 r·min-1水平离心10 min。⑤弃上清,以1 mL RNA Later保存液重悬,置-80 ℃保存备用。
1.2.2 淋巴细胞总RNA提取 采用Trizol试剂提取法提取淋巴细胞总RNA,经Thermo公司的Thermo Nano Drop One检测,所提取的总RNA浓度为356 ng·μL-1,OD260 nm/OD280 nm为1.87。
1.3 抗体可变区基因的扩增
1.3.1VH基因及VH-Linker基因扩增 以提取的淋巴细胞总RNA为模板,反转录得到全基因组cDNA。以cDNA为模板,VH-F1和VH-R1为引物,扩增VH基因。反应程序:98 ℃ 2 min;98 ℃ 10 s、52 ℃ 5 s、72 ℃ 30 s、30个循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集VH。
以VH基因为模板,VH-F1和VH-R2为引物,扩增VH-Linker基因。反应程序:98 ℃ 2 min;98 ℃ 10 s、56 ℃ 5 s、72 ℃ 30 s、35个循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集VH-Linker。
1.3.2VLλ基因及Linker-VLλ基因扩增 以cDNA为模板,VLλ-F1和VLλ-R1为引物,扩增VLλ基因。反应程序:98 ℃ 2 min;98 ℃ 10 s、53 ℃ 5 s、72 ℃ 30 s、30个循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集VLλ。
以VLλ基因为模板,VLλ-F2和VLλ-R1为引物,扩增Linker-VLλ基因。反应程序:98 ℃ 2 min;98 ℃ 10 s、68 ℃ 30 s、35个循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集Linker-VLλ。
1.3.3VLκ基因及Linker-VLκ基因扩增 以cDNA为模板,VLκ-F1和VLκ-R11、VLκ-R12、VLκ-R13为引物,扩增VLκ基因。反应程序:98 ℃ 2 min;98 ℃ 10 s,54 ℃ 5 s,72 ℃ 30 s,30个循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集VLκ。
以VLκ基因为模板,VLκ-F2和VLκ-R11、VLκ-R12、VLκ-R13为引物,扩增Linker-VLκ基因。反应程序:98 ℃ 2 min;98 ℃ 10 s,68 ℃ 30 s,30个 循环;72 ℃ 10 min;将扩增产物进行琼脂糖凝胶电泳,纯化收集Linker-VLκ。
1.3.4 ScFv(VH-Linker-VL)基因扩增 分别以VH-Linker和Linker-VLλ、VH-Linker和Linker-VLκ为模板,以VH-F1、VLλ-R1和VH-F1、VLκ-R11、VLκ-R12、VLκ-R13为引物,通过SOE-PCR技术扩增拼接VH-VLκ和VH-VLλ。反应程序如下,①无引物:98 ℃ 2 min;98 ℃ 10 s,68 ℃ 30 s,10个循环;72 ℃ 10 min。②有引物:98 ℃ 2 min;98 ℃ 10 s、55 ℃ 5 s,72 ℃ 50 s,35个循环;72 ℃ 10 min。将扩增产物进行琼脂糖凝胶电泳,纯化收集VH-VLκ和VH-VLλ。
1.4 T-A克隆鉴定及pET-30a-ScFv质粒的构建
将ScFv(VH-VL)基因连接至pMDTM20-T载体上,进行质粒PCR鉴定,取PCR扩增产物进行琼脂糖凝胶电泳,挑选条带大小合适的质粒送测序。对测序结果进行比对分析,挑选正确的基因序列送武汉金开瑞公司进行pET-30a-ScFv质粒的构建。
1.5 ScFv抗体的表达与纯化
将构建成功的pET-30a-ScFv质粒转化至BL21(DE3)感受态细胞,每50 μL感受态细胞分别转化1 μL pET-30a-ScFv质粒,将转化的菌液均匀涂布于LB-K+平板上,37 ℃倒置培养12~16 h直至单克隆出现,挑取单克隆菌落于LB-K+液体培养基中,37 ℃诱导表达抗体蛋白,对表达的抗体蛋白进行收集、洗涤、纯化,即得抗ASFV ScFv抗体。
1.6 VH-VLλ11抗体ELISA活性鉴定
1.6.1 VH-VLλ11包被检测板鉴定ASFV 取纯化的ScFv抗体VH-VLλ11(0.1 mg·mL-1),按照1∶4 的比例包被检测板,包被完成后,加入50 μL 灭活ASFV,37 ℃温箱孵育30 min,250 μL PBST洗涤液洗涤4次,拍干,分别加入50 μL 1∶5稀释的ASFV阳性血清2孔、1∶5稀释的健康猪血清2孔、血清稀释液2孔,37 ℃温箱孵育30 min,250 μL PBST洗涤液洗涤4次,拍干,加入50 μL 1∶15 000稀释的 HRP标记的猪二抗,37 ℃温箱孵育30 min,250 μL PBST洗涤液洗涤4次,拍干,加入50 μL TMB底物溶液,37 ℃温箱孵育15 min,加入50 μL终止液(H2SO4),在分光光度仪上读取反应物的OD450 nm值。
1.6.2 ASFV抗原包被检测板鉴定VH-VLλ11取P73兔抗1∶1 000包被检测板,4 ℃包被12 h后弃掉,PBST洗涤4次,拍干,再加入1∶1稀释的ASFV全病毒抗原,包被完成后,分别加入50 μL 1∶16 稀释的VH- VLλ11抗体蛋白(0.4 mg·mL-1)、稀释液各2孔,37 ℃温箱孵育30 min,250 μL PBST洗涤液洗涤4次,拍干,加入50 μL 1∶5 000稀释的兔抗猪HIS-HRP,37 ℃孵育30 min,250 μL PBST洗涤液洗涤4次,拍干,加入50 μL TMB底物溶液,37 ℃孵育15 min,加入50 μL终止液(H2SO4),于酶标仪上读取OD450 nm值。
1.7 VH-VLλ11抗体间接免疫荧光试验
以ASFV接种猪PAMS细胞,同时设立阴性对照,4%多聚甲醛固定30 min,PBS洗3次,0.1% Triton-100室温透膜15 min,PBS洗3次,再以5% Blocker BSA室温封闭15 min后,加入VH-VLλ11抗体(1∶200)4 ℃孵育过夜,PBS洗3次,6×-His Tag Monoclonal Antibody (HIS.H8),Alexa Fluor 555(1∶60)室温避光染色1 h,PBS洗3次,加入DAPI染核10 min,PBS洗3次,上镜观察。
2 结 果
2.1 VH及VL基因的扩增鉴定
将扩增的VH及VL基因进行1%的琼脂糖凝胶电泳鉴定,由结果可知在300 bp左右出现了明显的条带,条带大小与预期的目的条带大小相一致,见图1。
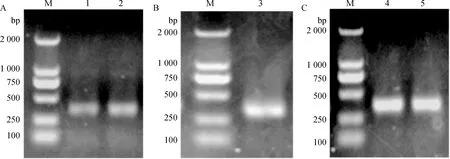
A.VH基因扩增产物;B.VLκ基因扩增产物;C.VLλ基因扩增产物;M.DNA相对分子质量标准;1~2.VH;3.VLκ;4~5.VLλA.VH gene amplification product;B.VLκ gene amplification product;C.VLλ gene amplification product;M.DL2000 DNA marker,1-2.VH;3.VLκ;4-5.VLλ图1 猪源抗体VH及VL基因扩增Fig.1 Porcine antibody VH and VL gene amplification
2.2 VH-Linker及Linker-VL基因的扩增鉴定
将扩增的VH及VL基因进行1%的琼脂糖凝胶电泳鉴定,结果可见在320 bp左右出现了明显的条带,条带大小与预期的目的条带大小相一致,见图2。

A.VH-Linker基因扩增产物;B.VLκ-Linker基因扩增产物;C.VLλ-Linker基因扩增产物;M.DNA相对分子质量标准;1.VH-Linker;2~3.VLκ-Linker;4~5.VLλ-LinkerA.VH-Linker gene amplification product;B.VLκ-Linker gene amplification product;C.VLλ gene amplification product;M.DL2000 DNA marker,1.VH-Linker;2-3.VLκ-Linker;4-5.VLλ-Linker图2 猪源抗体VH-Linker及VL-Linker基因扩增Fig.2 Porcine antibody VH-Linker and VL-Linker gene amplification
2.3 ScFv(VH-Linker-VL)基因的扩增鉴定
将SOE-PCR扩增拼接得到的VH-Linker-VL基因进行1%的琼脂糖凝胶电泳鉴定,结果可见在约800 bp左右出现了明显的条带,条带大小与预期的目的条带大小相一致,见图3。
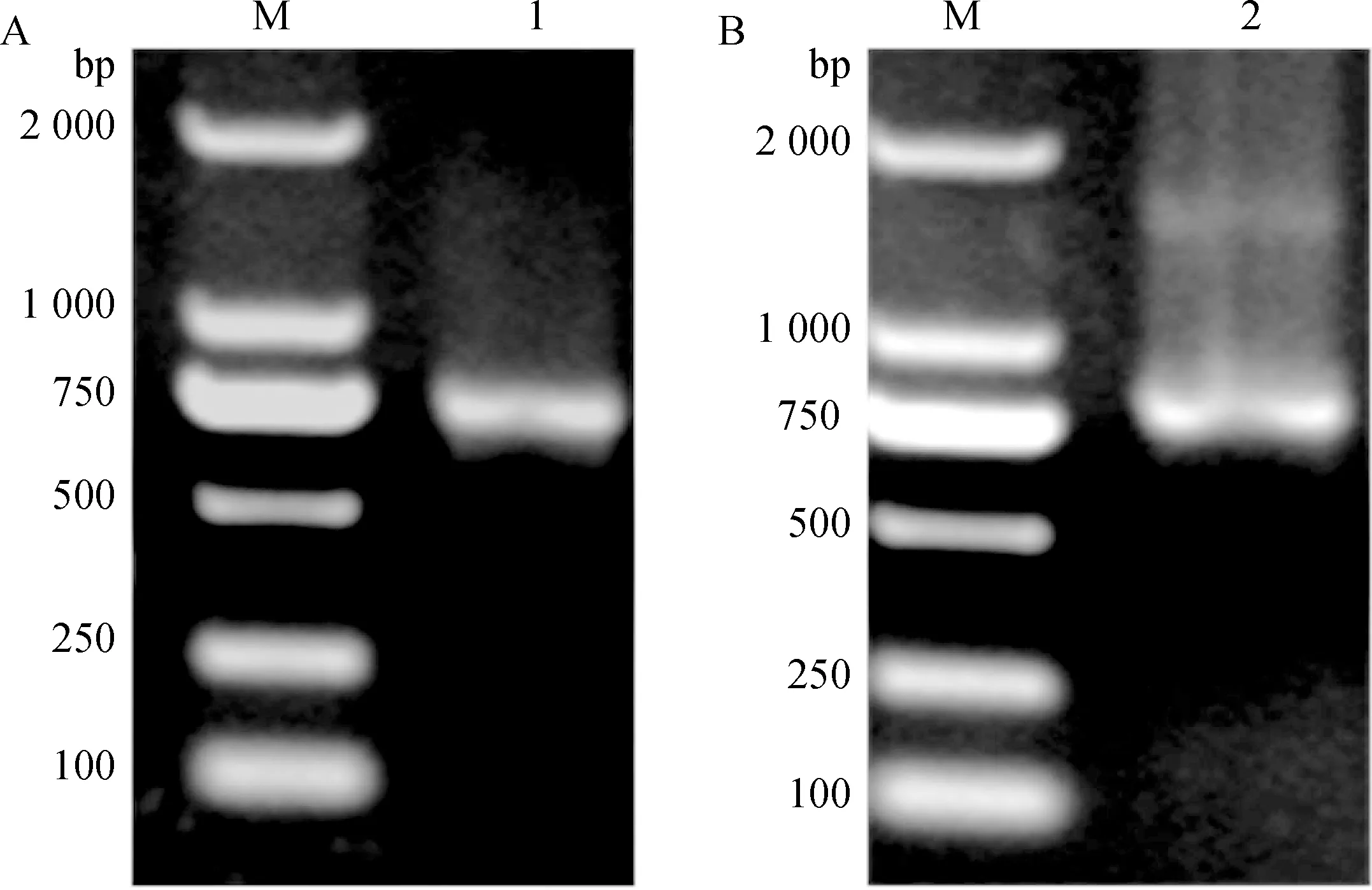
A.VH-Linker-VLλ基因扩增产物;B.VH-Linker-VLκ基因扩增产物;M.DNA相对分子质量标准;1.VH-Linker-VLλ;2.VH-Linker-VLκA.VH-Linker-VLλ gene amplification product;B.VH-Linker-VLκ gene amplification product;M.DL2000 DNA marker;1.VH-Linker-VLλ;2.VH-Linker-VLκ图3 猪源抗体ScFv(VH-Linker-VL)基因扩增Fig.3 Porcine antibody ScFv(VH-Linker-VL) gene amplification
2.4 T-A克隆鉴定及pET-30a-ScFv质粒构建
将构建的pMDTM20-T-ScFv(VH-Linker-VL)质粒送杨凌天润奥科生物科技有限公司进行测序,共挑选了17个单克隆,经测序后发现其序列与NCBI网站上公布的猪IgG可变区序列的框架区基本一致、CDR区存在差异,符合猪IgG轻重链可变区基因结构。将以上基因序列进行pET-30a-ScFv质粒的构建,VH-Linker-VL位于pET-30a的NdeⅠ和XhoⅠ酶切位点之间。
其中,VH-Linker-VLλ11测序结果如图4所示。
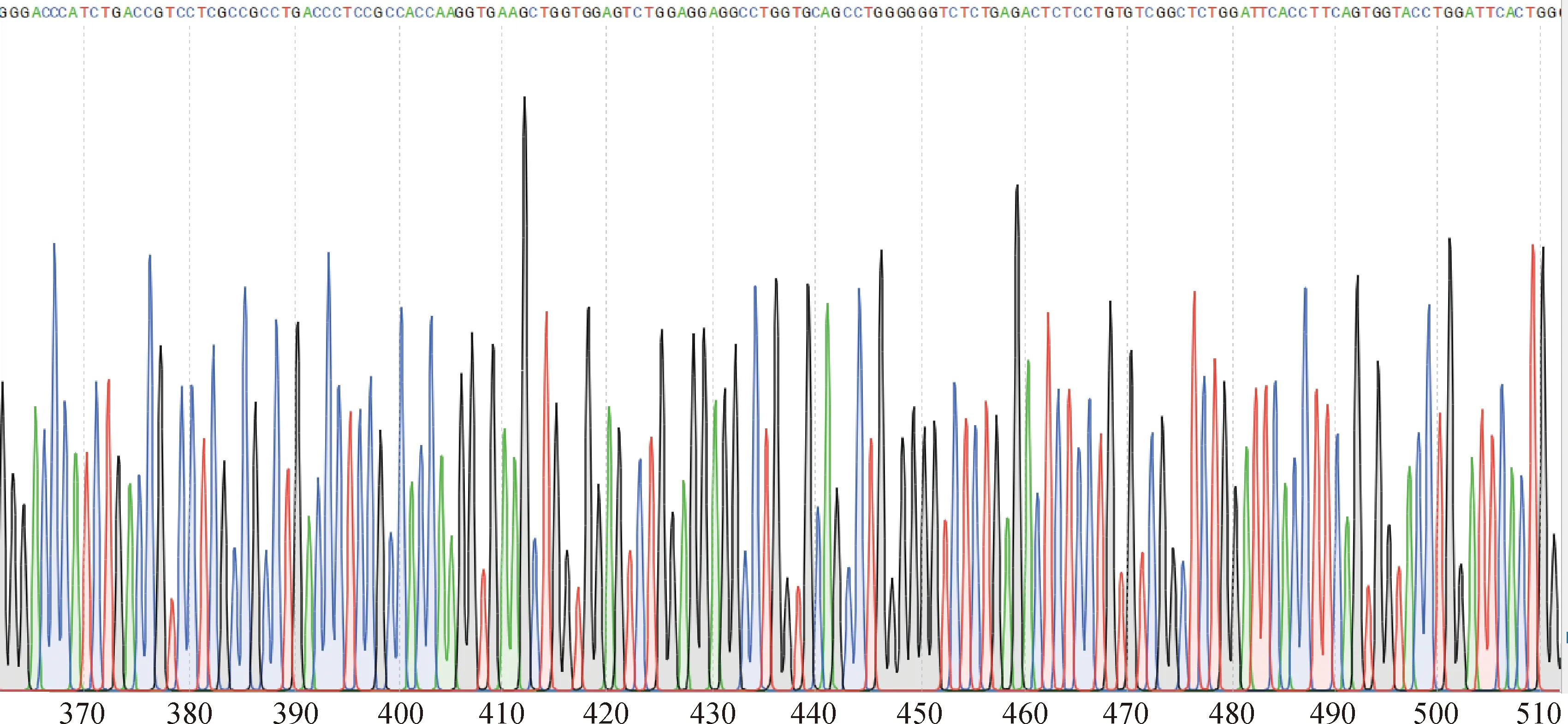
图4 pMDTM20-T-ScFv(VH-VLλ11)质粒测序峰图Fig.4 pMDTM20-T-ScFv (VH-VLλ11) plasmid sequencing peak map
2.5 ScFv抗体的制备
对构建的pET-30a-ScFv质粒进行抗体蛋白的诱导表达。结果显示:仅pET-30a-VH-VLλ11在37 ℃ 诱导后出现1条27 ku的特异蛋白条带(包涵体),大小与预期相符,并在诱导剂浓度为1/1 000,诱导时间为6 h时,ScFv抗体表达量达高峰。将表达的VH-VLλ11抗体进行镍柱纯化,结果如图5所示。
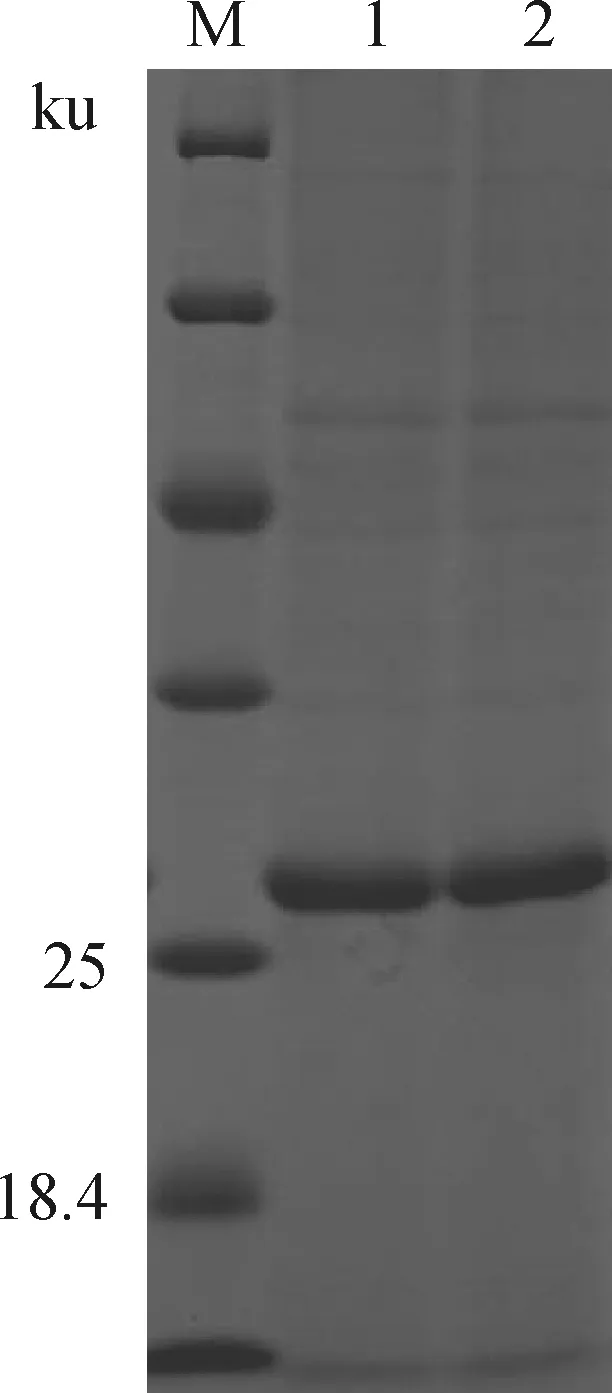
M.未染色蛋白质分子标准(26610);1、2.ScFv抗体(VH- VLλ11)M.Unstained protein MW marker (26610);1,2.ScFv antibody(VH- VLλ11)图5 pET-30a-ScFv(VH-VLλ11)抗体蛋白纯化浓缩Fig.5 pET-30a-ScFv (VH-VLλ11) antibody protein purification concentration map
2.6 VH-VLλ11抗体ASFV反应活性鉴定
2.6.1 VH-VLλ11包被检测板鉴定ASFV 将表达纯化的VH-VLλ11抗体蛋白包被检测板鉴定其与ASFV的反应活性,结果显示VH-VLλ11抗体具有ASFV反应活性,如图6所示。
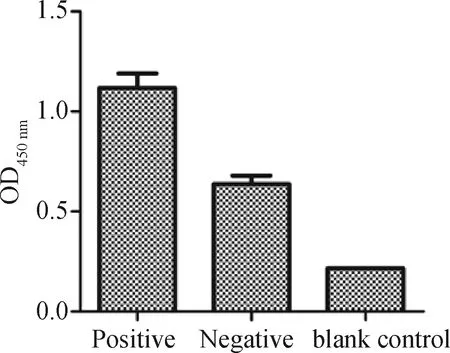
图6 VH-VLλ11包被检测板鉴定ASFVFig.6 Identification of ASFV coated with VH-VLλ11
2.6.2 ASFV抗原包被检测板鉴定VH-VLλ11以P73兔抗捕获ASFV抗原包被检测板检测纯化的VH-VLλ11抗体蛋白,结果显示,VH-VLλ11抗体蛋白与ASFV具有反应性,如图7所示。
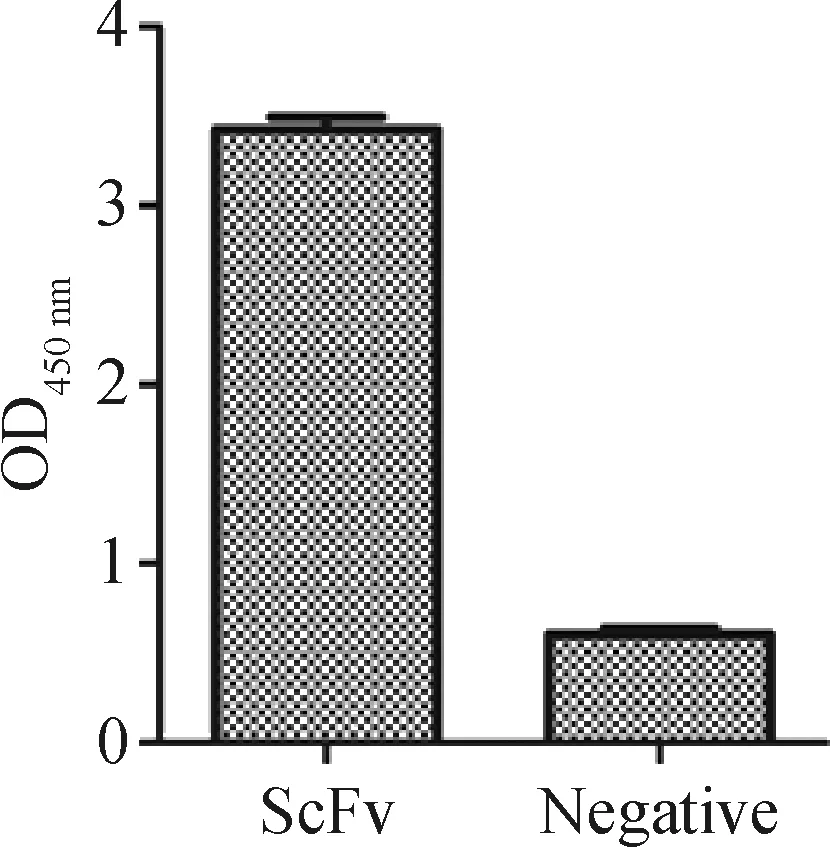
图7 ASFV包被检测板鉴定VH-VLλ11Fig.7 Identification of VH-VLλ11 coated with ASFV
2.6.3 VH- VLλ11抗体间接免疫荧光鉴定 以6×-His Tag Monoclonal Antibody (HIS.H8),Alexa Fluor 555进行VH-VLλ11抗体的荧光染色,结果显示VH-VLλ11可与处于细胞质中的ASFV发生反应,如8所示。
3 讨 论
目前,ASFV对全球养猪业造成了巨大威胁,中国作为养猪大国,猪肉更是老百姓的日常肉类主要来源。自2018年我国暴发非洲猪瘟疫情以来,猪肉价格大幅上涨,给百姓的日常生活带来了极大的影响。科研学者夜以继日,积极进行ASFV疫苗的研发,但目前全球还未有商品化的ASFV疫苗,因此,ASF的快速诊断对防控该病至关重要。抗体作为诊断方法中的核心成分,是决定诊断方法优劣的重要因素,在本研究中,主要致力于制备一种分子量小、穿透力强、异源性低的ScFv。
本研究通过分离了ASFV感染康复猪的外周血淋巴细胞,从中提取RNA来作为扩增模板,考虑到猪的抗体轻链类型有λ型和κ型两种,作者在设计引物时分别设计了两种轻链类型的引物,并通过在引物5′端添加Linker序列(一段由甘氨酸和丝氨酸组成的多肽链),利用重叠PCR(SOE-PCR)扩增得到VH-VLκ和VH-VLλ两种基因。BLAST比对结果显示,获取的基因与NCBI网站上公布的猪IgG重链与轻链基因的相似性均达80%以上,后由公司代为构建pET-30a-ScFv表达质粒,最终通过大肠杆菌表达系统表达得到VH-VLλ11抗体蛋白。
将表达的蛋白纯化后进行ELISA检测技术及IFA试验验证,证实VH-VLλ11抗体蛋白具有ASFV反应活性,但反应活性较低,这与ScFv亲和力低的特性相一致,其主要原因主要有两点:一是由于ScFv与常规抗体相比,少了Fc结构域,Fc结构域的缺失虽然能够降低抗体的异源反应[27],但也在一定程度上影响了抗体亲和力,二是因为ScFv的表达多选择大肠杆菌表达系统,其独特的还原性环境,影响了抗体表达过程中二硫键的形成,导致所表达的抗体蛋白多以包涵体的形式存在[28],从而掩盖了抗体的部分抗原表位,降低了抗体亲和力。当然,ScFv亲和力低的问题可以通过优化表达系统、增加伴侣蛋白等方式解决[29]。
本研究制备了一种与ASFV具有反应性的ScFv,后续可以应用ScFv作为捕获抗体或者检测抗体,建立检测ASFV的ELISA方法,或者包被灭活ASFV,应用抗ASFV ScFv建立竞争或者阻断ELISA方法。此抗体的成功制备填补了目前市场上ASFV ScFv抗体的空白,克服了单克隆抗体制备周期长、异源性强的问题,为ASF的诊断提供了新的原材料。
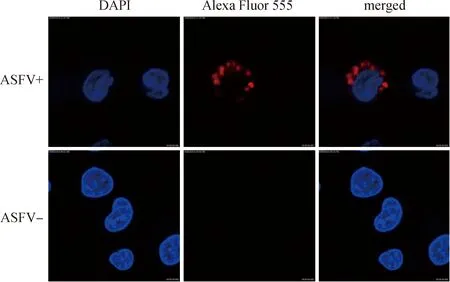
图8 VH-VLλ11的间接免疫荧光试验Fig.8 Indirect immunofluorescence experiment of VH-VLλ11
4 结 论
通过分离ASFV感染康复猪外周血淋巴细胞,提取淋巴细胞总RNA,应用SOE-PCR技术成功获得猪源ScFv基因,然后应用大肠杆菌表达系统表达ScFv基因,经过ELISA和IFA鉴定,成功获得1株具有ASFV反应活性的猪源ScFv(VH- VLλ11),为ASF的诊断注入新力量。
