梅毒血清固定患者NLRP3炎症小体及细胞因子表达的研究
2021-05-28鲁东平张荣王芬魏少凤贾婕张伟莲刘婷梁瑞杨文志
鲁东平 张荣 王芬 魏少凤 贾婕 张伟莲 刘婷 梁瑞 杨文志
1深圳市宝安中医院(集团)(广东深圳518133);2深圳市宝安区慢性病防治院皮肤科(广东深圳518133);3鄂东医疗集团黄石市妇幼保健院产科(湖北黄石435000);4深圳市宝安区中心医院(广东深圳518102)
梅毒血清固定是早期梅毒治疗后血清学结果长期保持阳性的一种特殊状态,随着梅毒发病率增长迅速,诊断为梅毒血清固定的病例也有明显增加[1],梅毒血清固定患者体内有没有梅毒螺旋体(Tp)存在?有没有必要反复治疗?诸多疑惑困扰着患者,他们的身心健康及家庭关系受到影响[2]。在临床随访工作中这种现象比较普遍,但是目前关于该病的成因还不清楚。
核苷酸结合寡聚化结构域样受体家族蛋白3(NLRP3)炎症小体是细胞内的一个多蛋白复合物,由NLRP3、凋亡相关点样蛋白(ASC)和前体胱天蛋白酶⁃1(Pro⁃caspase⁃1)组成,是天然免疫中重要的模式识别受体,通过信号传导,激活炎症因子;一旦该信号通路被激活,会诱导IL⁃1β和IL⁃18的分泌和成熟,它们会在感知细菌、螺旋体等的感染的天然免疫中,以及在宿主对感染而产生的获得性免疫反应中起着重要作用[3-4]。已有报道证实在兔模型中NLRP3炎症小体参与了梅毒感染引起的炎症过程[5],但是它们是否与梅毒血清固的形成相关尚未见报道,本实验采用实时荧光定量PCR(qRT⁃PCR)检测梅毒血清固定患者及健康人的外周血单核细胞NLRP3炎症小体的表达,探讨NLRP3信号通路相关因子在梅毒血清固定患者中的作用,从天然免疫方向来研究梅毒血清固定可能的发病机制,为该病的防治提供理论依据。
1 对象与方法
1.1 研究对象与分组病例的选择:选取2018年9月至2020年9月在我院就诊时已确诊为梅毒血清固定患者50例作为实验组,其中男26例,女24例,年龄22~40岁,平均(26.3±4.2)岁;纳入标准:(1)配偶或患者有不洁性交史;(2)每例病人均已接受过规范的梅毒治疗方案驱梅治疗,无临床症状或治疗后临床症状消失;(3)3年随访期间经TRUST、TPPA检测均阳性,第一年每3个月有复查1次,第二年每6月复查血清1次,第三年复查血清1次;在随访期间滴度无下降或上升4倍的情况,TRUST滴度均≤1∶8;(4)HIV抗体检测阴性;无生物学假阳性;(5)配偶或性伴长期性接触未被传染,育龄女性分娩的婴儿未被传染。实验组所有研究对象同时满足以上5个条件[6]。
健康对照组的选择:根据两组年龄和性别构成选健康志愿者50例作为对照组,其中男24例,女26例,年龄24~41岁,平均(25.8±4.1)岁;纳入标准:(1)HIV抗体检测阴性;(2)血清学TRUST连续两次(间隔1月复查)检查阴性。对照组所有研究对象同时满足以上2个条件。两组性别、年龄分布差异无统计学意义(P>0.05)。本研究符合医院伦理委员会要求。
排除标准:排除患有2型糖尿病、肥胖、痛风、矽病、阿尔茨海默病及克罗恩病等已知的可以影响NLRP3炎症小体信号通路的疾病;排除各种急慢性感染性疾病、严重的肺部疾病、肝脏及肾脏疾病。
1.2 方法
1.2.1 样本收集采集来我院就诊的梅毒血清固定患者(50例)及健康志愿者(50例)的外周血。采集前,进行常规消毒采集点及周围皮肤,经肘部静脉采集外周静脉血8 mL,共分二管,迅速置于肝素化的抗凝管中。
1.2.2 实时荧光定量PCR(qRT⁃PCR)采用Ficoll⁃Hypaque淋巴细胞分离液密度梯度离心法,分离各样本PBMCs;采用Trizol(大连TaKaRa公司)法提取PBMCs中的mRNA;用BioMate 3S分光光度计测量260 nm和280 nm波长处理的OD值检测mRNA纯度、含量及完整性;使用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(大连TaKaRa公司)进行qRT⁃PCR。简要步骤为先去除基因组DNA;随后立即进行逆转录,体系如下:37℃,15 min;85℃,5 s;4℃保存;最后于Bio⁃荧光定量PCR仪(美国伯乐BIO⁃RAD公司)进行Real Time PCR扩增;扩增条件:预变性95℃,30 s;PCR反应40个循环,变性95℃,5 s;复性延伸60℃,30~60 s;PCR各基因所用引物引物由生工生物工程(上海)股份有限公司合成序列如表1;结果目的基因的表达水平通过GAPDH(glyceraldehyde⁃3⁃phosphate de⁃hydrogenase)进行归一化处理,采用2⁃ΔΔCt法对目的基因进行相对定量。

表1 qRT⁃PCR所用引物Tab.1 Primers used for qRT⁃PCR in this study
1.2.3 ELISA测定血清IL⁃1β和IL⁃18的含量取抗凝血4 mL,迅速室温1 000×g离心30 min收集样本,小心取上清,分装后-20℃储存。采用Hu⁃man IL⁃1β High Sensitivity ELISA Kit(人白介素1β高敏ELISA试剂盒)和Human IL⁃18 ELISA Kit(人白介素18 ELISA试剂盒)购自杭州联科生物技术股份有限公司,测定IL⁃1β和IL⁃18的含量,步骤严格参照试剂盒说明书进行。
1.2.4 统计学方法利用GraphPad Prism 8统计学软件进行统计分析,各项检测结果均采用均值±标准误表示。基因相对表达量及细胞因子水平的组间比较采用两独立样本t检验。以α=0.05为检验标准,P<0.05为差异有统计学意义。
2 结果
2.1 梅毒血清固定患者PBMCs中NLRP3、ASC及Caspase⁃1 mRNA的表达统计学结果显示,梅毒血清固定组PBMCs中NLRP3、ASC及Caspase⁃1 mRNA的表达均低于健康组,差异均有统计学意义(P<0.05,图1),mRNA具体的相对表达量见表2。
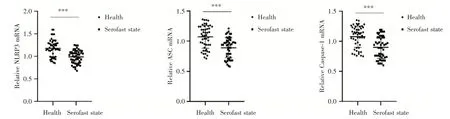
图1 梅毒血清固定患者PBMCs中NLRP3、ASC及Caspase⁃1 mRNA的表达水平Fig.1 Expression of NLRP3,ASC and Caspase⁃1 mRNA in PBMCs of patients with syphilis serofast state
表2 PBMCs中NLRP3、ASC及Caspase⁃1 mRNA的相对表达量Tab.2 The relative expression of NLRP3,ASC and Caspase⁃1 mRNA in PBMCs ±s
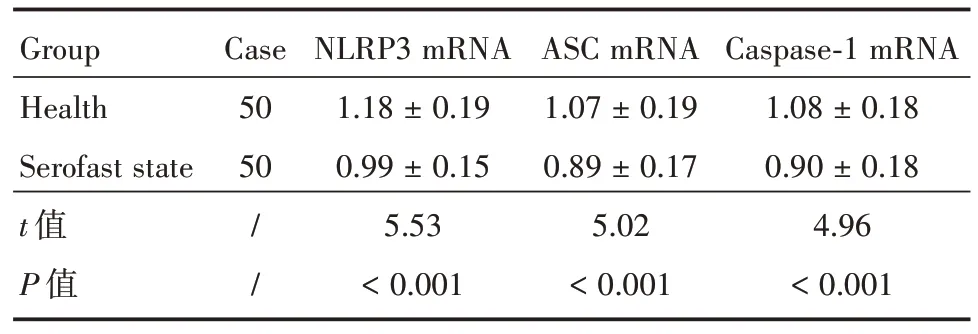
表2 PBMCs中NLRP3、ASC及Caspase⁃1 mRNA的相对表达量Tab.2 The relative expression of NLRP3,ASC and Caspase⁃1 mRNA in PBMCs ±s
Group Health Serofast state t值P值Case 50 50/ /NLRP3 mRNA 1.18±0.19 0.99±0.15 5.53<0.001 ASC mRNA 1.07±0.19 0.89±0.17 5.02<0.001 Caspase⁃1 mRNA 1.08±0.18 0.90±0.18 4.96<0.001
2.2 梅毒血清固定患者PBMCs中IL⁃1β及IL⁃18 mRNA的表达统计学分析显示,梅毒血清固定患者PBMCs中IL⁃1β及IL⁃18mRNA的表达水平均较健康者低,差异均有统计学意义(P<0.05,图2),mRNA具体的相对表达量见表3。
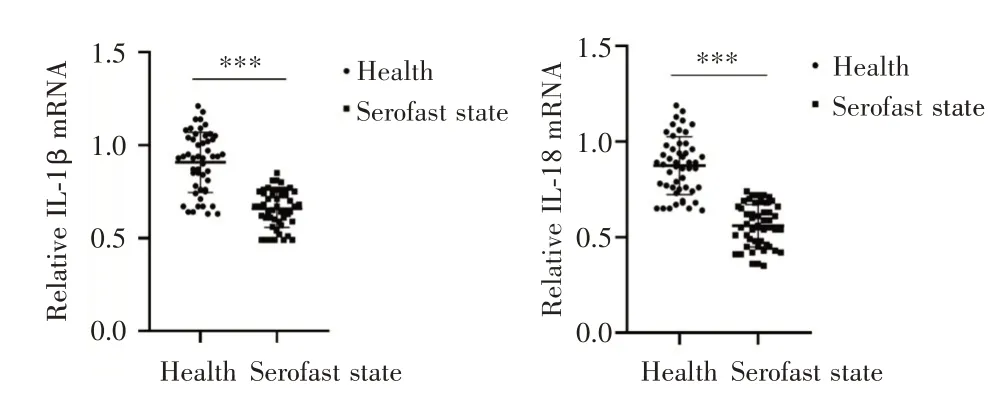
图2 梅毒血清固定患者PBMCs中IL⁃1β和IL⁃18 mRNA的表达水平Fig.2 Expression of(A)IL⁃1β and(B)IL⁃18 mRNA in PBMCs of patients with syphilis Serofast state
2.3 梅毒血清固定患者血清中的IL⁃1β和IL⁃18含量统计学结果显示,梅毒血清固定患者血清 中IL⁃1β和IL⁃18的含量均低于健康者,差异均有统计学意义(P<0.05,图3),具体表达量见表4。
表3 PBMCs中IL⁃1β及IL⁃18 mRNA的相对表达量Tab.3 The relative expression of IL⁃1β and IL⁃18 mRNA in PBMCs±s
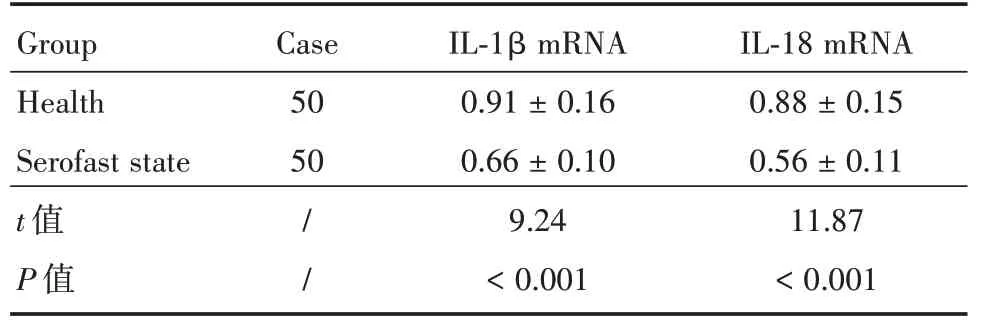
表3 PBMCs中IL⁃1β及IL⁃18 mRNA的相对表达量Tab.3 The relative expression of IL⁃1β and IL⁃18 mRNA in PBMCs±s
GroupCaseIL⁃1β mRNAIL⁃18 mRNA Health500.91±0.160.88±0.15 Serofast state t值P值50/ /0.66±0.10 9.24<0.001 0.56±0.11 11.87<0.001
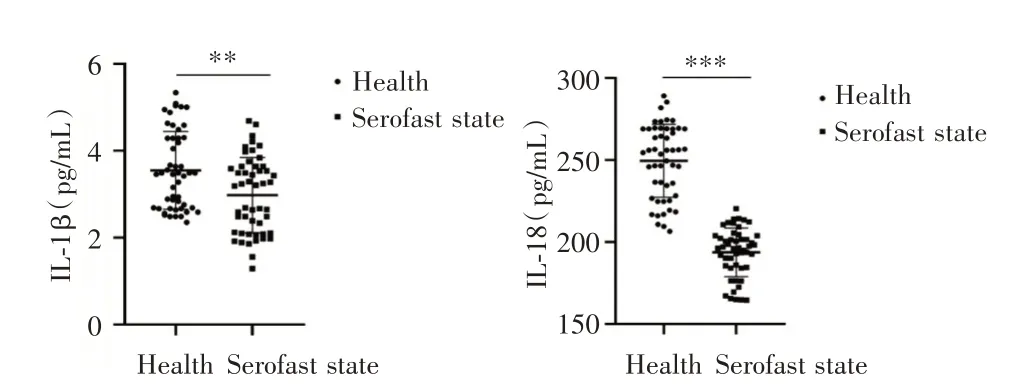
图3 梅毒血清固定患者血清中IL⁃1β和IL⁃18的水平Fig.3 IL⁃1 β and IL⁃18 in serum of patients with syphilis serofast state
表4 血清中IL⁃1β及IL⁃18水平的差异Tab.4 Difference of IL⁃1β and IL⁃18 levels in serum±s
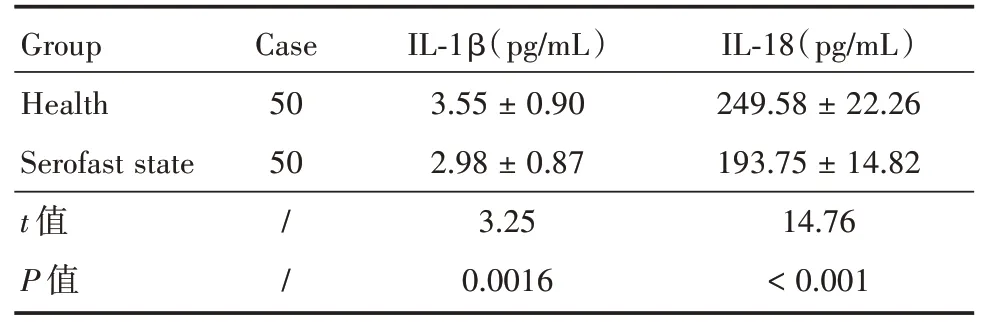
表4 血清中IL⁃1β及IL⁃18水平的差异Tab.4 Difference of IL⁃1β and IL⁃18 levels in serum±s
GroupCaseIL⁃1β(pg/mL)IL⁃18(pg/mL)Health images/BZ_84_1404_2704_1566_2755.png3.55±0.90249.58±22.26 Serofast state502.98±0.87193.75±14.82 t值/3.2514.76 P值 /0.0016<0.001
3 讨论
早期梅毒患者确诊后经规范用驱梅治疗,绝大部分患者的临床症状完全消失,达到临床治愈,但有部分患者治疗后梅毒血清学试验在很长时间内不会转阴,表现为梅毒血清固定,已有报道其发生率约为15%~44.4%[7-8]。在临床随访过程中这样的患者有很多,目前其发病机制尚不清楚,让医患都感到困惑。该病的相关研究主要在获得性免疫方面,关杨等[9-10]认为梅毒血清固定患者存在严重的细胞免疫失衡和免疫抑制,从而使少量的TP逃脱机体免疫系统的捕获,导致慢性感染;周平玉[11]则认为:梅毒血清固定可能是机体的一种特殊的免疫状态而非TP的持续存在。为了弄清楚其成因,近来国内外的学者对天然免疫在梅毒血清固定形成中的作用开展了一些研究,并认为天然免疫在其中也有重要的作用[12-14]。NLRs家族的NLRP3炎症小体在调节天然和获得性免疫反应时,因其具有参与免疫和抗微生物等重要作用而备受关注[15]。已有研究表明NLRP3炎症小体在梅毒感染免疫中发挥了重要作用[15],但目前国内外文献中未见关于NLRP3炎症小体与梅毒血清固定的形成关系的报道。本研究采用病例对照研究的方法,通过qRT⁃PCR检测梅毒血清固定患者和健康者PBMCs中NLRP3炎症小体及细胞因子,探究NLRP3炎症小体与梅毒血清固定的形成关系。
NLRP3炎性小体是NLRs家族成员中被研究最多的受体,它是一种存在于细胞质中的蛋白复合物,由NLRP3、ASC和Pro⁃caspase⁃1组成;ASC是NLRP3炎性小体的重要的接头蛋白,连接上游的NLRP3和下游的Pro⁃caspase⁃1,caspase⁃1是NLRP3炎性小体的效应蛋白,是调节炎症反应以及细胞凋亡的一类蛋白酶家族[16]。正常情况下,它以无活性的前体形式存在,其激活依赖于炎性复合体被外源入侵微生物或者由组织损伤产生的内源性危险信号,激活后将无活性Pro⁃caspase⁃1转变成有活性的caspase⁃1,进而能将无活性的促炎细胞因子IL⁃1β和IL⁃18的前体剪切加工为成熟的IL⁃1β和IL⁃18[17];这两个细胞因子均属于IL1家族成员,具有多样生物学活性,是Th1细胞生长和分化因子;可以诱导活化B细胞、T细胞和NK细胞产生IFN⁃γ;还可以通过上调Fasl表达来促进NK细胞毒性;它们作为促炎症细胞因子而参与炎症反应,参与机体的抗感染免疫,及时有效地清除病原体[18-20]。本实验结果显示梅毒血清固定患者PBMCs中的NLRP3、ASC及Caspase⁃1mRNA表达明显低于健康者(P<0.05),提示梅毒血清固定患者体内参与天然免疫的NLRP3信号通路存在异常,且该信号通路下游的IL⁃1β和IL⁃18的表达和分泌也均低于健康者(P<0.05),推测此类患者体内IL⁃1β和IL⁃18的下调可能会导致NK细胞、Th1型细胞因子、T细胞减少或表达失衡,导致机体的免疫功能抑制,在梅毒感染免疫的过程中机体对Tp的免疫清除能力降低,形成梅毒血清固定现象。相关研究显示梅毒血清固定患者外周血中NK细胞显著降低,NK细胞数量降低可能是导致该现象形成的重要原因[21]。国内外已有的研究表明梅毒血清固定患者存在外周血Th1型细胞因子、Th17和CD4+T细胞减少,会导致Th1/Th2型细胞因子的失衡、Treg/Th17和CD4+T/CD8+T细胞免疫失衡,致使机体的梅毒感染免疫应答受到抑制,小部分Tp逃过机体的细胞免疫,未能被及时彻底清除,形成梅毒血清固定[10,22-23]。说明NLRP3炎症小体及下游细胞因子可能在抗Tp感染免疫的过程中,对正常启动获得性免疫起到了关键性调控作用,并参与了梅毒血清固定的形成。
综上所述,笔者认为梅毒血清固定患者存在天然免疫异常,其体内的NLRP3炎症小体表达下调可能会影响到信号通路的下游细胞因子和相关细胞参与的梅毒感染免疫反应,导致梅毒血清固定形成。但具体免疫网络及其相关细胞因子间互相调节的分子机制并不是十分清晰,后续还需就其具体的分子机制进行深入的研究。
