微小RNA⁃191通过靶向调节TET1影响子宫内膜癌细胞的增殖和侵袭
2021-05-28李松董莉丽孙丽李刚袁爽王学博王克
李松 董莉丽 孙丽 李刚 袁爽 王学博 王克
南阳市中心医院妇产科(河南南阳473000)
子宫内膜癌是一种具有较强侵袭和转移能力的恶性肿瘤,在我国的发病率逐年增加,呈明显的低龄化趋势,治疗后易复发,易产生化疗耐药性,寻找更为有效的策略用于子宫内膜癌的治疗至关重要[1-2]。目前,基因靶向治疗被认为是更精准和安全的治疗方式,在恶性肿瘤的临床治疗中显示出广阔应用前景。微小RNA(microRNAs,miR⁃NAs)是指长度为19~25个核苷酸的非编码单链小RNA,主要通过与目的基因的3′非翻译区(3′UTR)结合调控mRNA翻译,可作为候选生物标志物用于疾病的诊断和治疗[3-4]。
miR⁃191是一种高度保守的miRNA,在多种不同的癌症类型中异常表达[5-6]。研究[7-9]证明,miR⁃191表达上调可促进肝癌、前列腺癌及胰腺癌的发展,是疾病预后不良的标志物。然而,miR⁃191在子宫内膜癌中的作用尚不明确。本研究检测了miR⁃191在子宫内膜癌临床样本和人子宫内膜癌细胞中的表达差异,探讨其对子宫内膜癌细胞生物学功能的影响及可能的作用机制,为临床子宫内膜癌的基因治疗提供新靶点。
1 材料与方法
1.1 组织来源104例患者的新鲜子宫内膜癌组织及其癌旁组织来自本院2015年12月至2018年12月子宫内膜癌手术切除标本,已经过病理诊断证实,取材后立即放置于液氮中,然后保存在-80℃超低温冰箱中备用。
1.2 细胞人子宫内膜癌Ishikawa、HEC⁃1⁃B、RL⁃952、JEC细胞株购自中科院上海细胞库。细胞培养在含有10%胎牛血清的DMEM培养基中,培养条件为5% CO2、37℃。每2~3 d传代一次,取对数生长期的细胞用于实验。
1.3 试剂DMEM培养基、胎牛血清、MTT染色试剂盒、Transwell小室、基质胶、结晶紫染液、双荧光素酶报告基因检测试剂盒(北京索莱宝科技有限公司);LipofectaminTM2000(美国Invitrogen公司);miR⁃191 inhibitor及其阴性对照、双荧光素酶报告质粒pmirGLO均委托上海吉玛公司构建;Rever⁃tAidTMfirst Strand cDNA Synthesis Kit(美国Thermo Scientific公司);引物(日本TaKaRa公司);TET1兔源单克隆抗体、羊抗兔二抗(Santa Cruz Biotechnol⁃ogy)。
1.4 方法
1.4.1 RT⁃PCR检测子宫内膜癌组织及细胞miR⁃191及TET1的表达取子宫内膜癌组织、癌旁组织和Ishikawa、HEC⁃1⁃B、RL⁃952、JEC细胞,加入裂解液抽提总RNA,使用RevertAidTM first Strand cD⁃NA Synthesis Kit逆转录试剂盒合成cDNA,作为荧光定量模版。引物由日本Takara公司设计合成,所有样品均以GAPDH为内参。反应体系:dNTPs 0.5 μL+5×Buffer 5 μL+Taq酶0.3 μL+MgCl21.5 μL+cDNA模板2 μL+上下游引物分别1 μL,加去离子水至总体积25 μL。反应条件为:95℃预变性5 min,95℃变性30 s、62℃退火30 s、72℃延伸30 s,重复40个循环,最后72℃延伸10 min,4℃5 min终止反应,实验重复3次。采用2⁃△△CT的方法计算目的基因mRNA相对表达水平变化。引物序列为:miR⁃191:5′⁃ACACTCCAGCTGGGCAACGGAATCCCAA⁃AAGC⁃3′;U6:5′⁃TTATGGGTCCTAGCCTGAC⁃3′;TET1:5′⁃CACTGCTTGCCTGGACTTCTG⁃3′,5′⁃CCC⁃AAAGAGCGGTTATCTTCTC⁃3′;GAPDH:5′⁃TGCTT⁃CACCACCTTCTTGA⁃3′,5′⁃TCACCATCTTCCAGGA⁃GC⁃3′。
1.4.2 细胞分组与转染收集Ishikawa细胞,以4×105个/孔的浓度接种到6孔板。将细胞分为inhibitor组、NC组和对照组。当细胞生长融合至70%~80%时,参照LipofectaminTM2000试剂说明书,对inhibitor组细胞转染miR⁃191 inhibitor,NC组细胞转染miR⁃191 inhibitor NC,对照组细胞采用正常培养基培养。转染5 h后更换为正常培养基,继续培养48 h后检测细胞miR⁃191和TET1 mRNA表达量,方法同1.4.1。
1.4.3 MTT法检测细胞增殖能力转染48 h后收集细胞,以3×103个/孔的浓度接种到96孔板,每组5个复孔,培养24、48、72 h后加入20 μL 5 mg/mL MTT溶液,37℃孵育4 h后弃上清,加入150 μL DMSO使结晶溶解,490 nm波长检测吸光度(OD)值。
1.4.4 Transwell法检测细胞侵袭能力收集细胞,采用无血清培养基稀释后以2×104个/孔接种于已铺基质胶的Transwell上室,每孔200 μL,下室加入600 μL DMEM完全培养基,培养24 h后取出上室,甲醇固定20 min,擦掉上室残余细胞,1%结晶紫染色15 min,PBS清洗后置于显微镜下观察,选取4个高倍视野进行细胞计数,取平均值。
1.4.5 Western blot法检测细胞TET1蛋白表达情况收集细胞提取蛋白,测定蛋白浓度,加入load⁃ing buffer混匀煮沸5 min使蛋白变性。配置15%的分离胶和5%的浓缩胶进行SDS⁃PAGE电泳分离蛋白,然后电转移至PVDF膜上,5%脱脂奶粉封闭2 h,分别加入不同的一抗稀释液,稀释比例均为1∶1 000,4℃过夜,洗膜,滴加发光液,置凝胶成像系统显影。
1.4.6 双荧光素酶靶标实验验证miR⁃191与TET1的关系在TargetScan网站(http://www.targetscan.org/vert_72/)检索发现TET1是miR⁃191的潜在靶点,为检测miR⁃191与TET1的靶向结合关系,设计与miR⁃191相结合的TET1的3′⁃UTR序列及其突变序列,将其构建到双荧光素酶报告基因载体pmirGLO上(此项工作委托上海吉玛公司完成)。取Ishikawa细胞,按照5×104个/孔的密度接种到24孔板,待细胞融合到80%左右,向细胞转染TET1⁃3′⁃UTR⁃NC/TET1⁃3′⁃UTR⁃WT/TET1⁃3′⁃UTR⁃MUT报告质粒、miR⁃191及对照miR⁃NC质粒进行共转染,使用双荧光素酶检测试剂盒检测萤火虫荧光素酶和海肾荧光素酶活性。
1.5 统计学方法应用SPSS 25.0软件进行统计分析数据,实验重复3次,计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜癌组织及癌旁组织miR⁃191和TET1表达比较子宫内膜癌组织中miR⁃191表达量显著高于癌旁组织,TET1 mRNA表达量显著低于癌旁组织,差异有统计学意义(P<0.05,图1)。
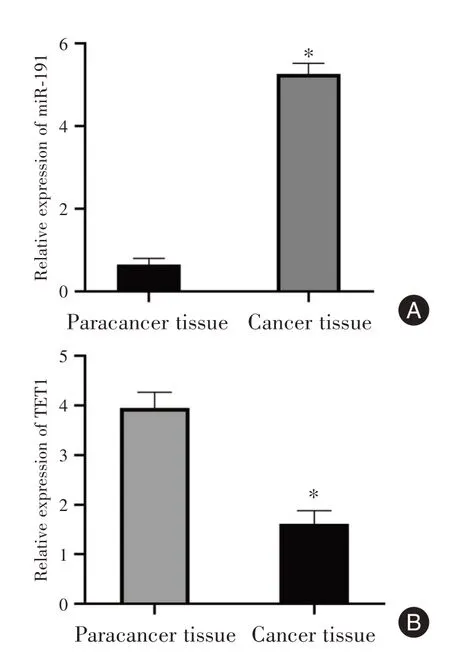
图1 子宫内膜癌组织及癌旁组织miR⁃191和TET1 mRNA表达比较Fig.1 Comparison of miR⁃191 and Tet1 mRNA expression in endometrial cancer tissue and adjacent tissues
2.2 子宫内膜癌细胞miR⁃191和TET1表达比较以JEC细胞为参照,miR⁃191在Ishikawa、HEC⁃1⁃B和RL⁃952细胞中的表达量分别为(85.62±1.35)、(20.68±1.98)、(1.88±0.88)(图2A),TET1 mRNA的表达量分别为(0.07±0.01)、(0.30±0.02)、(0.62±0.04)(图2B)。选择miR⁃191高表达和TET1低表达的Ishikawa细胞株进行后续实验。
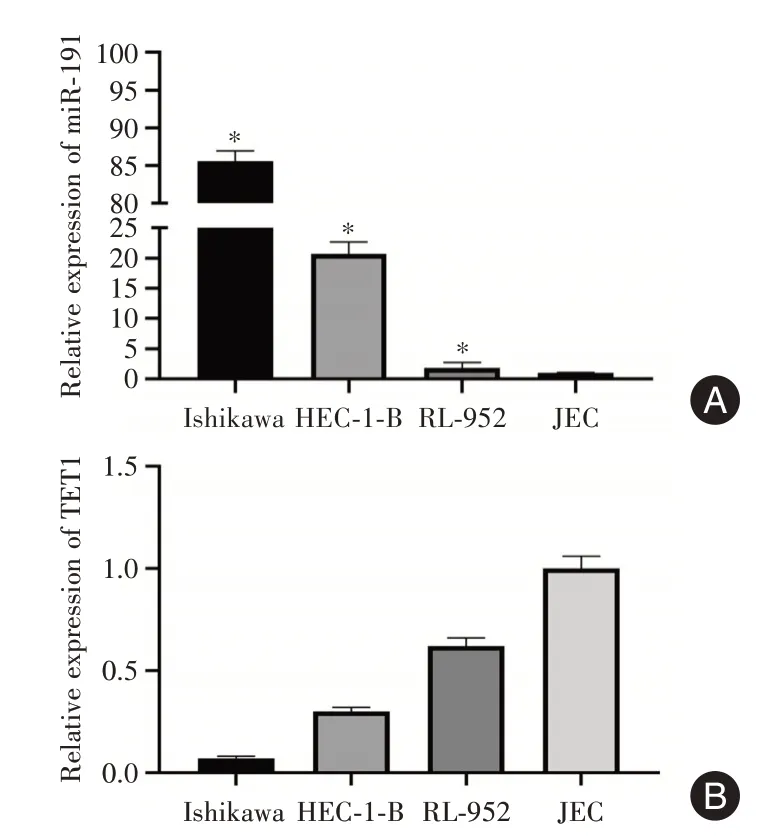
图2 子宫内膜癌细胞miR⁃191和TET1 mRNA表达比较Fig.2 Comparison of miR⁃191 and TET1 mRNA expression in endometrial cancer cells
2.3 抑制miR⁃191对TET1的表达水平的影响与对照组比较,NC组细胞miR⁃191和TET1表达无显著变化(P>0.05)。与对照组和NC组比较,转染miR⁃191 inhibitor使细胞miR⁃191表达降低,TET1表达升高,差异有统计学意义(P<0.05,图3)。
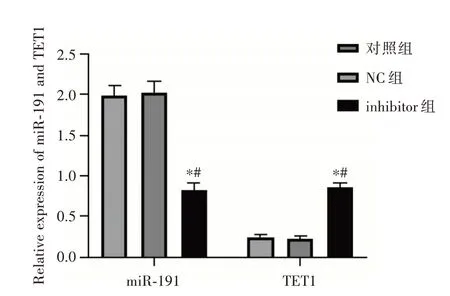
图3 抑制miR⁃191对TET1表达水平的影响Fig.3 Effect of miR⁃191 inhibition on TET1 expression
2.4 抑制miR⁃191对Ishikawa细胞增殖能力的影响培养24、48、72 h后,与对照组比较,NC组细胞的增殖能力无显著变化(P>0.05)。与对照组和NC组比较,inhibitor组细胞的增殖能力显著降低,差异有统计学意义(P<0.05,图4)。
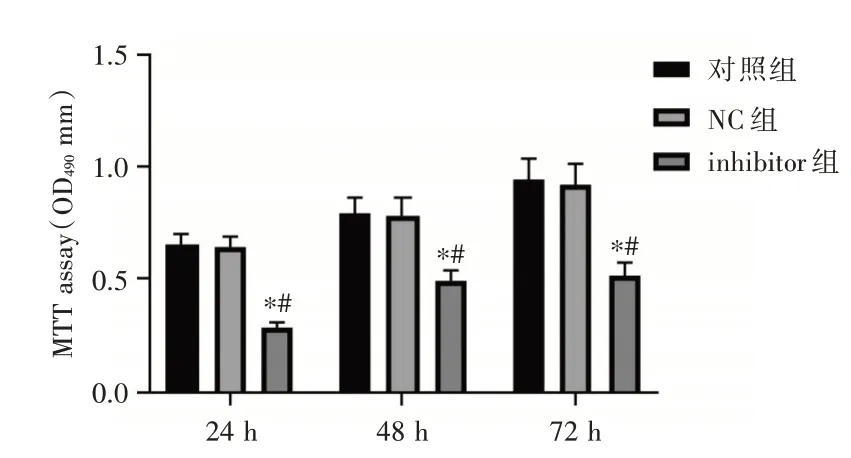
图4 抑制miR⁃191对Ishikawa细胞增殖能力的影响Fig.4 Effect of miR⁃191 inhibition on proliferation of Ishikawa cells
2.5 抑制miR⁃191对Ishikawa细胞侵袭能力的影响NC组与对照组细胞穿膜数量比较,差异无统计学意义(P>0.05)。与对照组和NC组比较,inhibitor组细胞穿膜数量显著降低,差异有统计学意义(P<0.05,图5)。
2.6 Western blot法检测miR⁃191对Ishikawa细胞TET1表达的影响NC组细胞TET1蛋白表达与对照组比较,差异无统计学意义(P>0.05)。与对照组和NC组比较,inhibitor组细胞TET1蛋白表达增加,差异有统计学意义(P<0.05,图6)。
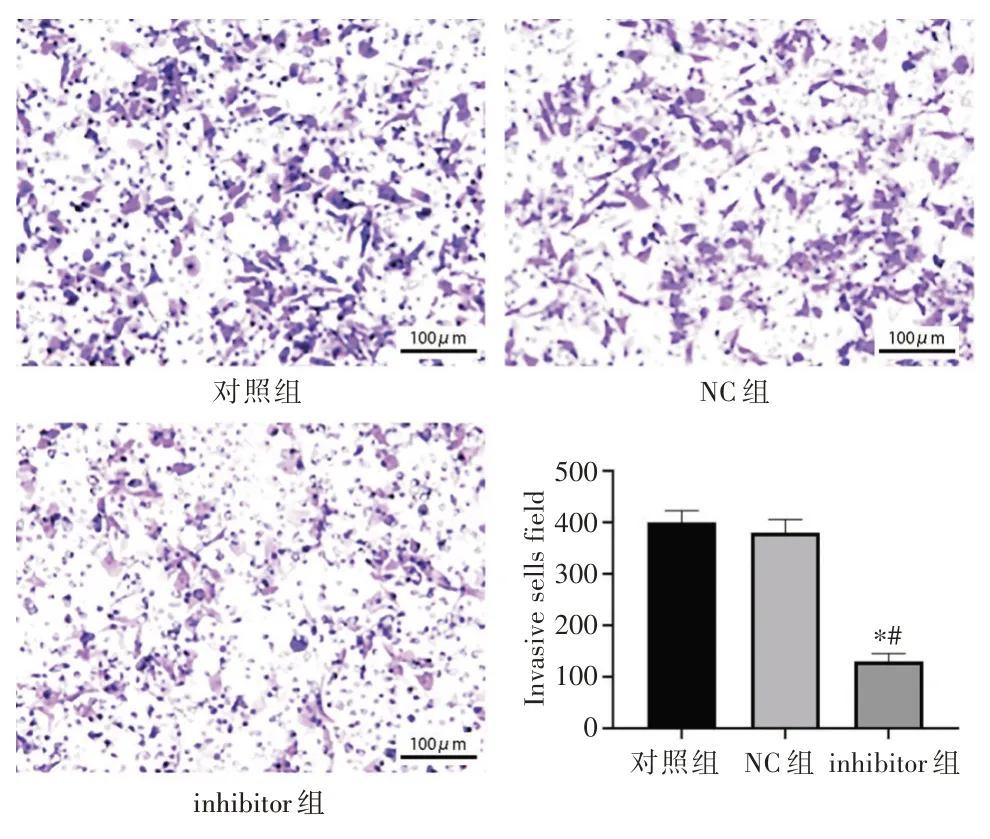
图5 抑制miR⁃191对Ishikawa细胞侵袭能力的影响Fig.5 Effect of miR⁃191 inhibition on invasion of Ishikawa cells
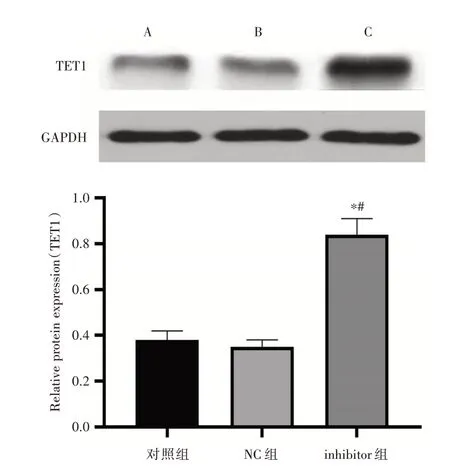
图6 Western blot法检测各组Ishikawa细胞TET1表达水平Fig.6 The expression of TET1 in Ishikawa cells was detected by Western blot
2.7 miR⁃191对TET1的靶向调控作用通过生物信息学网站对miR⁃191的靶基因进行预测和鉴定,TET1被预测为miR⁃191的结合位点(图7A)。双荧光素酶报告基因实验显示,加入miR⁃191后,共转染TET1⁃3′⁃UTR⁃WT的Ishikawa细胞中荧光素酶活性显著降低(P<0.05),共转染TET1⁃3′⁃UTR⁃MUT和TET1⁃3′⁃UTR⁃NC的Ishikawa细胞中荧光素酶活性无显著变化,差异无统计学意义(P>0.05,图7B)。
3 讨论
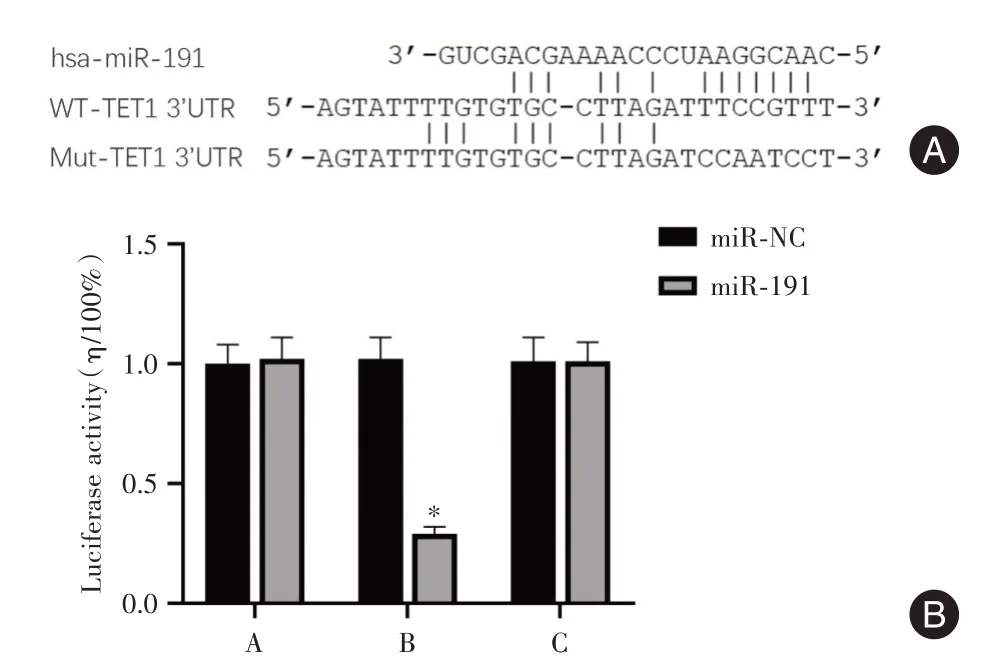
图7 miR⁃191与TET1 3′UTR潜在结合点及荧光素酶活性Fig.7 Potential binding site and luciferase activity of 3′UTR of mir⁃191 and TET1
子宫内膜癌在我国的发病率逐年升高,寻找更有效的疗法和靶标是当前子宫内膜癌临床治疗亟待解决的关键[10]。研究证明,成熟的miRNA可以通过3′⁃UTR、5′⁃UTR区域甚至mRNA编码序列的不精确互补来调节靶基因的表达[11-13]。miR⁃191是一种高度保守的miRNA,最初在鼠类基因中被发现,后被证实在人类基因中也存在,在多种恶性肿瘤中呈高表达状态,通过调控相应的靶基因促进癌细胞的增殖和侵袭[14-17]。然而,miR⁃191在子宫内膜癌中的作用尚不明确。
为探讨miR⁃191对子宫内膜癌细胞生物学功能是否具有调控作用,本研究检测了miR⁃191在子宫内膜癌及其癌旁组织中的表达差异。结果显示,子宫内膜癌组织中miR⁃191的表达量显著高于癌旁组织。同时,本研究检测了Ishikawa、HEC⁃1⁃B、RL⁃952、JEC四种子宫内膜癌细胞中miR⁃191的表达差异,结果显示,Ishikawa细胞中miR⁃191表达水平最高。向Ishikawa细胞转染miR⁃191抑制物可降低细胞的增殖和侵袭活力,以上结果提示miR⁃191与子宫内膜癌细胞的生物学功能密切相关,抑制miR⁃191可直接影响子宫内膜癌细胞的增殖和侵袭能力。
为进一步探究miR⁃191对子宫内膜癌细胞的作用机制,本研究在TargetScan网站对miR⁃191的靶基因进行预测,检索发现TET1是miR⁃191的潜在靶点。TET1基因是甲基胞嘧啶双加氧酶家族的重要成员,能够将5⁃甲基胞嘧啶氧化参与DNA去甲基化途径,调控胚胎干细胞发育,并与神经系统、血液系统及肿瘤疾病的发生密切相关[18-19]。研究证明,上调TET1基因可抑制恶性肿瘤的转移和侵袭,是肿瘤治疗的潜在靶点[20-21]。猜测miR⁃191可能通过调节TET1影响子宫内膜癌发生和发展。
本研究发现,子宫内膜癌组织中TET1 mRNA的表达量显著低于癌旁组织,在miR⁃191高表达的Ishikawa细胞中,TET1 mRNA的表达量最低。向Ishikawa细胞转染miR⁃191抑制物后,TET1 mRNA的表达量升高,细胞的增殖和迁移能力降低。与上述结果一致,当Ishikawa细胞miR⁃191表达被下调后,TET1蛋白表达水平显著增加,表明miR⁃191可能是通过调节TET1的表达改变子宫内膜癌细胞的生物学功能。为进一步证明miR⁃191对子宫内膜癌的作用是通过靶向TET1基因来调控的,采用双荧光素酶靶标实验验证miR⁃191与TET1的关系,结果显示,miR⁃191只能抑制野生型TET1⁃3′⁃UTR⁃WT Ishikawa细胞中的荧光素酶活性,而对突变型TET1⁃3′⁃UTR⁃MUT Ishikawa细胞中荧光素酶活性无影响,表明TET1是miR⁃191的潜在靶基因,miR⁃191对TET1基因的表达存在显著的调控作用。
本研究探讨了miR⁃191对子宫内膜癌细胞生物学功能的调控作用,并对其作用机制进行了初步探讨,结果显示miR⁃191在子宫内膜癌组织和子宫内膜癌Ishikawa细胞中高表达,能够促进子宫内膜癌细胞的增殖和侵袭,这种作用可能是通过靶向抑制TET1的表达而实现的。然而本研究仅在细胞水平展开,实验性质较为单一,未进行体内实验验证。本课题组下一步将在子宫内膜癌动物模型中探讨miR⁃191的作用,为miR⁃191在子宫内膜癌中的作用提供理论依据。
