口疡防愈凝胶对大鼠放射性口腔炎的保护作用及机制研究
2021-05-27刘向荣聂含竹黄皓麟孔祥建蔡川刘威刘开英李辉王萌廖玲菲
刘向荣 聂含竹 黄皓麟 孔祥建 蔡川 刘威 刘开英 李辉 王萌 廖玲菲


〔摘要〕 目的 觀察口疡防愈凝胶(Kouyang Fangyu gel, KFG)对放射性口腔炎的保护作用,并探讨其机制。方法 将50只SD大鼠随机分为空白对照组、轻度模型组、重度模型组、轻度模型+KFG治疗组、重度模型+KFG治疗组,每组10只。采用单次照射15 Gy和25 Gy X射线的方法分别建立轻度和重度口腔炎模型,并分别给予KFG药物治疗,连续7 d。于给药前及给药第3、5、7天时分别进行口腔黏膜炎症评分,采用HE染色法观察口腔黏膜病理变化,ELISA法检测血清促炎性因子TNF-α、IL-1β、IL-6及抗炎性因子IL-10的水平,免疫组化法检测黏膜TLR4、NF-κB表达。结果 轻度模型组口腔炎症自愈性明显,KFG不能明显缩短其愈合时间;重度模型组口腔溃疡面积及程度虽随着时间推移有减轻趋势,但在经KFG治疗后其评分快速下降,愈合明显加快;KFG能够改善重度口腔炎模型大鼠口腔黏膜病理形态,降低血清TNF-α、IL-1β、IL-6含量(P<0.05或P<0.01),升高IL-10水平(P<0.05),并抑制黏膜TLR4和NF-κB蛋白的表达(P<0.05或P<0.01)。结论 KFG对于重度放射性口腔炎有明显的治疗作用,其机制可能与抑制口腔黏膜TLR4/NF-κB信号通路,进而调节炎症因子水平有关。
〔关键词〕 放射性口腔炎;口疡防愈凝胶;口腔黏膜;炎症因子;TLR4/NF-κB信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.02.011
〔Abstract〕 Objective To observe the protective effect of Kouyang Fangyu gel (KFG) on radiation stomatitis and explore its mechanism. Methods 50 SD rats were randomly divided into the blank control group, the mild model group, the severe model group, the mild model + KFG treatment group, the severe model + KFG treatment group, with 10 rats in each group. A single exposure to 15 Gy and 25 Gy X-rays were used to establish mild and severe stomatitis models, respectively, and KFG drug treatment was given for 7 consecutive days. Oral mucosal inflammation scores were taken before and at 3rd, 5th, and 7th days after administration. HE staining was used to observe the pathological changes of oral mucosa. ELISA kit was used to detect the levels of serum pro-inflammatory factors TNF-α, IL-1β, IL-6 and anti-inflammatory factor IL-10, and immunohistochemical method was used to detect mucosal TLR4, NF-κB expression. Results In the mild model group, oral inflammation was obvious self-healing, and KFG could not shorten the healing time. The area and extent of oral ulcers in the severe model group tended to decrease over time, their scores decreased rapidly after healing with KFG, and healing was significantly accelerated. Meanwhile, KFG could improve the pathological morphology of oral mucosa in rats with severe stomatitis, reduce serum TNF-α, IL-1β, IL-6 levels (P<0.05 or P<0.01), increase IL-10 level (P<0.05), and inhibit the expression of TLR4 and NF-κB proteins in the mucosa (P<0.05 or P<0.01). Conclusion KFG has a significant therapeutic effect on severe radiation stomatitis, and its mechanism may be related to the inhibition of the TLR4/NF-κB signaling pathway in the oral mucosa and thus to regulate of inflammatory factor levels.
〔Keywords〕 radiation stomatitis; Kouyang Fangyu gel; oral mucosa; inflammatory factors; TLR4/NF-κB signaling pathway
头颈部肿瘤是临床常见肿瘤之一,占全身恶性肿瘤的8%,手术及放化疗是其主要治疗手段[1]。流行病学数据显示,约70%头颈部恶性肿瘤患者接受过放疗,其中鼻咽癌对射线敏感度高,放疗一直是其首选治疗方法[2]。然而,连续性地放疗对机体产生的不良反应不容忽视,在头颈部肿瘤患者放疗的系列不良反应中,口腔黏膜炎发生率占比高达85%,其中严重病例占比31%,严重影响患者的治疗舒适度及生活质量,甚至成为少部分患者中断治疗的重要因素[3]。
放射性口腔炎属于中医学“口疮”“嗌肿”“喉痹”等范畴,因放疗致火热内蕴,伤阴灼津,口腔黏膜易受热毒攻击,诱发口腔炎症,治疗当以清热解毒、养阴生津[4]。口疡防愈凝胶(KFG)为常德市第一中医医院(湖南中医药大学附属常德医院)的院内制剂,临床应用多年,主要用于防治各种急慢性放射性口腔炎,总有效率在80%以上[5]。然而,其基础研究开展缓慢,本研究旨在观察KFG对不同程度放射性口腔炎模型动物的作用效果,并探讨其潜在作用机制,以期为其临床应用提供充分的实验依据。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠,50只,体质量为200~220 g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号为SCXK(湘)2016-0002,饲养于湖南中医药大学实验动物中心SPF级动物房,使用许可证号为SYXK(湘)2019-0009。
1.2 药物
口疡防愈凝胶是在常德市第一中医医院(湖南中医药大学附属常德医院)名老中医个人经验方口疡防愈方(基本处方组成:生石膏30 g,芦根30 g,大青叶20 g,生地黄10 g,玄参10 g,牡丹皮10 g,赤芍10 g,蜂胶10 g,甘草5 g)的基础上,从汤剂逐步改良研制的现代中药复方凝胶剂型(20 g/支),由本院药剂科统一生产,质量安全,行装稳定,临床应用多年,疗效显著[5]。
1.3 主要试剂与仪器
肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)(货号H052-2)、白介素1β(interleukin 1β, IL-1β)(货号H002-2)、白介素6(interleukin 6, IL-6)(货号H007-1)、白介素10(interleukin 10, IL-10)(货号H009-1)试剂盒购自南京建成生物公司;兔抗大鼠Toll样受体-4(toll like receptor-4, TLR4)(货号ab22048)、核因子κB(nuclear factor kappa-B, NF-κB)(货号ab32360)多克隆抗体均购自英国Abcam公司;苏木素、伊红、DAB显色试剂盒、山羊抗兔二抗均购自武汉博士德公司。X射线辐照仪购自美国Precision X-ray公司;组织切片机购自美国Thermo公司;倒置荧光显微镜购自德国Zeiss公司。
1.4 动物分组、造模与给药
将大鼠随机分为5组,分别为空白对照组、轻度模型组、重度模型组、轻度模型+KFG治疗组、重度模型+KFG治疗组,每组10只。采用10%的水合氯醛(3 mL/kg)麻醉大鼠,取仰卧位,将四肢固定,平放于X射线辐照仪上,所能接受照射范围为大鼠双耳前连线前方的头部,撑开大鼠口腔并用铅皮保护颊部以外的头部区域,辐射剂量率为5 Gy/min。根据前期预实验结果,采用单次照射3 min(共15 Gy)的方法建立轻度口腔炎模型,单次照射5 min(共25 Gy)建立重度口腔炎模型,空白对照组只麻醉不辐射。造模完成后24 h,对大鼠进行口腔炎症评分,治疗组在评分完成后给药,将口疡防愈凝胶均匀涂抹在大鼠颊部受辐射黏膜处,模型组和空白对照组在同部位涂抹空白凝胶,每天1次,连续给药7 d。
1.5 口腔炎症评分
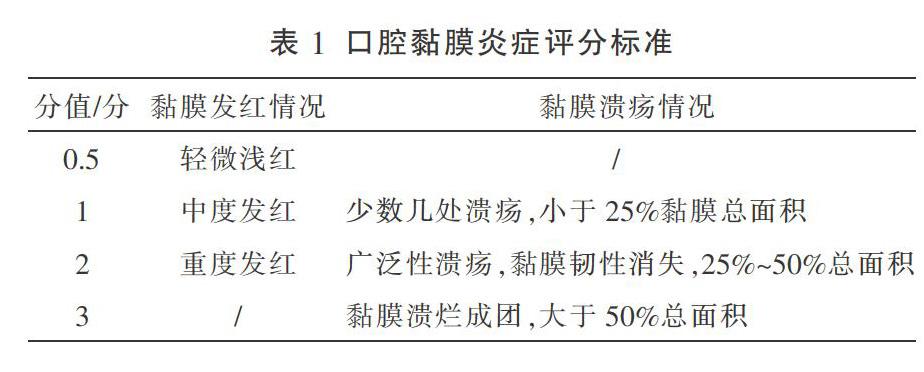
参照Parkins等[6]建立的口腔炎症评分标准进行评分,主要依据颊部口腔黏膜的变化及是否出现红斑(充血)、糜烂、溃疡等主要体征,评分值为黏膜发红及溃疡情况得分总和。在给药前及给药第3、5、7天后分别进行评分,评分由两名不了解实验方案的口腔专业研究生完成。评分标准见表1。
1.6 HE染色法观察口腔黏膜病理变化
在末次评分完成后,取出大鼠左右颊黏膜组织固定于4%多聚甲醛溶液中,固定充分后,梯度乙醇-二甲苯脱水透明,充分浸蜡包埋,连续切片,烘干后脱蜡,置于苏木素-伊红溶液中染色,染色完成后水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。待树胶干后置于显微镜下观察组织病理改变情况。
1.7 ELISA法检测血清炎症因子含量
将大鼠血液收集于促凝管中,静置2 h后离心,分离上清液保存。按照ELISA试剂盒说明书进行实验,根据标准曲线求出各组大鼠血清炎症因子TNF-α、IL-1β、IL-6、IL-10的含量。
1.8 免疫组化法检测黏膜TLR4、NF-κB表达
将口腔黏膜石蜡切片脱蜡、水化,用0.01 mol/L的枸橼酸钠缓冲液进行抗原热修复,PBS水洗,滴加山羊血清封闭液,室温孵育30 min,加相应一抗(1∶100)孵育过夜;PBS洗3次,反应增强液孵10 min,二抗(1∶200)孵10 min;冲洗,DAB染色,苏木素復染,梯度乙醇脱水,封片。将切片置于显微镜下进行拍摄,并采用Image-Pro Plus软件分析积分光密度值(IOD)。
1.9 统计学分析
采用SPSS 19.0软件进行数据分析,若数据满足正态分布、方差齐性,采用单因素方差分析,同时用LSD检验进行组间比较。若数据不满足正态分布,则用Kruskal-Wallis H检验。计量数据用“x±s”表示,以α=0.05作为检验水准。
2 结果
2.1 KFG对口腔黏膜炎症评分的影响
轻度口腔炎模型大鼠口腔黏膜有一定程度发红,溃疡集中于一侧,面积较小呈点状分布,随着时间推移,溃疡数量及面积减少,黏膜无明显肿胀,有较明显的愈合趋势;KFG治疗组口腔评分先上升后下降,较模型组无显著差异。重度口腔炎模型组大鼠颊黏膜呈深红色,形成大面积溃疡,核心区域糜烂,7 d后溃疡面积稍微减少,仍可见明显的黏膜溃烂;KFG治疗后,随治疗时间延长口腔炎症评分显著下降,5 d时较治療前及模型组均有显著统计学差异(P<0.01),治疗7 d后未见黏膜溃烂,仅有少数小面积溃疡,颜色浅红或正常,部分大鼠黏膜炎症完全消失。结果见表2。
2.2 KFG对口腔黏膜组织形态的影响
空白对照组大鼠口腔黏膜上皮结构完整,细胞排列整齐,无毛细血管扩张;轻度模型组上皮层有部分细胞坏死、脱落,明显变薄,但连续性仍较完整,黏膜下层可见轻微的毛细血管扩张及炎性细胞浸润现象,经KFG治疗后上皮层逐渐恢复正常,无明显毛细血管扩张充血现象;重度模型组黏膜上皮层处于崩解状态,大量细胞脱落消失,连续性差,下层可见大量炎性细胞浸润,经KFG治疗后黏膜上皮连续性变好,结构基本完整,下层有轻微毛细血管扩张及少数炎性浸润。结果见图1。
2.3 KFG对血清炎症因子水平的影响
与空白对照组比较,轻度模型组血清TNF-α及IL-1β含量显著升高(P<0.05),IL-6含量升高、IL-10含量下降,但两者均无统计学差异(P>0.05),重度模型组血清TNF-α、IL-1β、IL-6含量均显著升高(P<0.05或P<0.01),IL-10含量显著下降(P<0.05)。KFG治疗后,能显著降低重度口腔炎大鼠促炎因子TNF-α、IL-1β、IL-6含量(P<0.05),但对抗炎因子IL-10含量无明显影响(P>0.05),对轻度口腔炎大鼠血清各炎症因子表达水平均无统计学影响(P>0.05)。结果见表3。
2.4 KFG对口腔黏膜TLR4、NF-κB表达的影响
与空白对照组比较,轻、重度口腔炎模型大鼠口腔黏膜TLR4、NF-κB阳性表达均增加(P<0.05或P<0.01),其中重度模型组增加更为显著。分别经KFG干预后,重度模型组TLR4、NF-κB表达均降低(P<0.05或P<0.01),但对轻度模型组作用不明显(P>0.05)。结果见表4、图2。
3 讨论
放射性口腔炎是头颈部肿瘤患者放疗过程中最常见的不良反应,受机体状态及治疗周期的影响,患者会出现轻、重不同程度的口腔炎症,其中重度占比超过30%,主要表现为黏膜上皮层完整性破坏,毛细血管扩张、充血而形成红斑,黏膜溃烂,严重者黏膜会永久性坏死而需手术修复[7]。放射性口腔炎的发病机制目前主要包括口腔黏膜上皮细胞损伤、血管内皮损伤、T淋巴细胞亚群改变等方面[8]。本研究根据前期预实验结果,采用不同辐射剂量的X射线辐射分别建立轻、重度口腔炎症大鼠模型,经观察黏膜状态及炎症评分证实模型建立成功;进一步观察黏膜组织病理形态发现,轻度模型组黏膜上皮层部分细胞坏死脱落,但连续性较完整,下层可见轻微的毛细血管扩张及炎性细胞浸润现象,重度模型组上皮层崩解,大量细胞脱落消失,连续性差,下层可见大量炎性细胞浸润,与临床疾病特征类似。
放射性口腔炎的疾病进程与炎症因子的水平密切相关,重度溃疡患者血清炎症因子含量较轻度患者明显升高[9]。Moslemi D等[10]研究表明,炎症因子的含量与口腔黏膜溃疡面积和溃疡数目呈正相关。TNF-α是一种常见的促炎症因子,主要由活化的T细胞产生,为黏膜受损时机体最早作出应答的介质之一,其能通过与另一种促炎因子IL-1β协同触发炎症级联反应,诱导IL-6等多种炎症因子的产生[11-12]。IL-6被认为是与口腔黏膜炎症严重程度最为相关的炎症因子,其含量与炎症评分值呈显著正相关[13]。IL-10作为重要的抗炎性细胞因子,调控机体对外源致病物质的免疫和炎症应答。IL-10能抑制TNF-α、IL-1β、IL-6的生成,减轻炎症反应,保护黏膜组织[14]。口腔溃疡患者血清中IL-10水平较正常人低[15]。
TLR4/NF-κB信号通路是体内重要的炎症调节通路。TLR4是与机体固有免疫相关的一组受体,在巨噬细胞、内皮细胞、上皮细胞等多种细胞中有表达,能够识别脂多糖、细菌细胞壁等多种配体[16]。在TLR4与相应配体结合后,可以激活下游NF-κB信号通路,诱发炎症细胞因子(如TNF-α、IL-1β、IL-6等)的分泌,导致机体炎症产生[17]。研究表明,TLR4/NF-κB介导口腔鳞癌细胞分泌炎症因子并促进其增殖,抑制该信号能够促进癌细胞凋亡[18],但TLR4/NF-κB信号通路是否参与放射性口腔黏膜炎症的发生发展,尚未见报道。
中医认为,放射线属火毒,最易伤及津液,阴津亏虚则虚火内生,内外热邪交炽,积于血分的邪热搏血为瘀,血脉壅阻、血行不畅,瘀血产生致使阴液损耗更多,火毒炽盛,灼伤于黏膜致疾病发生。因此,放射性口腔炎关键病机可以用“热、毒、瘀”概括,治当以解毒化瘀、养阴生津。KFG是在口疡防愈方基础上,由传统汤剂改良的现代凝胶制剂。方中生石膏、芦根清气分实热,为君药,大青叶清热解毒利咽,生地黄、玄参不仅助君药清实热,兼能养阴生津清虚热,牡丹皮、赤芍活血祛瘀,五者共为臣药,蜂胶、甘草调和诸药,为佐使药,全方共奏清热解毒、养阴生津、祛瘀化浊之功。在改进剂型后,增加了药物在口腔黏膜的接触时间,有效成分持续释放,有助于促进创面修复,同时也更加便于用药。本研究通过干预轻、重度放射性口腔炎大鼠发现,KFG对于重度口腔炎症有很好的治疗作用,能够明显缩减黏膜溃烂面积,改善黏膜上皮细胞脱落、连续性差、炎性浸润等病理状态。同时,KFG能够显著抑制促炎症因子水平,降低黏膜TLR4、NF-κB蛋白的阳性表达,提示KFG的作用机制可能与抑制口腔黏膜TLR4/NF-κB通路,进而调节炎症因子水平有关。本研究从动物层面明确了KFG的治疗特点及潜在作用机制,今后将结合临床实验数据,为本药物的开发及推广提供助力。
参考文献
[1] 中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)鼻咽癌诊疗指南[M].北京:人民卫生出版社,2020:22.
[2] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012[J]. International Journal of Cancer, 2015, 136(5): E359-E386.
[3] VERA-LLONCH M, OSTER G, HAGIWARA M, et al. Oral mucositis in patients undergoing radiation treatment for head and neck carcinoma[J]. Cancer, 2006, 106(2): 329-336.
[4] 謝 靖,盛 沛,李 博,等.放射性口腔黏膜炎的发病机制及中西医防治研究进展[J].南京中医药大学学报,2019,35(3):338-343.
[5] 聂含竹.口疡防愈凝胶治疗头颈部肿瘤急性放射性口腔炎的临床效果观察[J].当代护士(下旬刊),2016(10):99-100.
[6] PARKINS C S, FOWLER J F, YU S. A murine model of lip epidermal/mucosal reactions to X-irradiation[J]. Radiotherapy and Oncology, 1983, 1(2): 159-165.
[7] MIYAMOTO H, KANAYAMA T, HORII K, et al. The relationship between the severity of radiation-induced oral mucositis and the myeloperoxidase levels in rats[J]. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 2015, 120(3): 329-336.
[8] 陆 叶,沈红梅.放射性口腔炎的治疗进展[J].临床与病理杂志, 2017,37(6):1269-1275.
[9] GRUBER S, BOZSAKY E, ROITINGER E, et al. Early inflammatory changes in radiation-induced oral mucositis[J]. Strahlentherapie Und Onkologie, 2017, 193(6): 499-507.
[10] MOSLEMI D, NOKHANDANI A M, OTAGHSARAEI M T, et al. Management of chemo/radiation-induced oral mucositis in patients with head and neck cancer: A review of the current literature[J]. Radiotherapy and Oncology: Journal of the European Society for Therapeutic Radiology and Oncology, 2016, 120(1): 13-20.
[11] 项冰倩,何金波,高 慧,等.右美托咪啶对肺缺血/再灌注损伤大鼠促炎介质IL-1β、TNF-α水平的影响及其机制[J].中国应用生理学杂志,2017,33(5):415-419.
[12] SAND F L, THOMSEN S F. Efficacy and safety of TNF-α inhibitors in refractory primary complex aphthosis: A patient series and overview of the literature[J]. The Journal of Dermatological Treatment, 2013, 24(6): 444-446.
[13] LEGERT K G, TSILINGARIDIS G, REMBERGER M, et al. The relationship between oral mucositis and levels of pro-inflammatory cytokines in serum and in gingival crevicular fluid in allogeneic stem cell recipients[J]. Supportive Care in Cancer: Official Journal of the Multinational Association of Supportive Care in Cancer, 2015, 23(6): 1749-1757.
[14] MAEHARA T, FUJIMORI K. Contribution of FP receptors in M1 macrophage polarization via IL-10-regulated nuclear translocation of NF-κB p65[J]. Biochimica et Biophysica Acta Molecular and Cell Biology of Lipids, 2020, 1865(5): 158654.
[15] 马金昀,徐玲霞,杨 月,等.复发性口腔溃疡症状积分与炎性细胞因子的相关性及加味黄连甘草汤的治疗作用[J].上海中医药大学学报,2017,31(1):18-23.
[16] FONCECA A M, ZOSKY G R, BOZANICH E M, et al. Accumulation mode particles and LPS exposure induce TLR-4 dependent and independent inflammatory responses in the lung[J]. Respiratory Research, 2018, 19(1): 15.
[17] JING N S, LI X N. Dihydromyricetin attenuates inflammation through TLR4/NF-kappaB pathway[J]. Open Medicine (Warsaw, Poland), 2019, 14: 719-725.
[18] HAN S W, XU W G, WANG Z Y, et al. Crosstalk between the HIF-1 and Toll-like receptor/nuclear factor-κB pathways in the oral squamous cell carcinoma microenvironment[J]. Oncotarget, 2016, 7(25): 37773-37789.
