一种单纯毛细胞缺失豚鼠耳聋模型的建立
2021-05-27庄文杰丛宁韩朝
庄文杰 丛宁 韩朝
通过各种方法改善听力的研究主要在药物和噪声聋的模型上进行。药物性聋的模型可以通过注射新霉素、庆大霉素、卡那霉素或使用前述药物的基础上联合应用速尿或利尿酸[1-5],也可以单纯应用顺铂造成内毛细胞为主的丢失[6]。噪声聋的模型主要使用稳态噪声或脉冲噪声。这些都是比较成熟的模型。但是这些模型除应用顺铂外不仅仅是造成毛细胞的损害,还对基底膜的结构产生了影响,从而使毛细胞再生和听觉恢复的研究变得复杂困难,尽管这与临床比较接近,但是同时将问题复杂困难化。本实验发现通过耳蜗侧壁打孔经中阶入路灌注注射用水或病毒液可以引起以外毛细胞为主的损失,同时这种损害的程度与灌注液体的成分似乎没有直接的影响,从而获得了一个较为单纯的以外毛细胞损伤为主的耳聋模型。这个模型不仅具有仅造成基底膜单一细胞损害的优点外,还为中阶内淋巴药物灌注建立了临时通路。
资料与方法
1 材料
250~350g 健康花豚鼠12 只(复旦大学上海医科大学动物科学部提供),雌雄不拘,耳郭反射正常,无耳疾。听觉诱发电位仪器使用BIOLOGIC 仪器。微量泵(53110V Single Syringe Pump, infusion, 220v,美国STOELTING 公司)。玻璃微电极。Fast Green Dye 快绿生物染料(sigma 公司)。共聚焦显微镜。Palloidin(sigma 公司)。Carl Zeiss 显微镜和显微耳科手术器械,聚亚酰胺微管内径0.08mm,外径0.1mm(Code 039-I 购自美国 MicroLumen 公司),Ad-EGFP 病毒总感染滴度(PFU)为 1.0×1011(Ad0112d,北京本元正阳公司),Leica DMR 显微镜(荧光和自然光),leica DFC300 FX 图像采集系统,leica Qwin V3 图像处理系统(Leica Microsysems, 瑞士)。
2 造模方法
氯胺酮(肌注,40mg/kg,临床剂型)2%利多卡因(皮下注射,0.5ml/次,临床剂型)和甲苯噻嗪(肌注,10mg/kg,南京法姆化工厂)。麻醉成功后仰卧位,伸颈,使用脱毛剂(8%硫化钠)脱毛。0.5%碘伏消毒皮肤。自左侧下颌下缘中点,平行于颈正中线向下剪开毛皮长约1.5cm。皮下稍加分离后置入撑开器,提起颈阔肌剪开一小口然后避开血管扩大切口,此时应该可以看到白亮的咬肌键膜,沿着咬肌内侧表面向深处分离,将腺体牵向中线(灰白色泡膜状),下颌下腺及颈外静脉在下方也牵向中线,下方可以看到茎突及前方走向的二腹肌后腹及键膜,在咬肌内侧二腹肌深处可以探到一个骨性平面就是骨性听泡了,将肌肉和迷走神经牵向中线就可以看到骨面。分离骨膜上撑开器。用血管钳在骨面最突起的后内方夹开少许骨质,去除后,撕掉内面的骨膜就进入听泡,可以看到内侧的耳蜗和外侧的鼓膜。在倒数第二圈(基本上覆盖40%~70%的区域频率在1~8K 之间的基底膜区)的中部色素带偏下打孔(使用自制尖端0.2mm 的三棱针)。导入聚亚酰胺微管,深度在0.1~0.2mm 之间,另一端连接微量注射泵(速率为0.5μl/min),药物容量为5μl(含1μl 0.25%快绿生物染料),使用快绿生物染料作为指示剂,确定是否位于中介内,病毒组使用携带egfp 基因的腺病毒和快绿生物染料混合液。注射用水组使用商品化的注射用水和快绿生物色素混合液。注射完毕,用小块颈阔肌封闭骨孔,用牙科磷酸锌水门汀(上海齿科材料厂)封闭听泡骨性开口。分层缝合切口。
3 标本处理与Phalloidin 染色步骤
ABR 测试结束后,豚鼠使用麻药麻醉后,断头取颞骨剥离出耳蜗,于顶部打孔,开放两窗,进行4%多聚甲醛灌注2 次,浸于4%多聚甲醛中过夜,去除蜗壳骨质,充分暴露依附于蜗轴的螺旋状基底膜,从顶圈开始用细针将基底膜完整剥离下来,放于瓶盖中 PBS 冲洗 3 次 5min,0.3%Triton-100 通透40min,PBS冲洗 3 次,5min,phalloidin (1:600) 湿盒37℃,1h,PBS 冲洗 3 次 5min,0.3%Triton-100 通透20min,Dapi 常温孵育 20min,PBS 冲洗 3 次,将基底膜小心的移入滴有10%甘油的载玻片上,使用显微刀片将基底膜分段切开,盖盖玻片,指甲油封片,荧光显微镜下观察拍照[7]。
4 ABR 测试方法
ABR 测试在手术结束24h 后进行,麻醉成功后,豚鼠处于腹卧位,参考电极接于测试耳乳突皮下,动作电极接于颅顶双耳中间,接地电极接于对侧耳乳突部皮下。由于bio-logic 的电极之间可以自动转化,因此将common 电极接于颅顶,right 电极接于右耳,left 电极接于左耳,电阻小于5 欧姆,极间电阻小于2 欧姆。Click 进行测试。从20dB SPL 开始,一直到出现明显的5 个波形,然后下降5dB 出现2~4 之间的任何一个于5 个波潜伏期一致波形,视为听觉阈值。
5 统计学方法
采用SPSS 11.5 统计学软件,两组t 检验。
结果
1 试验豚鼠中共有12 只成功的进行了5ul 内淋巴灌注,快绿生物染料显示清晰(图1),其中灌注方向朝向顶圈的有6 只,朝向底圈的有6 只。在灌注的方向上基底膜的毛细胞特别是外毛细胞受损严重,而灌注方向相反的基底膜受损较轻。灌注方向朝向底圈,毛细胞损失从底圈上部开始,围绕穿刺部位趋重(见图 2a,b,c,d)。灌注方向朝向顶圈,倒数第三圈上部至顶圈毛细胞正常,倒数第三圈中部以下外毛细胞几乎完全消失(见图 3a,b,c,d),而使用Dapi 染核显示支持细胞的胞核数量变化不明显,细胞核显示饱满,均质(图4)。腺病毒灌注在快绿染料显示注入中阶内淋巴系统时,腺病毒携带的绿色荧光蛋白基因表达显示注入了中阶内淋巴里(图5)。

图1 显示聚亚酰胺微管导入豚鼠耳蜗倒数第二圈的中阶中快绿生物染料示导入正确20 倍

图2 腺病毒灌注方向朝向顶圈。a 底圈的外毛细胞没有任何丢失现象;b 倒数第二圈的外毛细胞损失较轻;c 倒数第三圈外毛细胞损失严重仅存零星几个外毛细胞;d 顶圈外毛细胞损害严重,残留外毛细胞较倒数第三圈略多。
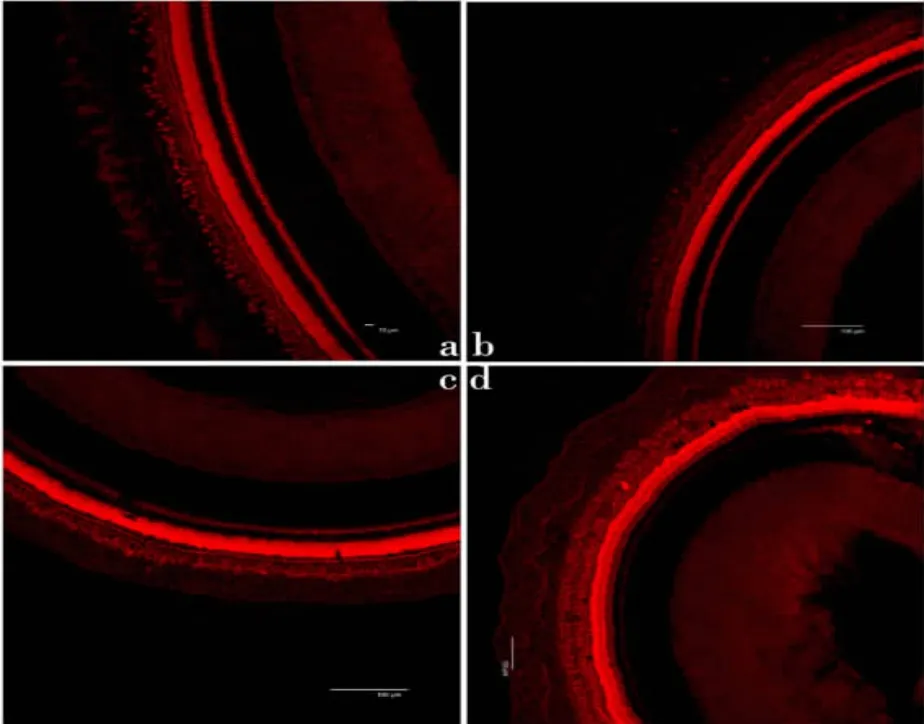
图3 腺病毒灌注方向朝向底圈。a 底圈外毛细胞全部丢失;b 倒数第二圈外毛细胞全部丢失;c 倒数第三圈仅存几个外毛细胞;d 顶圈外毛细胞受损轻可见零星几个外毛细胞丢失。

图4 图3b 相同位置Dapi 核染料显示除了外毛细胞胞核几乎全部消失外,包括内毛细胞,内外柱细胞等支持细胞位置的胞核仍然存在

图5 倒数第二圈腺病毒灌注后phalloidin 染色共聚焦显微镜显示绿色荧光蛋白(egfp)在基底膜的部分支柱细胞和支持细胞有表达
2 ABR 测试结果
观察到当灌注方向朝向底圈时,通过CLICK 测试的豚鼠听阈提高的阈值(92.5±8.22dB SPL)要高于灌注方向朝向顶圈的豚鼠听阈阈值(63.3±6.83dB SPL),P<0.05,差异具有统计学意义(表 1)。

表1 不同朝向注射后ABR 测试结果
讨论
本模型手术的操作国内外已经有报道[8,9],文献中只是作为一种内淋巴给药的方式并没有意识到这种方式本身的造模价值。本研究中毛细胞损害的分布与文献报道的有相似之处[8]。但是本实验同时使用了两种方向,进一步验证了灌注方向是决定毛细胞损害分布的关键。同时使用click 进行ABR 的测试发现灌注方向的不同,测试的阈值也不同,两者存在相关性。当朝底圈方向灌注引起底圈毛细胞受损严重时,click 测试的阈值提高明显。当朝顶圈方向灌注引起底圈毛细胞受损较轻时,click 测试的阈值提高较前者小。这直接证实了文献中报道的豚鼠耳蜗第二圈中间向下的基底膜对应于2kHz 以上的频率范围[10],由于 CLICK 的主频在 2~4kHz,因此如果注射方向朝向底圈,引起第二圈中间以下的毛细胞大量损失,click 阈值提高明显。说明该模型同时可以使用click 测试来判断灌注的方向,从而明确毛细胞损害的分布。对实验的评估有重要意义。
该模型的建立可以获得只有毛细胞缺失,而支持细胞的数量通过其胞核来判断几乎没有损失的耳聋模型,这种模型有利于作为将支持细胞转化为毛细胞的基因操控的平台,有利于复杂问题的分解解决,目前尽管基因可以将支持细胞转化为毛细胞,但是目前无论是药物性聋,还是噪声性聋都不仅仅是毛细胞损害,同时损害的还有支持细胞以及基底膜的结构和后期的螺旋神经元损害,同时不能同步进行治疗药物的灌注,在这种基础上直接完成听力改善的研究,困难是非常大的。而本实验模型恰恰是起到了一个承上启下的作用,等于将复杂问题简单分步化。同时由于本实验在造模的过程中同时建立了临时的内淋巴给药的通路可以将所需的药物或基因载体一次性导入,非常方便,而且由于作者研究证实无论使用的是注射用水,还是腺病毒保存液,两者对造成的听力损害没有差别[11],更给操作的可行性及后期的临床使用开辟了道路。有文献使用人造内淋巴液做内淋巴间隙灌注与腺病毒液进行比较证实两者对听力的影响没有差别[8]。而作者考虑到以后临床上注射用水使用方便,因此采用了注射用水来与腺病毒液进行比较,试验数据统计结果显示两者对听力的影响同样没有显著差别,对毛细胞的损害程度从形态上也未见明显差别[11]。两者的结果也间接证实了引起毛细胞损害的主要原因不是内淋巴液成分的变化。
但是本模型中毛细胞丧失的机理并不清楚,前面已经论述了内淋巴液成分变化引起的可能性很小,而结合本实验方向性决定了外毛细胞死亡的分布,更加排除了成分变化是主要原因的可能,因为如果是内淋巴成分变化引起的,整个内淋巴系统的成分都改变了,毛细胞应该都受损,可能因为耐受性不同而有所差别。受损的毛细胞主要分布在灌注的方向上,似乎提示是压力的变化在其中发挥主要的作用,因为灌注的方向存在压力的梯度,刚好与毛细胞损害的分布相一致。如果真是这样的话,该模型可能同时模拟了梅尼埃病的发病机制。梅尼埃病的发病机制目前认为是膜迷路积水,即膜迷路压力增加造成的。梅尼埃病每次发作都会引起听力的下降,可解释为每次压力的提高造成了部分毛细胞的损失,由于压力是一过性的相对轻微,因此引起的毛细胞损害少,而且由于压力均衡毛细胞损害的范围也同时涉及高频和低频区。但是最终该模型是否真的能够模拟梅尼埃病的发病机制,有待进一步试验证实。该模型由于对豚鼠来说只是局部损伤不同于噪音和药物的影响,因此对于耳鸣的研究来说也是一个很好的单纯外周去出入模型。因为噪音和药物不可避免的会引起动物情绪或其他方面的影响[12]。另外,本模型之所以采用豚鼠,是因为豚鼠的耳蜗相比小鼠、大鼠更大,圈数更多,结果相对更好。对于这种高度精细的操作,成功率更高一些。当然本模型的技术难度还是很高,需要良好的解剖知识,高超的手术操作技巧。
