射频消融联合经皮椎体成形术治疗脊柱转移瘤
2021-05-27彭立鹏
李 杰,江 伟,彭立鹏
骨转移已成为晚期恶性肿瘤的常见并发症之一,脊柱是其转移的常见部位[1-2]。大多数脊柱转移瘤患者为溶骨性破坏,最常见的症状为慢性难治性疼痛,也可伴发高钙血症、神经损害、继发椎体压缩骨折、脊髓压迫等[3]。开放手术创伤大、并发症多、恢复时间长,不仅耽误原发肿瘤的治疗,而且不适用于多发性脊柱转移瘤的治疗[4-5]。微创手术因具有创伤小、手术禁忌证少等优势被越来越广泛地用于治疗脊柱转移瘤患者[3]。射频消融(RFA)及经皮椎体成形术(PVP)均属于脊柱的微创术式[6]。2013年10月~2018年10月,我科采用单纯PVP和RFA联合PVP治疗62例脊柱转移瘤患者,本研究探讨RFA联合PVP的疗效,报道如下。
1 材料与方法
1.1 病例资料纳入标准:① 有明确的恶性肿瘤病史并经病理学检查证实;② 经X线、CT、MRI、ECT或PET-CT检查证实为脊柱椎体破坏,或经病理学或细胞学诊断为脊柱转移瘤;③ 胸腰段椎体病灶均为溶骨性病变或以溶骨性病变为主;④ 椎体后缘骨皮质结构完整,不存在明确的神经根受压症状和体征;⑤ 有不同程度的胸、背、腰部疼痛症状;⑥ 经药物等非手术治疗无效;⑦ 预计术后生存期≥3个月。排除标准:① 成骨性病变;② 合并严重的器官功能障碍或凝血功能障碍。本研究共纳入62例,按治疗方法的不同将患者分为对照组(行单纯PVP治疗,30例)和观察组(行RFA联合PVP治疗,32例)。两组术前一般资料比较差异无统计学意义(P>0.05),见表1。入院后患者完善术前检查,明确肿瘤位置。本研究经医院伦理委员会批准,患者均签署知情同意书。
表1 两组术前一般资料的比较
1.2 手术方法患者俯卧位,定位并标记手术区域,2%利多卡因局部麻醉。① 观察组:在C臂机引导下选择穿刺部位、角度和路径,将骨穿刺针经椎弓根穿刺到病变部位,拔出针芯,建立工作通道,于病变中心部位行活检。将射频消融仪电极沿工作通道送入病灶,调整电极针在病灶中心位置,打开电极,设置消融参数:功率150 W,温度75 ℃,维持温度在70~80 ℃,持续时间8~15 min。在不损伤神经和血管的前提下,消融范围应尽量完全覆盖肿瘤病灶并超过其边界0.5~1.0 cm。RFA治疗结束后行PVP。将电极针退回并拔出后,将骨穿刺针芯重新置入穿刺针套管内,C臂机透视下将骨穿刺针穿至椎体前中1/3处,拔出针芯,将拉丝期骨水泥缓慢注入。在侧位透视下观察骨水泥缓慢散开,当充盈接近椎体后壁时停止注入,整个过程中密切观察患者生命体征及双下肢运动及感觉情况。待部分骨水泥硬化后拔出穿刺针,无菌敷料覆盖创口。② 对照组:除采用单纯PVP治疗外,穿刺定位和骨水泥注入均同观察组。
1.3观察指标与疗效评价① 记录骨水泥渗漏率;② 采用VAS评分评价疼痛情况;③ 采用ODI评估功能障碍改善情况;④ 采用KPS评分评估生活质量。
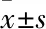
2 结果
患者均获得随访,时间3~12个月。
2.1 两组VAS评分、ODI、KPS评分比较见表2。VAS评分、ODI两组术后各时间点均明显低于术前(P<0.05);术后7 d、1个月、3个月VAS评分及ODI观察组均明显低于对照组(P<0.05)。KPS评分两组术后各时间点均高于术前(P<0.05),两组间各时间点比较差异均无统计学意义(P>0.05)。
2.2 两组骨水泥渗漏率比较见表3。骨水泥渗漏率观察组明显低于对照组(P=0.013)。患者均未出现脊髓或神经根压迫症状,未发生出血、感染、肺栓塞等并发症。
2.3 两组典型病例见图1~6。
3 讨论
3.1 脊柱转移瘤的治疗现状脊柱转移瘤的发病率为3%~30%,其最常见的原发肿瘤为乳腺癌、前列腺癌、肺癌及肾癌[7]。脊柱转移瘤患者中位生存时间约7个月,出现硬膜外转移的患者生存时间 3~6 个月[8]。虽然脊柱转移瘤患者生存期较短,但剧烈的疼痛、大小便功能障碍、肢体无力甚至瘫痪严重影响患者的生存质量[9-10]。目前,临床上多提倡多学科联合协作综合治疗脊柱转移瘤以改善患者生活质量,延长生存期[4]。脊柱转移瘤的外科手术能够迅速缓解患者疼痛,维持脊柱稳定性,是综合治疗中重要的一部分,其主要包括整体切除、减压内固定术及微创手术。微创技术符合现代外科手术“损伤控制”的发展趋势,以手术创伤小、禁忌证少、效果明确等优势被越来越广泛地用于治疗脊柱转移瘤。

表2 两组手术前后VAS评分、ODI、KPS评分比较

表3 两组骨水泥渗漏率比较[例(%)]
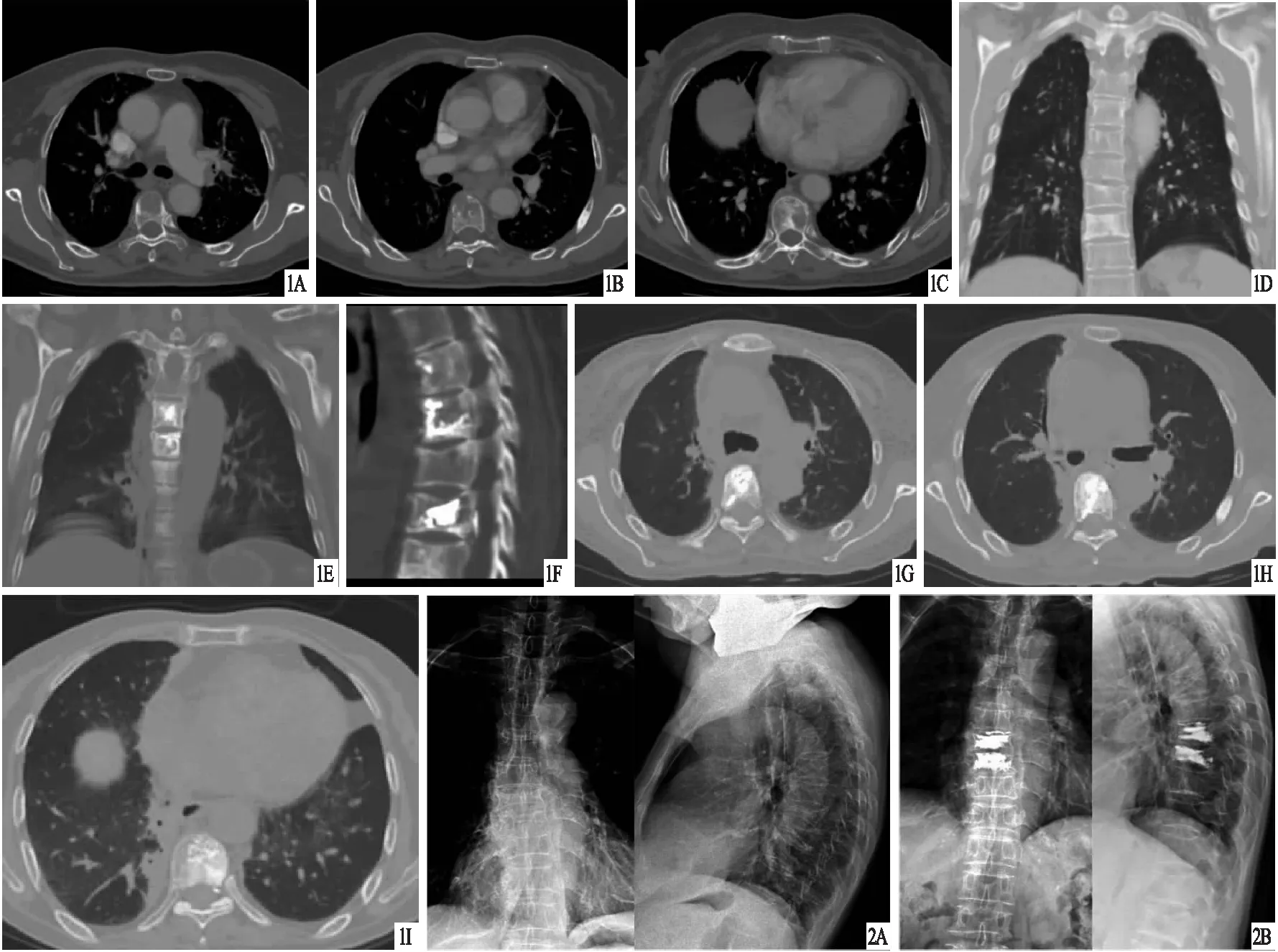
图1 患者,女,66岁,甲状腺癌骨转移,行RFA联合PVP治疗 A~C.依次为术前T7、T8、T10椎体CT横断面,显示均有明显溶骨性破坏;D.术前CT冠状位,显示椎体破坏;E、F.术后24 h CT,显示冠状面及横断面骨水泥均填充在位;G~I.依次为术后1个月T7、T8、T10椎体CT横断面,显示骨水泥填充满意 图2 患者,女,58岁,乳腺癌骨转移,行RFA联合PVP治疗 A.术前X线片,显示T8和T9椎体压缩、破坏;B.术后3个月X线片,显示椎体高度部分恢复,骨水泥填充满意,无渗漏
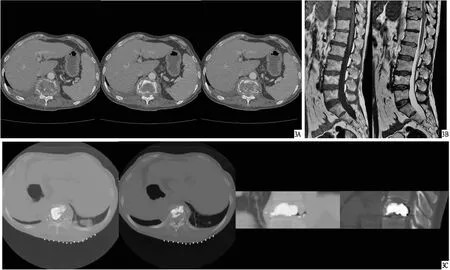
图3 患者,男,52岁,直肠癌多发骨转移,行RFA联合PVP治疗 A.术前CT,显示T11不同层面溶骨性骨质破坏并椎体略变扁,周围软组织肿胀,提示转移瘤并病理性骨折;B.术前MRI,显示T11和胸腰椎部分附件骨质破坏,以T11为著且椎体压缩,周围软组织肿胀,后方椎管变窄(前后径约0.5 cm),该平面髓内示斑片状稍长T2信号影,结合病史提示骨转移瘤,并T11病理性骨折,椎管明显变窄且脊髓受压稍肿胀;扫描区骨质信号稍高(T2WI、DWI);C.术后24 h CT,显示骨水泥填充满意,无渗漏
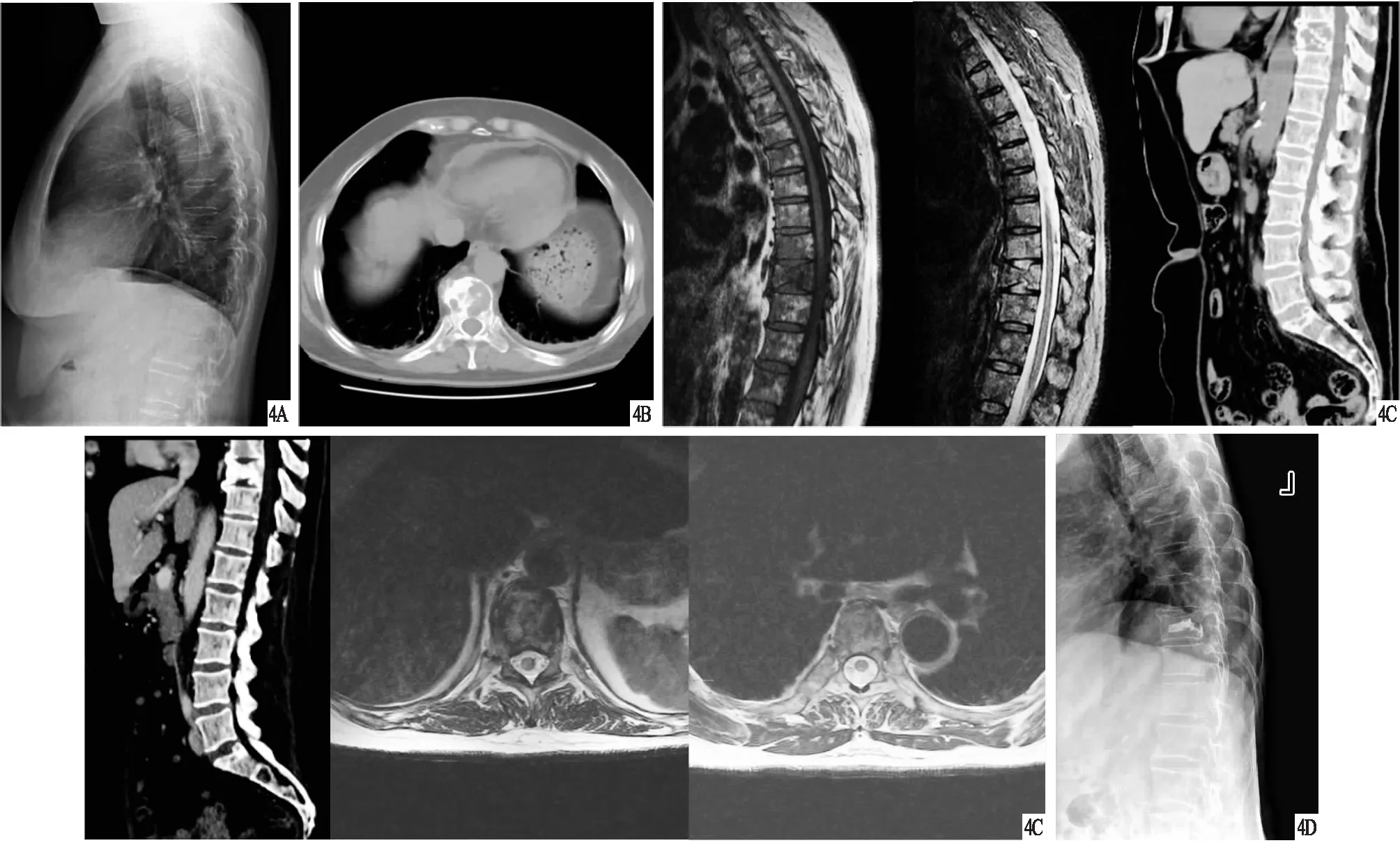
图4 患者,男,68岁,肺癌多发骨转移,行单纯PVP治疗 A、B.术前X线片及CT,显示椎体骨质破坏,虫蚀样改变,考虑骨转移瘤,其中T10椎体病理性骨折;C.术前MRI,显示扫描区多发脊柱和肋骨骨质信号异常,呈长T1稍短T2信号,抑脂序列为高信号,并T10椎体病理性骨折像;D.术后X线片,显示骨水泥渗漏入椎管

图5 患者,男,72岁,肺癌骨转移,行单纯PVP治疗 A.术前X线片,显示双侧多条肋骨、多个胸腰椎骨密度欠均匀,骨质破坏;B、C.术前CT及MRI,显示多处骨质(肋骨、椎骨和髂骨)信号异常;T8、T9、L1椎体变扁,以L1为著,其高度压缩约2/3,T8、T9、L1椎体内示斑片状长T1、短T2信号影,抑脂序列呈高信号,邻近软组织稍肿胀,相邻后方椎管略变窄,最窄前后径约0.9 cm;扫及骨质信号欠均匀(T1WI、T2WI);D.术后X线片,显示骨水泥填充满意,前方椎旁渗漏 图6 患者,男,64岁,肺癌胸椎转移,行单纯PVP治疗 A.术前MRI,显示T2~6各椎体缘稍变尖,T6椎体变扁,椎体前缘压缩约椎体高度1/3,T3~7各椎体及T7右侧肋骨头示斑片状呈等或长T1、T2信号影,STIR呈高信号,以T6椎体为著,增强扫描呈轻度强化(T6、T7),T3~7平面椎旁软组织肿胀;B.术前CT,显示T6椎体稍变扁,椎旁软组织稍肿胀,其内骨质密度欠均匀;C.术后24 h CT,显示骨水泥填充满意
3.2 PVP治疗脊柱转移瘤的疗效及局限性PVP是指在影像系统导向下,利用穿刺针经皮穿刺至椎体内,经通道向肿瘤破坏区注入主要成分为聚甲基丙烯酸甲酯的骨水泥,从而达到快速缓解疼痛、加固病变椎体、控制局部肿瘤进展的目的[3]。PVP的主要作用机制[3]:① 骨水泥在凝固过程中产热并释放细胞毒性物质从而杀伤肿瘤细胞;② 破坏感觉神经末梢而减轻疼痛;③ 破坏肿瘤组织的血液供应,造成肿瘤组织缺血性坏死;④ 骨水泥渗透到骨小梁间隙后固化,可增强椎体强度、维持其原有高度,解除对脊髓的压迫。本研究表明,PVP应用于脊柱转移瘤能较好地缓解溶骨性破坏引起的疼痛,改善患者生活质量,但骨水泥渗漏为其主要并发症。另有研究[11]表明,骨水泥凝固过程中产生的温度维持时间较短,不能彻底破坏椎体内的肿瘤细胞,可能会较快复发。
3.3 RFA联合PVP治疗脊柱转移瘤的疗效分析RFA是指通过影像引导,将射频电极探针定位于肿瘤组织,并通过高速离子震动和摩擦产生一个60~100 ℃的高温区域,使肿瘤组织发生变性坏死,从而灭活肿瘤细胞,达到治疗目的[1]。RFA的主要作用机制[3]:① 通过灭活肿瘤细胞,减少炎性介质和细胞因子(包括白细胞介素、肿瘤坏死因子等)的产生;② 高温破坏了进入骨膜及骨皮质的痛觉传导神经;③ 抑制了肿瘤的破骨细胞生长,从而减轻疼痛。但单纯行RFA不能维持椎体的高度,肿瘤坏死后留下的空洞可能造成椎体压缩骨折及相应的椎管狭窄,RFA联合PVP则可产生互补效应而提高临床疗效[12]。本研究表明,术后7 d、1个月、3个月VAS评分及ODI观察组均明显低于对照组(P<0.05);骨水泥渗漏率观察组明显低于对照组(P<0.05)。RFA联合PVP能更有效地缓解患者疼痛,减轻其功能障碍,这可能与RFA能灭活更广范围的肿瘤细胞有关。我们发现,脊柱转移瘤往往并不规则,骨水泥很难均匀分布在椎体内,而肿瘤坏死后产生的空间更大、更规则,较利于骨水泥均匀分布,能更好地维持椎体高度,从而增强椎体强度及稳定性。本研究中,两组在术中透视下发现骨水泥渗漏即立刻停止注射,患者均未出现脊髓或神经根压迫症状,未发生出血、感染、肺栓塞等并发症。
综上所述,与单纯PVP相比,RFA联合PVP治疗脊柱转移瘤能更有效缓解患者疼痛,减轻其功能障碍并降低骨水泥的渗漏率。但本研究样本量较少,可能导致结果偏倚,还需多中心、大样本的研究。
