羊水细胞染色体核型分析联合基因组拷贝数变异测序技术在产前诊断中的应用*
2021-05-26张素华徐月新
张素华,徐月新,傅 丹
江苏省苏北人民医院产前诊断中心,江苏扬州 225001
羊水细胞染色体核型分析技术是诊断胎儿染色体异常的金标准,但其检测周期长、分辨率较低,无法检出5 Mb以下的基因组拷贝数变异(CNVs)。染色体微阵列分析(CMA)为目前主要用于全基因组范围CNVs检测的技术[1]。然而,该技术成本较高,通量较低,实验程序较复杂,因此限制了其在产前诊断中的大规模使用。而且CMA探针覆盖范围有限,导致一部分致病性CNVs可能无法被检出[2-3]。下一代测序(NGS)技术的出现,使得CNVs的检测范围更广、通量更大、费用更低,报告周期更短,而且所需DNA量更少,临床适用性更强[4-6]。虽然国内外学者对基因组拷贝数变异测序(CNV-Seq)技术做了一些临床应用探讨[7-9],但国内对染色体核型分析联合CNV-Seq技术的临床应用报道尚不多见。因此,本研究选取了2017-2019年在本院进行产前诊断,并选择两种技术联合检测的316例病例进行回顾性分析,以探讨羊水细胞染色体核型分析联合CNV-Seq技术在临床中的应用价值,现将结果报道如下。
1 资料与方法
1.1一般资料 2017年1月至2019年12月到本院产前诊断中心就诊的具备高危指征的单胎妊娠且接受羊膜腔穿刺的孕妇共计316例,年龄15~48岁,中位年龄30岁;高龄组 (≥35岁)87例(27.53%), 低龄组(<35岁)229例(72.47%);孕周17~29周。产前诊断指征主要包括高龄(≥35岁)、产前筛查高风险、不良孕产史(包括胚胎停育、死胎、流产、胎儿畸形等非正常妊娠情况)、B超指标异常(包括结构畸形及软指标异常)、高通量测序无创产前筛查(NIPS)提示高风险、染色体异常携带者、孕妇本人智力落后、孕早期接触有毒物质、妊娠合并其他疾病等。所有接受羊水穿刺的孕妇及家属均被充分告知羊水细胞染色体核型分析及CNVs-Seq的临床意义、穿刺的风险、注意事项,在知情同意及自愿选择的情况下签署两份知情同意书。
1.2仪器与试剂 GSL120全自动染色体核型扫描分析系统仪购自德国徕卡公司;Illumina NextSeq500平台购自美国Illumina公司;Thermo Forma CO2培养箱购自美国Thermo Fisher公司;羊水培养基购自广州白云山拜迪生物医药有限公司和碧艾生物科技有限公司;秋水仙素购自美国Sigma公司;吉姆萨染液购自上海乐辰生物科技有限公司;枸橼酸三钠、三羟甲基氨基甲烷、冰醋酸(分析纯AR)、甲醇(分析纯AR)均购自国药集团;胰蛋白酶购自美国Amresco公司;基因组DNA抽提试剂盒购自德国QIAGEN公司;测序反应通用试剂盒购自杭州贝瑞和康基因诊断技术有限公司。
1.3方法
1.3.1羊水细胞染色体核型分析 抽取羊水标本后进行细胞培养及中期染色体制备,G显带后,每份标本至少计数20个分裂相,至少分析5个核型,至少达到320条带水平,按照人类细胞遗传学国际命名体制(ISCN2009)[10]标准对孕妇染色体命名,如有异常加倍计数和分析。
1.3.2CNV-Seq (1)标本采集、DNA提取、文库构建及测序:通过羊膜穿刺术获取胎儿羊水标本5 mL,通过短串联重复序列(STR)排除母血污染,然后按照基因组DNA抽提试剂盒的说明书提取胎儿DNA,将50 ng基因组DNA经过随机消化,末端补平,连接接头;通过聚合酶链反应(PCR)进行富集、磁珠纯化后得到DNA文库,最后在Illumina NextSeq500平台上对DNA文库进行测序,采用FASTQ数据质控;检测分析非整倍体及全基因组范围CNVs。(2)数据判读:采用ChAS2.0软件,选取长度≥100 kb缺失/重复片段(可信度≥90%)进行分析。根据CNVs的性质不同,将其分为致病性、可能致病性、致病性未知(意义未明)、可能良性及良性CNVs 5类[11]。为了临床数据分析的需要,本研究只对前3类CNVs进行分析[12]。数据分析参照在线公共数据库,如OMIM、DGV、DECIPHER等,并查阅相关文献进行CNVs的判读。
2 结 果
本研究中316例孕妇同时进行羊水细胞染色体核型分析和CNV-Seq检测,结果发现,两种方法联合检测共发现49例异常,占受检人数的15.51%;其中两种方法同时发现异常共16例,结果见表1;羊水细胞染色体核型分析结果异常而CNV-Seq未检出异常的有8例(主要是平衡易位,结果未显示);胎儿CNV-Seq检测结果异常而染色体核型分析结果正常25例,结果见表2。羊水细胞染色体核型分析结果异常24例,占受检总人数的7.59%,包括染色体数目异常13例,结构异常11例,结构异常中包括平衡易位8例,非平衡易位3例;CNV-Seq检测结果异常41例,占受检总人数的12.97%,包括染色体数目异常13例,结构异常28例,结构异常包括致病性CNVs 10例,可能致病性CNVs 7例,致病性未知CNVs 11例。
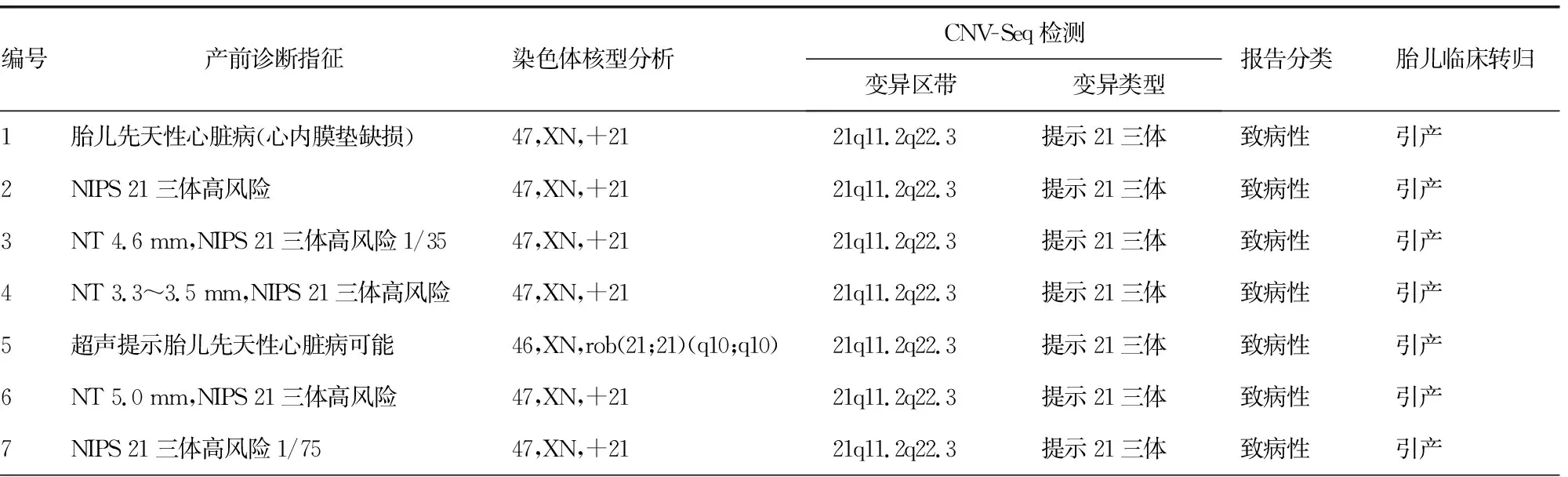
表1 16例羊水细胞染色体核型分析及CNV-Seq检测均异常结果
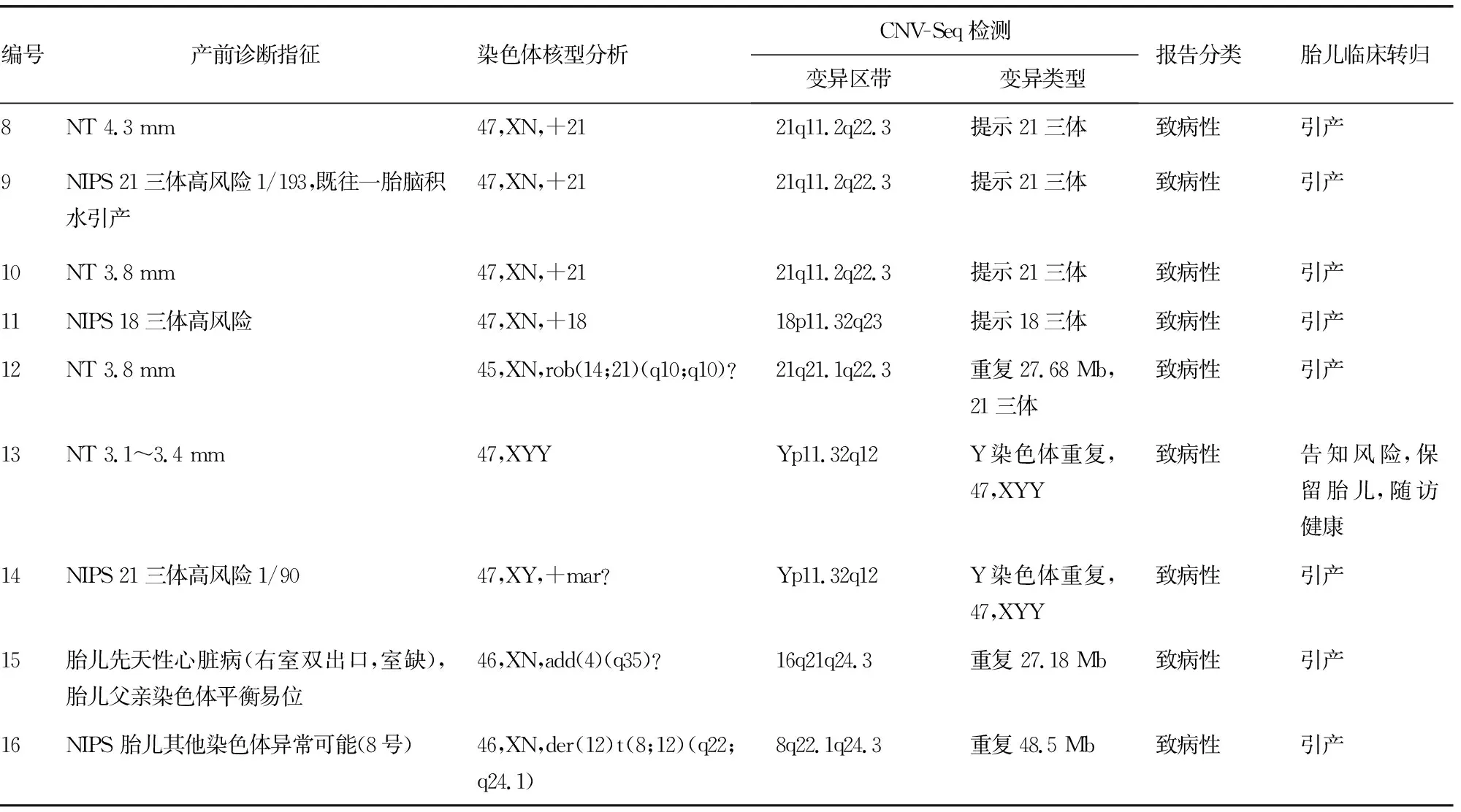
续表1 16例羊水细胞染色体核型分析及CNV-Seq检测均异常结果
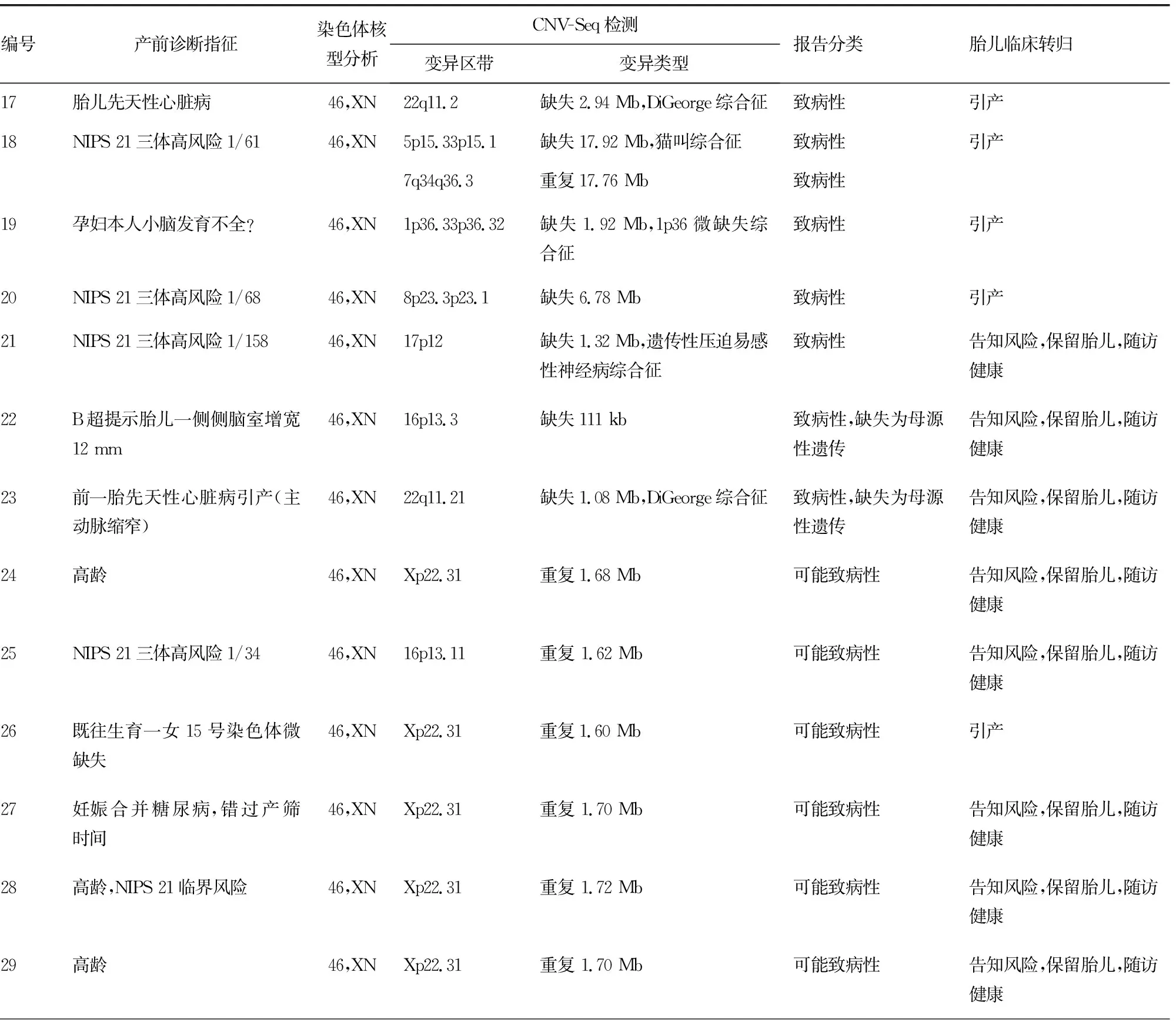
表2 25例羊水细胞染色体核型分析正常及CNV-Seq检测异常结果
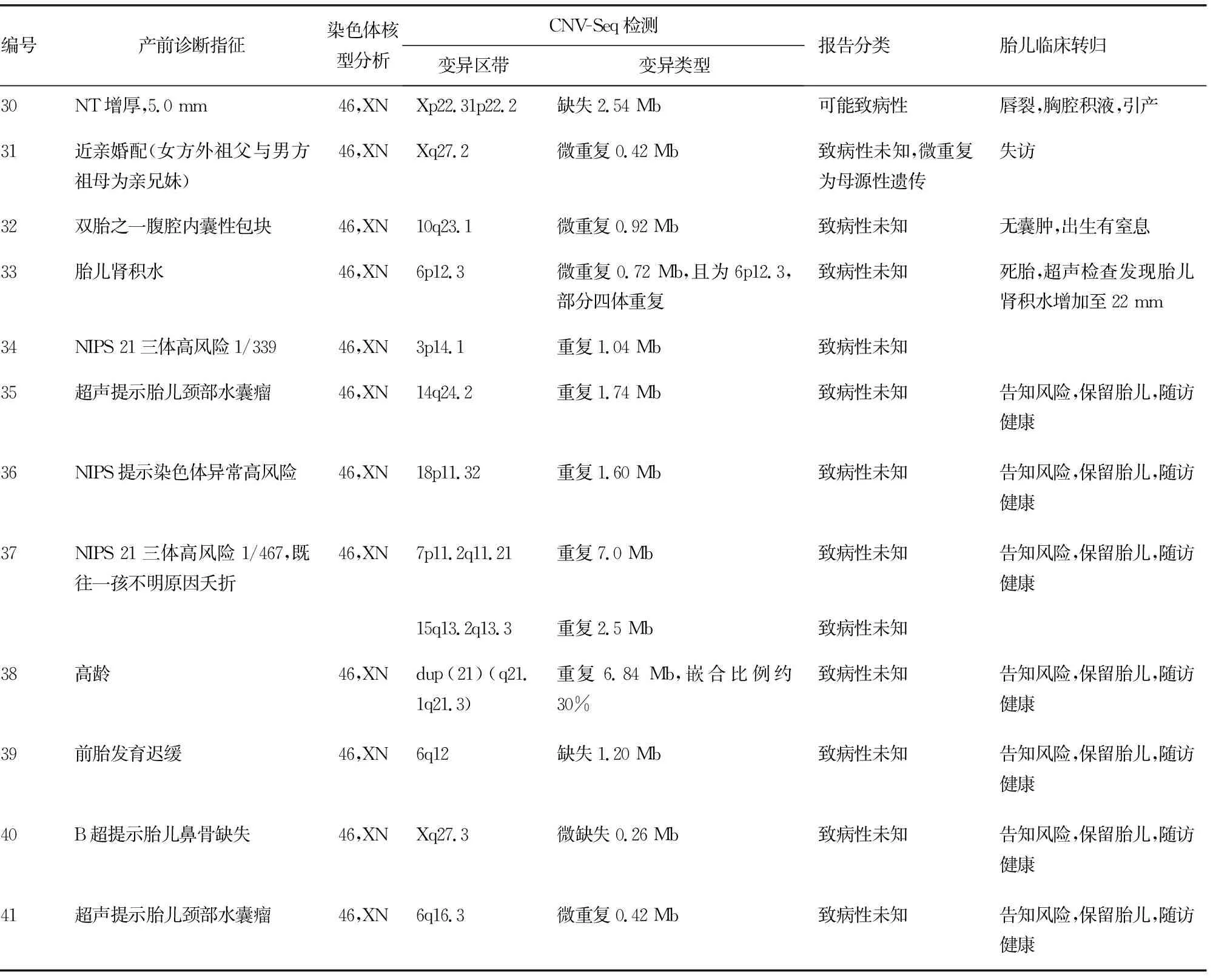
续表2 25例羊水细胞染色体核型分析正常及CNV-Seq检测异常结果
3 讨 论
胎儿染色体数目或结构异常是导致胎儿畸形、流产、死胎及新生儿死亡的主要原因,传统细胞遗传学分析难以发现染色体亚显微结构改变,即CNVs。目前为止,已明确由CNVs所致的染色体微缺失及微重复综合征已达300余种[13-14],综合发病率约为1/600[13],占染色体畸变所致出生缺陷的一半[15]。有研究表明,核型分析正常但超声提示结构异常的胎儿中,有6%~7%存在明确致病或可能致病的CNVs[16-18]。
本研究对316例孕妇进行羊水细胞染色体核型分析和CNV-Seq检测,结果发现,两种方法联合检测共发现49例异常,占受检总人数的15.51%。染色体核型分析结果异常的有24例,占受检总人数的7.59%,CNV-Seq检测结果异常的有41例,占受检总人数的12.97%,该技术对致病或可能致病的染色体异常的检出率为9.49%(30/316),与染色体核型分析技术相比,提高了1.90%的异常检出率,与其他研究报道结果相似[8,11-12]。
CNV-Seq技术可以检测出所有的染色体非整倍体异常,如21三体、18三体、性染色体异常,并且对于核型分析无法判断染色体来源的异常片段能更精准地定位,对临床遗传咨询及胎儿的去留提供更有力的依据,如本研究中的12、14、15及16号孕妇的胎儿。12号孕妇的胎儿有一条非正常的21号染色体,且14号染色体发生了罗伯逊易位,经CNV-Seq检测分析,发现为21号染色体大片段重复,符合21三体的诊断;14号孕妇的胎儿染色体核型分析见mar,但不能断定是Y染色体,CNV-Seq检测提示为Y染色体,临床诊断为47,XYY;15号孕妇的胎儿父亲存在着4号与16号的染色体平衡易位,所以胎儿染色体中发生了不平衡的易位,16号染色体和4号染色体分别发生了重复和缺失,后经数据库查询所引起的临床表型和B超提示的胎儿先天性心脏病相符合,提示为致病性CNVs;16号孕妇NIPS提示胎儿其他染色体异常可能(8号),经CNV-Seq检测,提示8号染色体q22.1q24.3区段存在约48.5 Mb大小的拷贝数重复,属于8号染色体长臂三体综合征,临床表现包括身材矮小、特殊面容、隐睾等,因此该拷贝数变异也是致病性CNVs。本研究表1中的16例染色体核型分析及CNV-Seq检测均异常结果的胎儿,只有1例47,XYY的胎儿在家属知情同意后保留,其余胎儿家属知情同意后均选择引产。
CNV-Seq能够发现染色体的微重复及微缺失。在羊水细胞染色体核型分析正常的标本中共发现了7例致病性CNVs,7例可能致病性CNVs,11例致病性未知的CNVs。7例致病性CNVs中17、18及19号孕妇胎儿的异常结果可以引起临床常见的DiGeorge综合征、猫叫综合征及1p36微缺失综合征,值得一提的是18号孕妇胎儿,CNV-Seq提示5p15.33p15.1缺失17.92 Mb,7q34q36.3重复17.76 Mb,这么大片段的缺失和重复在核型中为什么没有明显地表现出来?后来通过分析发现原来5号染色体短臂末端其实是7q34q36.3易位至此,两个缺失和重复的片段很相似,而两条7号染色体正常,所以羊水细胞染色体核型没有发现异常。如果这例孕妇没有选择进行胎儿的CNV-Seq检测,则很有可能导致猫叫综合征的患儿出生,从而给家庭带来沉重的精神和经济压力。此外,本研究还发现,可能致病性及致病性未知的CNVs所占比例也很高,这给临床遗传咨询工作带来了困难和挑战,需要结合胎儿的其他检查结果及胎儿父母CNVs的溯源检测结果进行分析,如果可能致病性及致病性未知的CNVs源自胎儿父母,可能对孕妇的遗传咨询有所帮助[19],如果是新发的CNVs,根据美国医学遗传学与基因组学学会(ACMG)的建议则需要进行随访[20]。而对于大多数的国内孕妇,由于CNV-Seq费用偏高,一般拒绝做进一步的胎儿父母溯源检测,如果没有特殊情况则选择保留胎儿。
CNV-Seq技术不能检测染色体的平衡易位及倒位[11,21],这类携带者出生后可能无异常临床表现,成年后也有生育能力,但因产生异常配子的可能性大,反复发生流产,且生育染色体异常患儿的风险也随之增加。这类携带者生育期可根据实际情况选择合适的生育方案,例如自然妊娠后进行孕期产前诊断,或者利用胚胎植入前遗传学诊断技术选择诊断正常的胚胎移植[7]。本研究中的8例染色体平衡易位未能被CNV-Seq技术检测出,这也说明易位的过程中没有发生染色体的微缺失和微重复,为胎儿的保留提供了有利的证据。此外,若该异常染色体遗传来自临床表型正常的双亲,则大部分胎儿表型仍可能为正常,若为新发变异则可能破坏或打断原体内正常基因的表达活性,导致疾病的发生,因而需要结合超声及临床检测结果进行充分评估[22]。本研究中8例发生染色体平衡易位的胎儿均保留,目前随访均未见异常表型。
综上所述,羊水细胞染色体核型分析和CNV-Seq检测在产前诊断中各有优缺点,遗传学产前诊断结果的准确性依赖于分子遗传学的检测结果,在不增加流产的风险下,CNV-Seq检测能为传统的羊水细胞染色体核型分析技术提供有效的补充。两者联合检测,能为孕妇提供更全面、更精准的产前诊断结果。
