Semaphorin 3A对低氧导致人肾小球内皮细胞转分化的影响※
2021-05-26单真珍罗朋立
单真珍,刘 燕,罗朋立
(1.青海大学医学院,青海 西宁 810001;2.青海大学附属医院肾病科,青海 西宁 810001)
肾脏纤维化是多种病因引起的慢性肾病(chronic kidney disease,CKD)发展至终末期肾病(end stage of renal disease,ESRD)的共同病理特征,而低氧是引起肾脏纤维化最主要的因素[1]。肾脏纤维化以细胞外基质(extracellular matrix,ECM)尤其是肌成纤维细胞积聚为主要特征[2]。近年来的研究显示,肾脏纤维化中肌成纤维细胞有10%来源于内皮细胞间质转分化(Endothelial-Mesenchymal Transition,EndMT)[3]。EndMT是指内皮细胞失去其特有的表型,而获得间质细胞表型及生理特征的一个生物学过程。在抗肾小管基底膜疾病的啮齿动物模型中首次发现“肾小管上皮细胞通过基底膜迁移至间质后,转分化为肌成纤维细胞”的现象[4],提示细胞迁移是细胞发生转分化的前提。糖尿病小鼠中足细胞特异性过表达Sema3A会加重肾小球硬化以及肾脏纤维化,当抑制Sema3A后,上述症状可减轻[5],说明Sema3A在肾脏纤维化的过程中起了非常重要的作用。近年来的研究还显示,Sema3A是肾脏血管内皮细胞存活和迁移的调节因子[6],细胞从基底膜脱落是发生转分化的重要环节,但Sema3A是否会影响EndMT过程未见报道。本研究主要探讨Semaphorin 3A对低氧导致人肾小球内皮细胞转分化的影响。
1.材料与方法
1.1 主要仪器和试剂选择
人肾小球内皮细胞株(HGECs)、胎牛血清、内皮细胞培养基及内皮细胞生长因子由ScienCell公司生产,小鼠抗人CD31及α-SMA一抗由abcam公司生产,共聚焦显微镜由德国Zeiss公司生产,细胞培养皿由Thermo公司生产,信号素3A(Sema3A)酶联免疫吸附测定试剂盒由ELabscience公司生产,Human Semaphorin3A/SEMA3A Protein由Sino Biological公司生产,二氧化碳培养箱由Thermo公司生产,全波长酶标仪(SpectraMax Plus 384型)由美国MD公司生产,电泳系统和凝胶成像仪由Bio-RAD公司生产。
1.2 HGECs实验分组
原代HGECs包被复苏后在37 ℃、5% CO2培养箱中增殖,每两天更换一次培养基(含5%sFBS和1×青链霉素的ECM培养基)。在显微镜下观察,细胞形态呈鹅卵石样或卵圆形,贴壁生长,生长达90%融合状态后传代培养,选取第4~6代细胞用于本实验。按完全随机法设计分组,在体外给予HGECs不同的实验条件,将贴壁细胞(细胞消化、接种至培养瓶后置于正常氧浓度培养10小时)分成低氧组[予以含5%sFBS和1×青链霉素的ECM培养基置1%低氧(1%,5% CO2,95%N2)培养箱培养5天]、低氧干预组[予以含200ng/mL外源性Sema3A的ECM培养基置1%低氧(1%,5% CO2,95%N2)培养箱培养5天]、常氧组[予以含5%sFBS和1×青链霉素的ECM培养基置于常氧(21% O2、5% CO2、74% N2,37℃)培养箱培养5天]。
1.3 细胞计数
将生长占培养瓶90%的细胞消化、离心(半径12.36cm,1000r/min,5min),弃上清液,加入新鲜培养基,反复吹打均匀,在1.5 mL的EP管中加入900 μL 1×DPBS缓冲液,再次加入100 μL上述细胞悬液(稀释10倍)吹打均匀后,取出10 μL稀释好的细胞悬液加到干净且干燥的计数板上,在显微镜下数8个16方格的细胞数,位于方格边缘的细胞按数上不数下、数左不数右的原则计数,细胞数/mL=8个16方格细胞数总和/8×104×10(稀释倍数)。
1.4 细胞上清液提取
将生长占培养瓶90%左右的细胞消化、离心(半径12.36cm,1000r/min,5min),弃净上清液,加入新鲜培养基(5%FBS)后重悬,按照上述细胞计数方法对细胞进行计数,并将细胞悬液稀释成2×104个/mL,之后将细胞悬液移入培养瓶中,每瓶1 mL,然后补足新鲜的完全培养基,在常氧培养箱中培养10小时,待贴壁后分常氧组(21% O2)、低氧组(1% O2)和低氧干预组(1% O2+外源性Sema3A干预),将细胞放在常氧和低氧(1%氧浓度)培养箱分别培养1、3、5天,之后用移液枪分别吸取上述培养瓶中的上清液,转移至无菌的1.5 mL的EP管中,离心(半径12.36cm,12000r/min,4℃,15min),取上清液,弃沉淀,置-20 ℃冰箱保存。
1.5 低氧对HGECs培养上清液中Sema3A表达的影响
通过ELISA法测试。根据上述方法提取细胞上清液后,具体操作根据Sema3A 酶联免疫吸附测定试剂盒说明书进行。
1.6 转分化蛋白检测
通过Western Blot法检测。用BCA法测蛋白浓度,按SDS-PAGE凝胶试剂盒说明书配置10%的分离胶及5%浓缩胶,上样前加入5×蛋白上样缓冲液,每孔上样30 μg,先在恒压(80mV)下电泳15 min,再切换至120 mV下电泳约60 min,待蛋白样本达到分离胶的底部时,停止电泳。将PVDF膜剪切、激活、覆盖后在恒定电流(180m A)下转膜2小时,取出PVDF膜,浸泡于脱脂牛奶中封闭(室温,2小时),孵育相应一抗(4℃冰箱内过夜),用1×TBST洗涤7次,5 min/次。孵育相应二抗2小时,洗膜后用ECL化学发光成像系统显影。使用Quantity One软件分析并计算蛋白灰度值。
1.7 统计学处理

2.结果
2.1 低氧培养下HGECs的形态变化
倒置显微镜下可见各组细胞均匀的贴壁生长,边界清晰,胞膜光滑,胞核透亮,折光性较强,呈克隆性生长,7~8天融合达90%左右,逐渐出现接触抑制现象。常氧组细胞呈“铺路石”或“鹅卵石”外观;相较于常氧组,低氧组和低氧干预组细胞培养5天后细胞形态发生了明显变化,尤其是低氧组,几乎所有的细胞胞体增大,细胞之间间隙变大,连接减少且紊乱,单个细胞外观呈长梭形或纺锤形,总体呈离散状甚至呈“棋盘状”生长;低氧干预组的细胞仅有少数细胞形态发生了变化,多数细胞还是呈“铺路石”样外观(图1)。
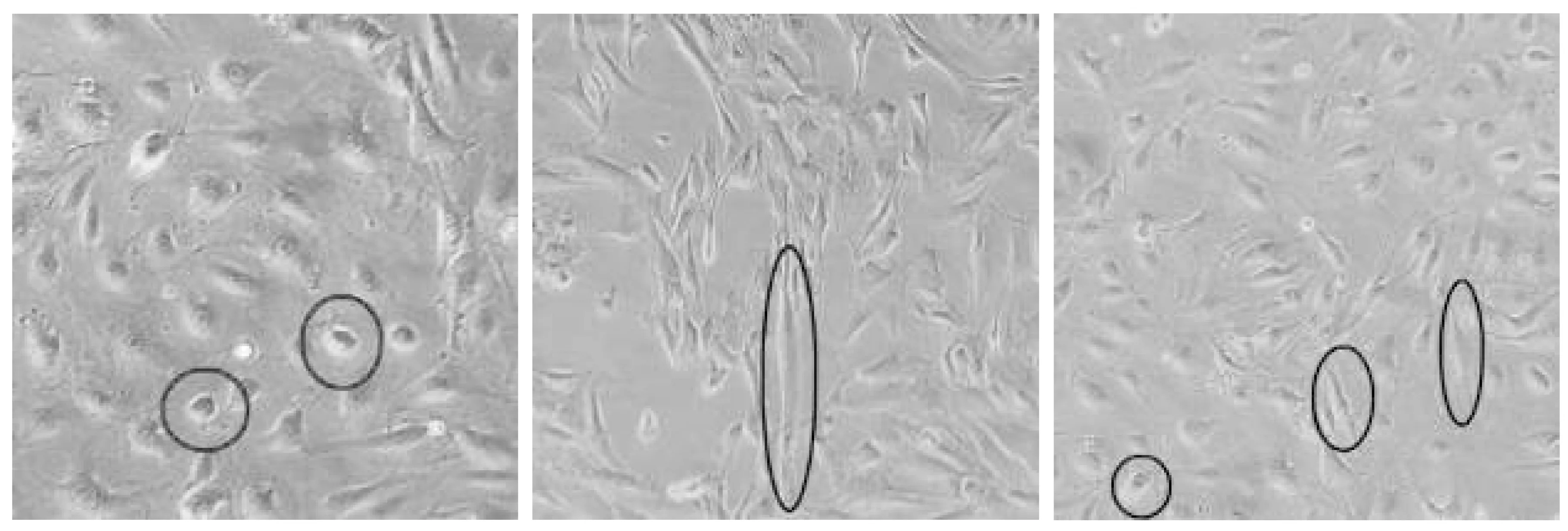
常氧组 低氧组 低氧干预组
2.2 低氧对HGECs上清液中Sema3A表达的影响
ELISA结果显示,常氧组和低氧组HGECs均有Sema3A分泌。与常氧组相比,低氧明显抑制了Sema3A的分泌,在第五天最显著,P<0.05(表1)。

表1 低氧对HGECs上清液中Sema3A表达的影响
2.3 低氧对HGECs α-SMA和CD31蛋白表达的影响
Western Blot结果显示,三组HGECs中α-SMA和CD31蛋白表达差异均有统计学意义(Fα-SMA=686.468,P<0.05;FCD31=5884.993,P<0.05)。低氧处理5天后,相较于常氧组,低氧组和低氧干预组中的CD31表达均明显降低(P<0.05),α-SMA表达均明显升高(P<0.05);相较于低氧组,经外源性Sema3A干预后CD31表达仍下降(P<0.05),α-SMA表达有所降低(P<0.05),但仍高于常氧组(表2,图2)。

表2 低氧对HGECs转分化蛋白α-SMA和CD31含量的影响结果
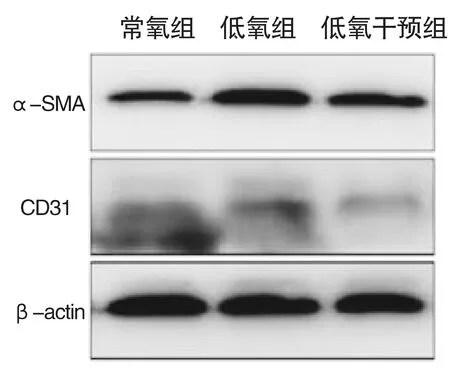
图2 Western Blot检测HGECs转分化蛋白α-SMA和CD31图
3.讨论
3.1 低氧诱导人肾小球内皮细胞向肌成纤维细胞转分化
EndMT是指内皮细胞在各种病理因素如缺氧、炎症因子、机械损伤等刺激下,内皮细胞失去了细胞之间的粘附性和顶端-基底部的极性,转变成了瘦长纺锤状梭形并获得高度侵袭性和迁移性的间充质细胞。这一过程中最重要的是生物学的改变,即内皮细胞表面标志物表达的减少和间质细胞表面标志物的增多,接受EndMT的内皮细胞其表型标志物CD31表达减少甚至消失,而纤维细胞特性的α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)表达增加[2]。近年来的研究显示,EndMT是肾组织中肌成纤维细胞的主要来源。缺氧已被认为是引起不同组织(肝脏,心脏,肺脏)纤维化的重要原因[7-10],并且参与了EndMT的过程[2,7,11]。EndMT在梗阻性和糖尿病肾病、缺血-再灌注损伤和Alport综合征的动物模型中有报道[12,13]。在糖尿病肾病、免疫球蛋白A肾病、狼疮性肾炎和移植失败的患者肾活检中也发现了EndMT[14-16]。有证据表明,低氧是促使内皮细胞发生EndMT的有效诱导因素,我们在体外培养的人肾小球内皮细胞中发现,低氧组细胞发生了由“铺路石”样外观向“长梭形” 样外观转变,这种细胞形态与肌成纤维细胞非常类似。同时我们还发现低氧环境下内皮细胞表面标志物CD31表达减少,而肌成纤维细胞标志物α-SMA表达增加,提示低氧可以诱导人肾小球内皮细胞向肌成纤维样细胞转化。
3.2 Sema3A影响低氧诱导的人肾小球内皮细胞转分化
Sema3A是一种趋化导向蛋白,在许多器官和组织(神经、心血管、肺脏、肾脏)的形成过程中发挥了重要作用,并参与了细胞死亡[17]、细胞粘附和聚集[18]以及细胞迁移和血管重构等调控过程[19]。在肾脏组织中,Sema3A主要在肾小球上皮细胞、足细胞和远曲小管、集合管表达[20,21],是肾脏血管内皮细胞存活和迁移的调节因子[6]。小鼠动物模型显示,Sema3A缺乏时可导致肾内Flk1-LacZ阳性内皮细胞增多,毛细血管腔内内皮细胞增殖、迁移受抑制并因此引起血管形态的异常[6]。给健康小鼠注射重组Sema3A 4小时后,肾小球内皮细胞肿胀、窗口缺失和损伤,表现为空泡和部分脱落[22]。足细胞过表达Sema3A可诱导内皮细胞凋亡,Sema3A与内皮细胞结合,抑制其迁移[19]。在共培养实验和迁移实验中,重组Sema3A抑制内皮细胞向胚胎肾外植体迁移,表明Sema3A在肾小球内皮细胞迁移中起着非常重要的化学反应导向信号作用[6]。有研究显示,Sema3A在肾脏纤维化中也起到了非常重要的作用,在动物模型中发现糖尿病小鼠中足细胞特异性过表达Sema3A会加重肾小球硬化以及肾脏纤维化[5],随后的研究发现当糖尿病小鼠的Sema3A基因表达突变时,其促纤维化基因表达减少,肾小球硬化和间质纤维化程度减轻,肾功能得以改善[23]。采用新型Sema3A抑制肽,对糖尿病引起的蛋白尿、肾纤维化有抑制作用[24,25]。以上研究均显示Sema3A不仅影响了内皮细胞的迁移和生存,也在肾脏纤维化的进程中发挥重要作用。本研究首先对Sema3A在肾脏组织细胞中的定位有了进一步的认识:既往认为Sema3A在肾脏组织中主要定位在肾小球上皮细胞、足细胞和远曲小管、集合管[20,21],但我们通过ELISA检测发现,在常氧与低氧环境下获得的条件细胞培养上清液中有Sema3A表达,说明人肾小球内皮细胞可分泌Sema3A,这与Vacca A的报道一致[26]。重要的是我们发现,低氧组细胞上清液中Sema3A浓度均明显低于对照组,提示低氧环境抑制了细胞Sema3A的分泌。其次对常氧和低氧两组细胞中CD31和α-SMA蛋白的表达情况进行了检测,相较于常氧组,低氧组细胞中CD31表达减少,而α-SMA表达增加。当向低氧条件下的HGECs中加入外源性Sema3A后,与低氧组相比,HGECs细胞中的CD31表达进一步降低,提示Sema3A可抑制CD31的表达。CD31主要在内皮细胞细胞间连接处高度表达,对维持内皮细胞连接完整性起非常重要的作用,当其表达下降时可破坏细胞间连接,有助于细胞从基底膜脱离,细胞从基底膜脱落是转分化关键的一个环节。因此低氧条件下Sema3A低表达有助于维持细胞间连接的完整性,这是一种保护性反应。同时我们发现,受低外源性Sema3A刺激后α-SMA表达反而有所下降,因α-SMA是肌成纤维细胞的标志性蛋白,因此我们推测Sema3A不能直接诱导细胞发生转分化。在Sema3A参与的纤维化过程中,其更多的作用可能是促进细胞间连接破坏,促进细胞脱落,以有利于向纤维细胞的转化。
综上所述,我们认为低氧可抑制人肾小球内皮细胞Sema3A表达,此有利于CD31的表达,有助于维持细胞间连接的完整性,这可能是细胞在低氧条件下的保护性反应。
