内界膜填塞与翻转覆盖治疗大直径特发性黄斑裂孔的疗效对比王爱芹
2021-05-26高自清张锐
高自清 张锐
黄斑裂孔是指黄斑中心凹部视网膜神经上皮层从内界膜层到光感受器细胞层出现的组织缺损,是常见的玻璃体视网膜疾病,严重损害患者的中心视力。特发性黄斑裂孔(idiopathic macular hole,IMH)是指排除眼外伤、玻璃体视网膜病变等原发眼部病变的年龄相关性黄斑裂孔,发病率占所有黄斑裂孔的83%[1]。随着特发性黄斑裂孔病因、发病机制研究的不断进展,其手术治疗方式也在不断改进。目前的标准术式是经睫状体平坦部玻璃体切割+内界膜剥除术,解除了裂孔周围的切线牵拉作用,刺激Müller细胞增生,促进裂孔愈合[2]。但是应用于大直径的特发性黄斑裂孔时,闭合率较低[3],且会出现视网膜结构改变、视野缺损等不良后果。改良黄斑裂孔手术中,玻璃体切除联合内界膜翻转覆盖术在解除牵引力的同时为神经胶质细胞的增生提供支架,提高了裂孔闭合率[4]。玻璃体切割联合内界膜填塞术在大直径黄斑裂孔的治疗中也取得了良好的闭合率和视觉预后[5]。本研究观察大直径特发性黄斑裂孔患者行内界膜填塞术或内界膜翻转覆盖术手术前后黄斑区形态及血流特征变化,比较分析两种术式的临床疗效,从而促进黄斑裂孔闭合机制的进一步研究,优化术式选择。
资料与方法
一、 一般资料
选取2019年2月至2020年2月在蚌埠医学院第一附属医院眼科收治的特发性黄斑裂孔且裂孔最小直径>600 μm的患者为研究对象,27例(27只眼),男性9例,女性18例,年龄45~80岁,平均年龄为(63.41±8.41)岁。已排除合并眼部外伤史、视网膜脱离、糖尿病性视网膜病变、年龄相关性黄斑变性、葡萄膜炎等疾病的病例;无法耐受手术的病例;高度近视者;高眼压(≥21 mmHg)或青光眼患者;有明显白内障未行手术治疗者。

表1 患者基本情况
二、治疗方法
1.术前检查:所有患者术前均行最佳矫正视力(best corrected visual acuity,BCVA)、眼压、裂隙灯+90D前置镜眼底检查、IOL-Master、眼部B型超声、相干光层析成像术(optical coherence tomography, OCT)、相干光层析血管成像术(optical coherence tomography angiography, OCTA)检查。其中OCTA检查选择视网膜血流成像扫描模式(Angio retina 3.0 mm)。
2.分组标准:将纳入研究的27例患眼随机分为A、B两组,其中A组15例均行玻璃体切除+内界膜填塞+玻璃体腔消毒空气填充术,B组12例均行玻璃体切除+内界膜翻转覆盖+玻璃体腔消毒空气填充术。手术均由同一位经验丰富的眼底病医师完成。
3. 手术方法:术前准备:术前予以抗生素滴眼液点眼、泪道冲洗、结膜囊冲洗等处理。手术操作:手术均在2%利多卡因球后麻醉条件下行标准25G三通道玻璃体切割,切割中轴玻璃体后,曲安奈德染色玻璃体,完成玻璃体后脱离,切割周边玻璃体。稀释后吲哚青绿溶液染色内界膜,A组使用内界膜颞环形撕除裂孔周围约2 PD大小内界膜,内界膜不完全剥离,留有一蒂与孔缘相连,玻切头修剪内界膜瓣(内界膜瓣的大小取决于裂孔直径)后填塞至裂孔内。B组环形撕除裂孔周围约2 PD大小内界膜,但保持下方内界膜瓣(内界膜瓣的大小取决于裂孔直径)与孔缘相连,将其向上反折并覆盖在裂孔上。操作完成后,两组均行缓慢气液交换,防止内界膜瓣移位,玻璃体腔内注入消毒空气,拔出套管针,整合切口,棉签轻轻按摩,不予以缝合。检查切口是否有渗漏,若切口有明显渗漏,则使用8-0可吸收缝线缝合。术后处理:术后予以局部抗感染治疗;严格俯卧位休息至玻璃体腔内气体吸收;监测眼压变化,如有眼压升高,排除禁忌证后予以卡替洛尔或布林佐胺滴眼液点眼。
4.术后随访:患者术后分别于1个月、3个月行BCVA、裂隙灯+90D前置镜眼底检查、眼压、OCT、OCTA检查。记录BCVA、裂孔闭合形态、外界膜(external limiting membrane,ELM)缺损直径、中心凹无血管区(foveal avascular zone,FAZ)面积变化。
三、统计学分析
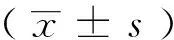
结 果
一、裂孔闭合情况
术后随访3个月结束时,所有患者均无视网膜脱离。内界膜填塞组14只眼裂孔闭合(93.33%),其中4只眼呈U型闭合(26.67%),1只眼未闭合。内界膜翻转覆盖组10只眼闭合(83.33%),其中7只眼呈U型闭合(58.33%),2只眼未闭合。见图1。两组裂孔闭合率差异无统计学意义(P>0.05)。
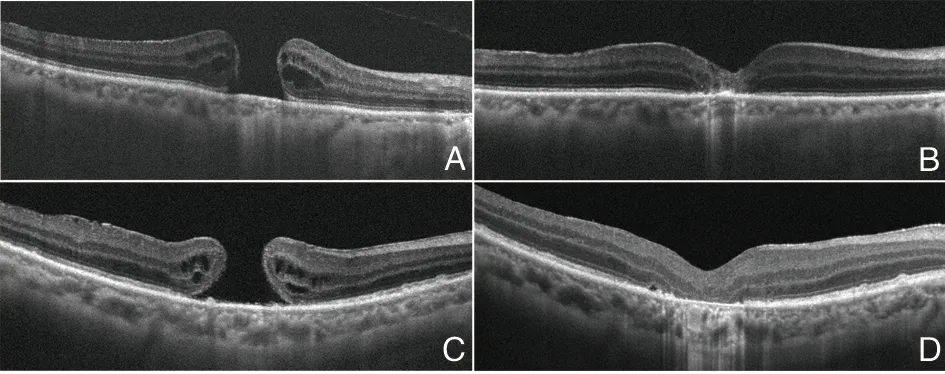
图1 A示玻璃体切除联合内界膜填塞术前OCT检查结果;B示患者术后OCT检查结果;C示玻璃体切除联合内界膜翻转覆盖术前OCT检查结果;D示患者术后OCT检查结果
二、术后视力
术后两组患者BCVA较术前均有明显改善(P<0.05),且翻转覆盖组术后BCVA优于填塞组,术后1个月(t=2.298,P=0.030)、术后3个月(t=2.196,P=0.038)。见表2。
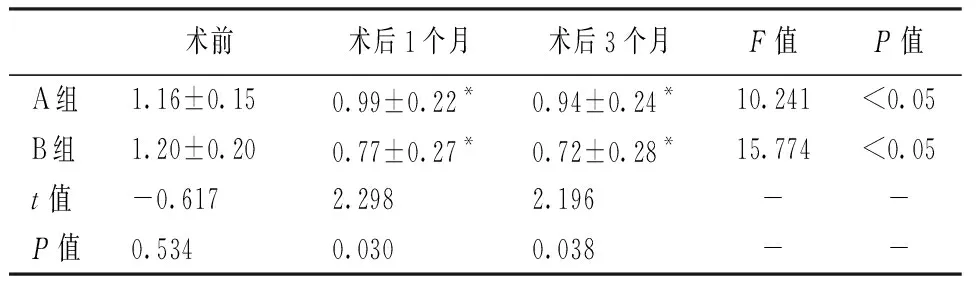
表2 两组各随访时间点平均BCVA(logMAR)
三、ELM缺损直径
术后两组患者ELM缺损直径均较术前减小(P<0.05),但两组间比较差异无统计学意义,术后1个月(t=0.440,P=0.664),术后3个月(t=1.894,P=0.07)。内界膜翻转覆盖组中有3只眼在随访结束时外界膜重新连接(25%),而填塞组未见外界膜重新连接。见表3。
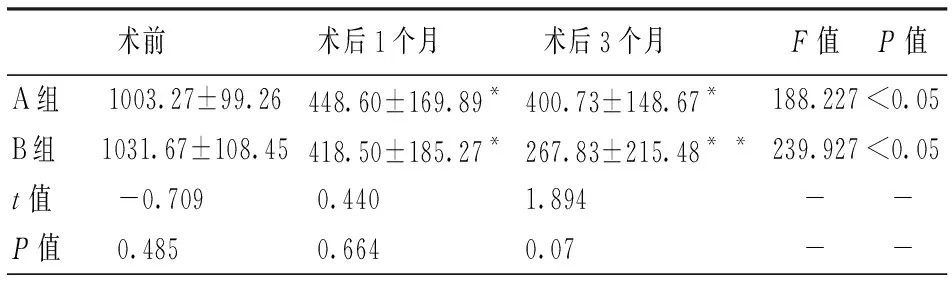
表3 两组各随访时间点平均ELM缺损直径(μm)
四、FAZ变化
术后两组患者FAZ面积(视网膜层)均较术前减小(P<0.05),但两组间比较差异无统计学意义,术后1个月(t=-0.543P=0.592),术后3个月(t=-0.376P=0.710)。见表4。
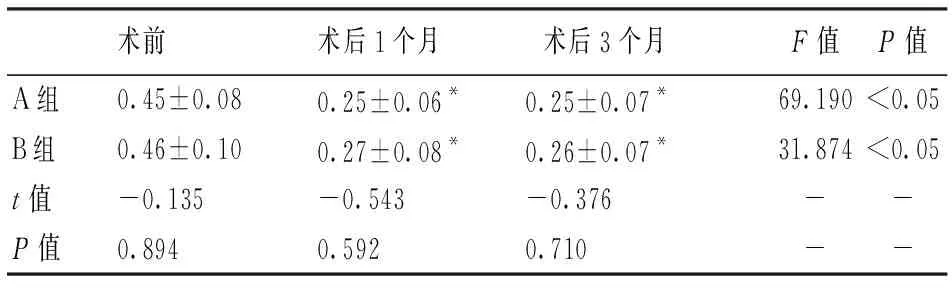
表4 两组各随访时间点平均FAZ面积(mm2)
讨 论
玻璃体切除联合内界膜撕除术是治疗特发性黄斑裂孔最常用的术式[6]。解除了黄斑中心凹处玻璃体后皮质产生的切线牵引力,促进裂孔闭合,但对于大直径黄斑裂孔患者,裂孔闭合率及视力预后仍不理想。并且会产生内层视网膜结构改变、黄斑移位、视敏度下降及视野缺损等并发症[3]。随着研究的不断进展,玻璃体切除联合内界膜填塞术与玻璃体切除联合内界膜翻转覆盖术都是治疗大直径特发性黄斑裂孔有效的手术方式,可以得到较高的闭合率和良好的视力改善。
Michalewska等首次将玻璃体切除联合内界膜翻转覆盖术用于治疗大直径黄斑裂孔,闭孔率达到98%[7]。一方面,ILM中的IV型胶原、纤维连接蛋白和层粘连蛋白可以促进Müller细胞的增殖和迁移,诱导网膜向心运动,另一方面也避免了外层视网膜与玻璃体内物质接触,减少水合作用,维持中心凹持续重塑,带来良好的视力预后[8]。内界膜填塞术可以起到类似作用,但是内界膜填塞至裂孔内的操作可能会造成RPE层的机械性损伤[9],填塞至裂孔内的内界膜阻碍神经上皮层重新连接和光感受器细胞层复位,可能是造成术后视力不佳的原因。无论是内界膜翻转覆盖术还是内界膜填塞术,都可能会有胶质过度增生的风险[10],胶质过度增生可能会延缓邻近光感受器细胞层缺损的修复。
自频域相干光层析成像术(spectral-domain optical coherence tomography,SD-OCT)技术出现后[11],OCT的成像速度、分辨率有了大幅度提升,使黄斑区视网膜各层结构的观察和分析成为可能。椭圆体带缺损直径是指光感受器细胞层两断端间的水平距离,光感受器细胞层将光信号转化成生物电信号向中枢神经传递,它的重建是评价黄斑裂孔术后视力恢复的重要指标[12]。ELM作为光感受器细胞和Müller细胞连接的标志,是评价黄斑裂孔手术疗效的指标,同时也是光感受器细胞层修复的重要条件[13]。本次试验中,翻转覆盖组术后有25%的患者外界膜层重新连接,填塞组未见外界膜层重新连接。翻转覆盖组术后视网膜形态优于填塞组。填塞至裂孔内的内界膜会引起瘢痕愈合[17],可能是术后外界膜不能重新连接的原因。
黄斑裂孔术后FAZ面积减小,提示黄斑中心凹组织发生向心运动[14]。2017年,Kim等[15]应用OCTA比较分析黄斑裂孔患者黄斑区血流特点发现患者术后BCVA与FAZ面积大小显著相关。然而Yun等[16]的试验得出的结论却是最终视力与视网膜血流变化无关。本研究中,内界膜填塞组与翻转覆盖组术后FAZ面积均较术前减小,但组间比较无统计学差异。本次试验未对FAZ面积变化与术后视力进行相关性分析,FAZ面积变化与术后视力恢复的关系还需进一步研究考证。内界膜填塞及翻转覆盖均可以得到较高的裂孔闭合率,是治疗大直径特发性黄斑裂孔疗效稳定的术式,但是内界膜翻转覆盖术术后视力及裂孔闭合形态优于内界膜填塞术。本次试验随访时间短、样本量较小,可能造成试验结果的偏差,且未行视野等检查,不能全面评价患者视功能变化。对于大直径特发性黄斑裂孔手术治疗的研究还需要更大样本量的前瞻性研究,以完善个性化术式选择。
