多发性硬化患者IL-23R基因多态性和γδT及Treg细胞关联性分析①
2021-05-25林再红傅增辉于绘丽张广萍
林再红 傅增辉 金 艳 姜 岩 刘 晶 于绘丽 张广萍
(齐齐哈尔医学院附属第三医院神经内科,齐齐哈尔161002)
多发性硬化(multiple sclerosis,MS)是一种炎症性脱髓鞘性神经疾病(inflammatory demyelinating diseases,IDD)。白细胞介素23A(interleukin-23A,IL-23A)通过与其受体IL-23R相互作用调节和协调免疫细胞活性,并在免疫炎症疾病的致病机理中发挥关键作用。MS是一种自身免疫性疾病,该疾病的发生发展涉及IL-23和其受体。LI等[1]发现IL-23R基因中rs1884444位点与MS患者发病风险有关。有研究发现,IL-23R基因rs11209032、rs11209026、rs11465804位点与强直性脊柱炎和溃疡性结肠炎等自身免疫疾病的发病风险有关[2-3]。γδT细胞属于固有免疫细胞,可调控适应性免疫应答。已有研究报道,γδT细胞表达IL-23R,参与多种自身免疫性疾病的病理形成[4]。在实验性自身免疫性脑脊髓膜炎(experimental allergic encephalomyelitis,EAE)动物模型实验中,EAE模型动物脑脊液中的γδT细胞比例增加,而CD4+CD25+Foxp3+Treg比例降低,γδT细胞通过抑制CD4+CD25+Foxp3+Treg细胞发挥抑制免疫功能[5]。本研究对132例汉族非急性加重期MS患者的IL-23R基因进行分析,评估IL-23R基因内rs11209032、rs11209026、rs11465804位点,流式细胞术检测CD4+CD25+Foxp3+Treg和γδT细胞比例,ELI⁃SA检测MS患者血清IL-23水平,发现MS患者外周血IL-23水平和γδT细胞比例高于健康人群,但CD4+CD25+Foxp3+Treg细胞比例低于健康人群,同时MS患者IL-23R基因位点rs11209032 AA基因型及A等位基因检测率明显高于健康人群,可能是MS发病的危险遗传易感基因之一。
1 资料与方法
1.1 资料
1.1.1 研究对象 收集齐齐哈尔医学院附属第三医院神经内科门诊和病房2015年1月至2018年12月确诊的汉族MS患者作为研究对象。纳入要求:符合《多发性硬化诊断和治疗中国专家共识》诊断标准和McDonald诊断标准的非急性加重期MS患者[6-7]。需排除项目:①肝炎病毒感染;②滥用酒精;③合并其他免疫相关疾病,如系统性红斑狼疮、强直性脊柱炎、肿瘤等患者。本研究共入选132例MS患者,所有MS患者进行扩展残疾状况评分量表(ex⁃panded disability status scale,EDSS)评分。另选本院体检中心、实习学生等与病例组在性别、年龄相匹配的132例健康志愿者作为对照组。研究经齐齐哈尔医学院附属第三医院伦理委员会批准,均符合赫尔辛基宣言[8]要求,所有研究对象知情同意。
1.1.2 主要试剂与仪器 ELISA检测试剂盒、全血DNA基因组试剂盒、PE标记的γδ单抗、CD25单抗和APC标记的Foxp3单抗、FITC-标记的CD4单抗和CD3单抗、IgG1-FITC、IgG2-PE均购于BD公司。
1.2 方法
1.2.1 标本采集 所有研究对象空腹采肘静脉血,分别加入无抗凝剂干燥管和EDTA-K2抗凝管(5 ml/管),用于后续全血DNA提取、流式细胞术检测及ELISA检测。
1.2.2 流式细胞术检测 调节外周血单个核细胞(peripheral blood mononuclear cell,PBMC)浓度至1×106个/ml,Ficoll密度梯度离心法分离PBMC。加入荧光标记的鼠抗人单克隆抗体于PBMC:PE标记的γδ单抗、CD25单抗和APC标记的Foxp3单抗,FITC-标记的CD4单抗和CD3单抗。以IgG1-FITC和IgG2-PE为对照。胞内细胞因子的标记以Fixation/perme⁃abilization溶液进行破膜固定后,再用Permeabiliza⁃tion缓冲液洗涤,加入APC标记的Foxp3单抗行细胞内染色,流式细胞术测定CD4+CD25+Foxp3+Treg和γδT细胞比例,采用CellQuest V3.2软件分析。
1.2.3 IL-23检测 ELISA法检测IL-23水平,实验步骤严格按照说明书操作。
1.2.4 DNA提取 试剂盒提取全血DNA,严格按说明书操作。DNA提取后,电泳检测其完整程度,紫外分光光度仪检测其浓度及纯度,达标后用于后续检测。

表1 IL-23R基因引物序列Tab.1 Primer sequences of IL-23R gene
1.2.5 基因多态性检测 利用Primer Premier 5软件设计引物,具体见表1。采用PCR⁃RFLP及基因测序法检测PBMC细胞的IL-23R基因SNP类型。PCR反应体系的建立:总体积6.4µl,其中10µmol/L的上下游引物各0.2µl、PreMix TaqDNA聚合酶3µl、DNA模板1µl、去核酸酶水2µl。PCR反应条件;95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s,共循环36次,72℃延伸5 min。取2µlHsp92Ⅱ限制性内切酶加入5µl的PCR扩增产物,37℃下孵育6 h,将3%的琼脂糖凝胶加入酶切后的PCR产物,Goldview染色后于250 V下电泳,Bio-Rad凝胶成像仪检测结果,紫外灯下切胶,回收并检测PCR产物。
1.3 统计学处理 采用GraphPad Prism 5统计软件对所测数据进行统计学分析,计量资料采用±s表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,样本遗传平衡检验采用Hardy-Weinberg计算法,以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 对照组132例(男36例,女96例),平均年龄(39.17±12.01)岁;MS组132例(男35例,女97例),平均年龄(38.20±11.47)岁。对照组和MS组的年龄和性别分布如表2所示,年龄、性别相比差异均无统计学意义(均P>0.05)。
2.2 两组IL-23R基因rs11209032位点多态性分布 对照组和MS组PBMC细胞IL-23R基因位点rs11209026、rs11465804和rs11209032位点实际基因型分布与Hardy-Weinberg平衡状态下的理论分布差异均无统计学意义(χ2=1.290,P=0.223;χ2=1.941,P=0.303;χ2=2.130,P=0.401),符合Hardy-Weinberg遗传平衡定律,达到遗传平衡,具有群体代表性。所有研究对象均基因分型成功。对照组和MS组rs11209026和rs11465804位点的基因型均为纯合子,无法用于后续研究。这与HapMap数据库的报道一致,仅rs11209032位点用于病例对照研究。PCR扩增片段可被限制性内切酶切为2个小片段,其中出现1条带的称为AA型,2条带的称为GG型,3条带的称为A/G型。MS组与对照组基因型频率相比差异有统计学意义(P<0.05),见表3。
2.3 两组外周血中IL-23含量及CD4+CD25+Foxp3+Treg和γδT细胞比例比较 MS组血清中IL-23含量为(365.12±43.45)pg/ml,明显高于对照组的(150.14±30.23)pg/ml,差异有统计学意义(t=3.196,P=0.003);MS组CD4+CD25+Foxp3+Treg细胞比例为(3.93±0.55)%,明显均低于对照组的(7.42±1.03)%,差异有统计学意义(t=2.247,P=0.008);MS组γδT细胞比例为(5.15±0.65)%,明显均高于对照组的(3.12±0.45)%,差异有统计学意义(t=2.540,P=0.009)。
表2 两组一般资料的比较(±s)Tab.2 Comparison of general data between two groups(±s)

表2 两组一般资料的比较(±s)Tab.2 Comparison of general data between two groups(±s)
Index Control MS χ2/t P n 132 132 Age(years)39.17±12.01 38.20±11.47 1.014 0.339 Male 36(27.27%)35(26.52%)0.019 0.889 Female 96(72.73%)97(73.48%)EDSSscore-3.60±1.78- -Onset Age(years)-32.46±9.35- -
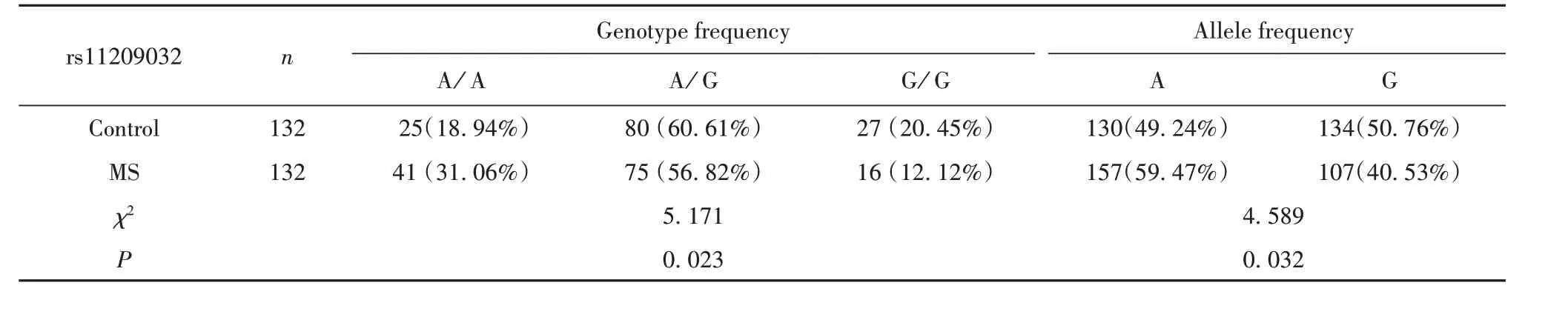
表3 两组IL-23R基因rs11209032多态性的分布Tab.3 Distribution of rs11209032 polymorphism of IL-23R gene in two groups
表4 MS组基因型外周血IL-23含量比较(±s)Tab.4 Comparison of IL-23 content in MSgroup genotype peripheral blood(±s)

表4 MS组基因型外周血IL-23含量比较(±s)Tab.4 Comparison of IL-23 content in MSgroup genotype peripheral blood(±s)
Note:Compared with A/A,1)P<0.05.
Item IL-23(pg/ml)CD4+CD25+Foxp3+Treg cell(%)γδTcell(%)A/A 535.01±71.31 2.51±0.30 6.50±0.57 A/G 382.19±40.131)3.80±0.411)5.21±0.541)G/G 262.30±63.221)4.93±0.521)4.01±0.611)t 2.501 1.038 1.934 P 0.009 0.003 0.005
2.4 MS组基因型外周血中IL-23含量及CD4+CD25+Foxp3+Treg和γδT细胞比例比较 如表4所示,MS组IL-23R基因位点rs11209032 AA基因型IL-23水平和γδT细胞比例显著高于其他基因型,差异有统计学意义(P<0.05);而MS组IL-23R基因位点rs11209032 AA基因型CD4+CD25+Foxp3+Treg细胞比例显著低于其他基因型,差异有统计学意义(P<0.05)。
3 讨论
目前为止,MS的病因尚不明确,可能与环境、免疫及遗传因素等有关。迄今,已发现众多与MS相关的SNP位点,IL-23R基因为其中之一[9]。IL-23R可诱导多种细胞因子和趋化因子的表达,从而加剧神经髓鞘的破坏[10]。IL-23由抗原提呈细胞产生,在炎症疾病中扮演关键角色,同时在固有或先天免疫之间有桥梁作用[11]。另外,在初始的CD4+T细胞转化为Th17细胞的过程中,IL-23也发挥关键作用,可增加Th17细胞的数量并维持其活性,导致致炎细胞因子IL-17产生,这种IL-23/Th17/IL-17轴在MS等自身免疫病中有关键作用[12]。IL-23R在CD4+T细胞分化成为Th17淋巴细胞亚群的过程中起重要作用,是细胞因子IL-23异二聚体受体的特异性构成。在IL-23R基因敲除的C57BL/6小鼠模型中,分泌IL-17的Th17淋巴细胞亚群能导致骨、神经及肠道等组织的破坏[13]。还有研究表明,IL-23R的变异使患者对多发性硬化等自免疫疾病的易感性增加,该基因是解释这些疾病易感的因素[14-15]。本研究中,所有健康志愿者和MS患者PBMC细胞IL-23R基因rs11209026和rs11465804位点的基因型均为纯合子,仅rs11209032位点的基因型频率在健康志愿者和MS患者PBMC细胞间差异显著。通过检测研究对象血清IL-23水平,发现MS患者IL-23水平高于对照组,与课题组的前期研究相符[16]。
MS是一种T细胞介导的自身免疫病,其中调节性T细胞的数量及功能异常在MS发病中起锁钥作用[17]。调节性T细胞主要包含数群具有免疫调节功能的T细胞,如CD4+CD25+Foxp3+Treg、Tr1、Th3及CD8+CD28-Treg等,在维持机体免疫及自身免疫耐受稳态中起纽带作用,按其来源又可分为胸腺自然生发的nTreg及与外周血通过转化生长因子β等诱导产生的iTreg[18]。T细胞按其表面抗原识别受体(Tcell receptor,TCR)所含肽链的区别,分为αβT和γδT细胞,后者能迅速识别TCR信号和模式识别信号,被认为是一种固有免疫细胞,是固有免疫与适应性免疫应答的纽带[19]。有研究发现,γδT细胞表面IL-23R与IL-23结合,进一步分泌IL-17等炎症因子,IL-17可进一步通过与Naive CD4+T细胞表面IL-17R结合,促进其向分泌IL-17的Th17细胞分化,而IL-21可抑制Naive CD4+T细胞向Treg细胞分化[20-21]。那么在MS中,IL-23是否通过与γδT细胞表面的IL-23R结合,进而活化γδT细胞并引起Th17/Treg免疫失衡?本研究发现,MS患者外周血CD4+CD25+Foxp3+Treg细胞比例较健康人降低,故CD4+CD2 5+Foxp3+Treg的异常与MS发病有关,这与MARINA等[22]的研究相似。T细胞中约有5%的γδT细胞,是一群表达T细胞抗原受体γδ链的T细胞亚群。在EAE小鼠模型中的研究中,表达IL-23受体的γδT细胞可通过IL-23依赖的机制抑制CD4+CD25+Foxp 3+Treg细胞功能,从而促进CD4+效应性T细胞增殖,促进EAE发病[23]。本研究中,MS患者外周血中γδT细胞比例较健康人显著升高,γδT细胞在促进MS的发病中具有重要作用。课题组前期的临床研究发现,IL-23与IL-17表达具有关联性,推测MS中可能存在IL-23-Th17/IL-17轴的优势活化,IL-23水平升高可诱导Th17的增殖分化并分泌IL-17,最终导致Th17/Treg免疫失衡,促进MS的发生发展[16]。
MS患者外周血IL-23水平和γδT细胞、IL-23R基因位点rs11209032多态性具有一定关联,IL-23R基因位点rs11209032可能是MS发病的危险遗传易感基因之一。IL-23R基因位点rs11209032基因多态性、外周血IL-23水平和γδT细胞三者协同可能有利于MS患者的早期诊断。本研究存在一定的局限性,存在样本量较少且单一的弊端,尚需对不同地区、不同人群因遗传背景和生活环境因素的不同的人群进行研究;本研究入选的MS均为非急性加重期,尚需进一步研究与急性加重期患者相关指标进行对比,进一步深入研究将有助于MS的发病机制的理解,并为MS的诊断、治疗和预后判断提供可能的标志物。
