miR-155表达变化对TGF-β1损伤足细胞蛋白podocin、CD2AP、synaptopo⁃din的影响①
2021-05-25凌霄雁郑心彤黄海庭古贤君杜秀日唐志明韦美理
凌霄雁 林 栩 郑心彤 黄海庭 古贤君 梁 钊 覃 卿 杜秀日 唐志明 王 晨 韦美理
(右江民族医学院附属医院,百色533000)
足细胞已成为治疗肾脏疾病的直接靶点,几乎肾小球疾病都涉及足突(foot procfesses,FPs)回缩消失、足细胞脱落或凋亡等足细胞损伤,最终引起蛋白尿、肾小球硬化[1]。而足细胞的正常结构和功能是由许多足细胞基因及其产物相互作用来维持的,例如裂孔隔膜相关蛋白nephrin、podocin、CD2AP和synaptopodin,它们在稳定肾小球滤过系统中共同发挥作用。相关研究发现足细胞基因的突变、缺乏会引起或加剧足细胞损伤,但是至今其中的分子病理生理机制尚未完全阐明[2-3]。
miRNA已被证明对足细胞的稳态至关重要,它是一种能靶向调节特定基因的非编码小RNA,足细胞中miRNA的两种必需酶Dicer或Drosha特异性损失则导致小鼠FPs消失、足细胞凋亡,出现明显的蛋白尿并迅速发展为肾衰竭[4]。TGF-β1作为常用于诱导肾细胞损伤的因子,前期课题组已在TGF-β1诱导的足细胞损伤模型中发现miR-155表达增加,其表达水平可能与CD2AP、synapto⁃podin具有相关性,然而miR-155是否参与TGF-β1诱导的足细胞损伤,其中关系如何未明确,本实验进一步深入研究miR-155与足细胞蛋白的调控关系,为miR-155在足细胞损伤中的作用提供理论和实验依据[5]。
1 材料与方法
1.1 材料 肾小球足细胞株(MPC5,上海复旦大学细胞中心);RPMI1640培养基(美国Gibco公司);胎牛血清(以色列BI-04-002-1A);胰蛋白酶(美国Gibco公司);miR-155-5p模拟物(miR-155 mimics)、miR-155-5p抑制剂(miR-155 inhibitor)、miR-155 NC阴性对照(广州RiboBio公司);脂质体2000转染试剂(美国Invitrogen公司);Opti-MEM无血清培养基(美国Gibco公司);重组人TGF-β1(美国PeproTech公司);RT-PCR试剂盒(日本TaKaRa公司);Mir-X miRNA FirstStrand Synthesis Kit(美国Clontech公司);PCR引物由生工生物工程(上海)股份有限公司设计并合成(引物序列见表1);Podocin、CD2AP、synaptopodin、GAPDH兔抗小鼠一抗和HRP标记的羊抗兔二抗(美国Proteintech公司);磷酸酶抑制剂混合物、蛋白酶抑制剂混合物(北京康为世纪公司);BCA蛋白定量试剂盒(中国碧云天公司);蛋白质提取试剂盒、ECL发光显影液(美国Millipore公司);4%多聚甲醛(上海Absin公司),Alexa Fluor 594荧光素标记兔抗IgG(美国CST公司);荧光定量PCR仪(瑞士Roche公司);凝胶成像系统(上海天能公司);免疫荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养 培养方法参考本课题组的前期研究[5]。在含10%胎牛血清的RPMI1640培养液,于37℃、5%CO2培养箱中培养,细胞长满至80%~90%时用胰蛋白酶消化传代,放入培养箱继续培养。用细胞免疫荧光染色鉴定足细胞是否分化成熟。
1.2.2 细胞转染与药物处理 以0.4×105~1×105个细胞种于6孔板中,待各组细胞融合至50%~70%后分别将Cy3 miR-155 NC、miR-155 mimics/mimics NC、miR-155 inihibitor/inhibitor NC及Lipo⁃fectamineTM2000加入Opti-MEM无血清培养基中混匀,静置5 min,然后相对应混合,轻轻吹打混匀,室温静置20 min后加入6孔板细胞中,在培养箱孵育4~6 h。①用免疫荧光倒置显微镜随机取3个高倍镜视野,观察Cy3 miR-155 NC红色荧光的细胞数占总细胞数的百分比(转染细胞率=荧光表达细胞数/总细胞数×100%),取其平均值作为转染效率。②6孔板细胞中加入TGF-β1干预,终浓度为12 ng/ml,继续培养进行后续实验。

表1 荧光定量PCR引物序列Tab.1 Primers of RT-PCR
1.2.3 细胞分组 ①检测正常组、TGF-β1组miR-155及蛋白CD2AP表达量;②分为miR-155 mimics+TGF-β1组、miR-155 mimics NC+TGF-β1组和miR-155 inhibitor+TGF-β1组、miR-155 inhibitor NC+TGF-β1组,在转染(0 h、24 h、48 h、72 h)收集细胞检测miR-155表达量;③分为正常组、TGF-β1组、TGF-β1+mimics组、TGF-β1+mimics NC组、TGF-β1+inhibitor组、TGF-β1+inhibitor NC组,给予TGF-β1干预48~72 h收集细胞进行检测。
1.2.4 RT-PCR检测足细胞miRNA-155、Podo⁃cin、CD2AP、Synaptopodin mRNA的表达 按1.2.3进行干预后,用TRIzol提取各实验组细胞的总RNA,用紫外分光光度计进行总RNA的浓度和纯度检测,按照TaKaRa试剂盒说明书进行反转录和qRT-PCR,以GAPDH作为内参,miRNA内参为U6,反应条件:变性95℃30 s,反应95℃5 s,延伸60℃30 s,共40个循环,以2-ΔΔCt法计算相对表达量。
1.2.5 Western blot检测足细胞Podocin、CD2AP、Synaptopodin蛋白的表达 各组细胞按1.2.3进行干预后用RIPA裂解液充分裂解细胞,提取各组细胞总蛋白,并用BCA法测定蛋白浓度。将蛋白质样品与蛋白质上样缓冲液混匀,100℃下反应3~5 min充分变性,冷却至室温,取30~50µg蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,300 mA恒流湿转至PVDF膜,封闭液室温封闭1 h,加一抗(Podocin 1∶400,CD2AP 1∶1 000,synaptopodin 1:1 000,GAPDH 1∶10 000),4℃孵育摇匀过夜。TBST洗膜3次,加入HRP标记的二抗(1∶5 000)室温孵育2 h。TBST洗膜3次,用化学发光液进行显影,凝胶成像系统采集图像,Image J软件分析蛋白条带灰度值。
1.2.6 细胞免疫荧光法 用PBS洗细胞3次,4%多聚甲醛室温下固定15 min,PBS洗3次,0.3%Tri⁃tonX-100室温破膜10 min,PBS洗3次,山羊血清室温封闭1 h,加入一抗(CD2AP,1∶100),4℃摇床过夜,PBS洗3次,加入荧光二抗(1∶500)室温避光孵育1 h,滴加DAPI复染5 min后防荧光淬灭剂封片,免疫荧光显微镜下观察、摄片,Image Pro Plus图像分析软件分析荧光强度。
1.3 统计学方法 采用SPSS20.0软件进行统计分析,符合正态性分布的资料以±s表示,两组间比较采用t检验;多组间比较用单因素方差分析(Oneway ANOVA),两两比较用LSD-t检验;转染后miR-155表达随时间变化的比较采用两因素重复测量方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 足细胞分化鉴定 应用细胞免疫荧光染色检测足细胞特异性蛋白CD2AP,荧光显微镜观察显示染色明显,CD2AP分布于胞浆、细胞周边、次级突起(图1),此为分化足细胞CD2AP的分布的特征。用于实验的细胞均为分化成熟的足细胞。
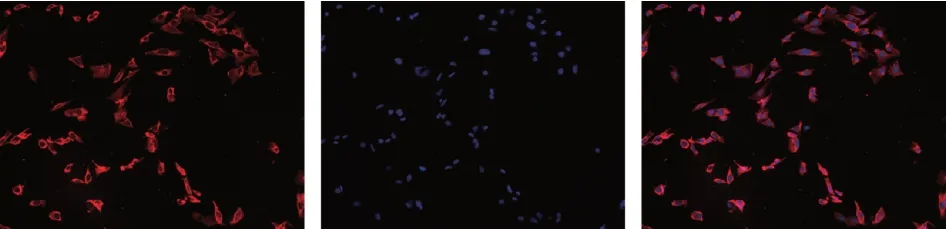
图1 CD2AP在足细胞中的表达和分布(×200)Fig.1 Expression and distribution of CD2AP in podocytes(×200)
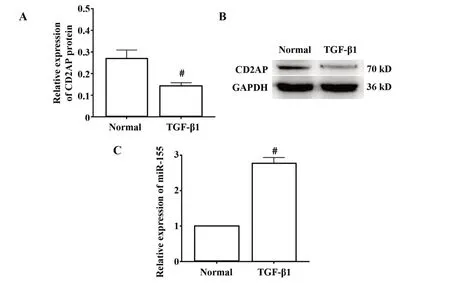
图2 miR-155和CD2AP在TGF-β1诱导的足细胞中的表达Fig.2 Expressions of miR-155 and CD2APin podocyte in⁃duced by TGF-β1
2.2 TGF-β1诱导足细胞miR-155和蛋白CD2AP表达改变 用TGF-β1处理足细胞72 h后提取细胞,与正常组相比,TGF-β1处理可使足细胞中miR-155的表达显著升高,CD2AP的蛋白表达水平显著降低(P<0.05,图2)。这与本课题组前期实验TGF-β1诱导足细胞损伤结果一致[5]。
2.3 miR-155转染足细胞后不同时间的miR-155表达变化 转染成功指示剂Cy3 miR-155 NC转染入足细胞,24 h后用倒置荧光显微镜观察转染荧光情况,红色荧光明显分布于细胞内,转染效率为90%左右(图3A)。转染miR-155 mimics或miR-155 in⁃hibitor 0 h、24 h、48 h、72 h,用RT-PCR检测miR-155的表达。重复测量方差分析结果显示:对照组NC+TGF-β1的0 h和24 h miR-155表达水平无明显差异(P>0.05);mimics+TGF-β1组24 h和0 h相比,miR-155表达水平增加(P<0.05);inhibitor+TGF-β1组24 h和0 h相比,miR-155表达水平差异无统计学意义(P>0.05)。转染24 h、48 h、72 h:①不同的时间点miR-155表达差异有统计学意义(P<0.05);②不同组间miR-155表达差异有统计学意义(P<0.05);③不同转染组和观察时间之间存在交互作用(P<0.05)。miR-155 mimics+TGF-β1组在转染48 h、72 h后miR-155表达水平上升(P<0.05),NC+TGF-β 1组转染48 h、72 h后miR-155水平稍上调(P<0.05),但mimics+TGF-β1组与mimics NC+TGF-β1组比,miR-155表达水平增加(P<0.05),而miR-155 inhibitor+TGF-β1组在转染miR-155 inhibitor 48、72 h后miR-155表达水平下降(P<0.05),inhibitor NC+TGF-β1组miR-155的表达水平上调(P<0.05),inhibitor+TGF-β1组与inhibitor NC+TGF-β1组比,miR-155表达水平降低(P<0.05),miR-155 inhibitor可能抑制了TGF-β1诱导的足细胞miR-155水平的表达(图3)。以上说明miR-155可能参与了TGF-β1对足细胞的作用。
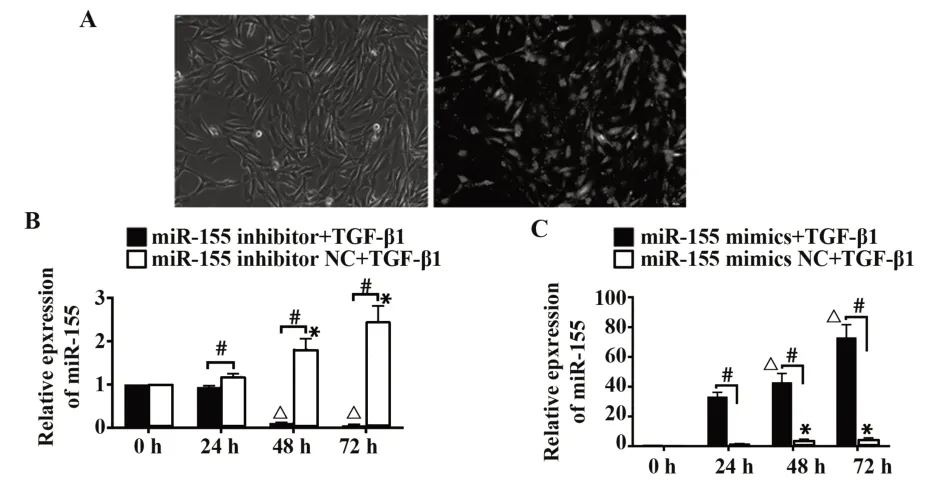
图3 miR-155在足细胞中的转染效果Fig.3 Transfection effects of miR-155 in podocytes
2.4 转染miR-155 mimics和miR-155 inhibitor后TGF-β1诱导的足细胞miR-155表达水平的变化 各组与正常组比,miR-155的表达量差异均有统计学意义(P<0.05),与TGF-β1组相比,miR-155 mimics的转染显著上调miR-155的表达量(P<0.05),而转染miR-155 inhibitor后miR-155表达下调,差异均有统计学意义(P<0.05),TGF-β1+mimics NC、TGF-β 1+inhibitor NC组与TGF-β1处理组相比miR-155的表达水平无明显变化(表2)。结果进一步表明,miR-155 mimics可上调TGF-β1诱导的足细胞miR-155表达,miR-155 inhibitor则抑制TGF-β1诱导的足细胞miR-155表达。
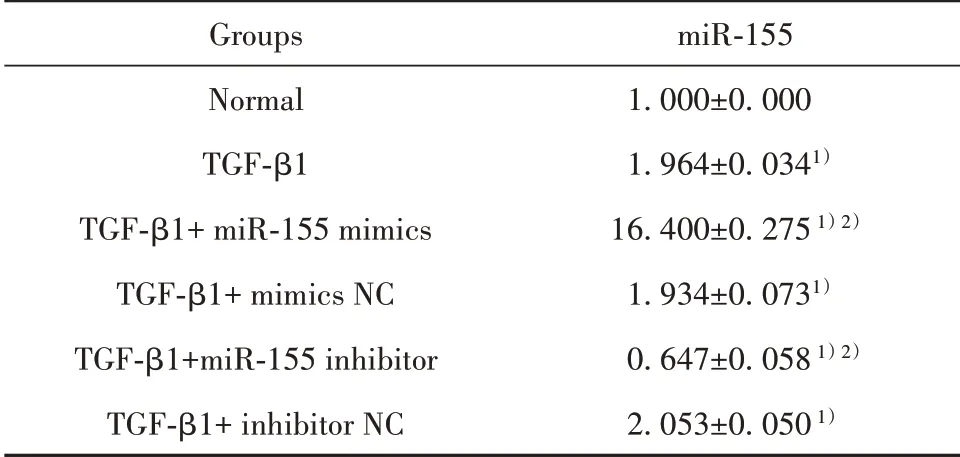
表2 miR-155 mimics/miR-155 inhibitor转染后miR-155表达水平的变化(xˉ±s,n=3)Tab.2 Changes in miR-155 expression level after miR-155 mimics/miR-155 inhibitor transfection(xˉ±s,n=3)
表3 miR-155表达水平对TGF-β1诱导足细胞损伤中podocin/CD2AP/synaptopodin mRNA表达的影响(±s)Tab.3 Effects of miR-155 expression level on expression of podocin/CD2AP/synaptopodin mRNA in TGF-β1 induced podocyte injury(±s)
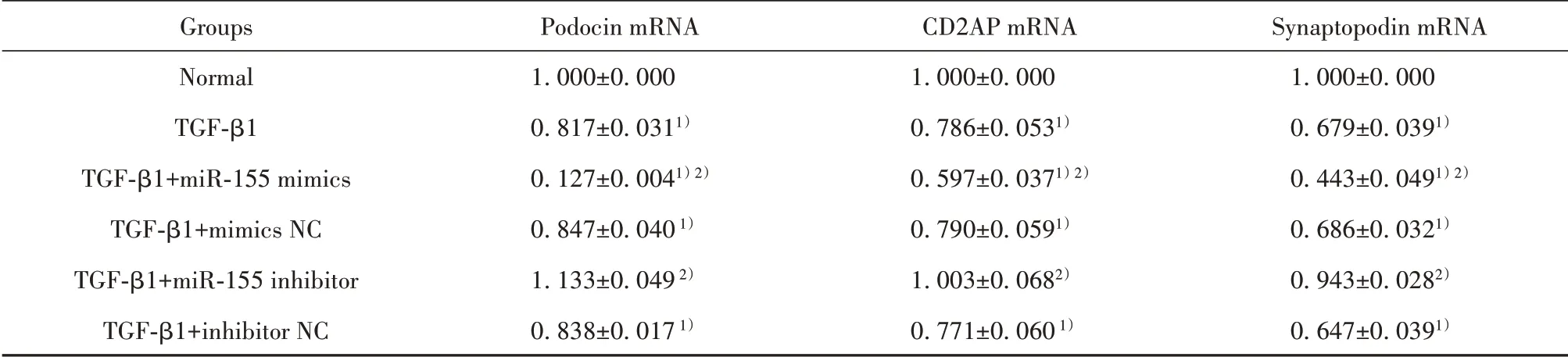
表3 miR-155表达水平对TGF-β1诱导足细胞损伤中podocin/CD2AP/synaptopodin mRNA表达的影响(±s)Tab.3 Effects of miR-155 expression level on expression of podocin/CD2AP/synaptopodin mRNA in TGF-β1 induced podocyte injury(±s)
Note:Compared with normal group,1)P<0.05;compared with TGF-β1 group,2)P<0.05.
Groups Normal TGF-β1 TGF-β1+miR-155 mimics TGF-β1+mimics NC TGF-β1+miR-155 inhibitor TGF-β1+inhibitor NC Podocin mRNA 1.000±0.000 0.817±0.0311)0.127±0.0041)2)0.847±0.040 1)1.133±0.049 2)0.838±0.017 1)CD2APmRNA 1.000±0.000 0.786±0.0531)0.597±0.0371)2)0.790±0.0591)1.003±0.0682)0.771±0.060 1)Synaptopodin mRNA 1.000±0.000 0.679±0.0391)0.443±0.0491)2)0.686±0.0321)0.943±0.0282)0.647±0.0391)
2.5 miR-155转染后对TGF-β1损伤足细胞podo⁃cin、synaptopodin、CD2APmRNA表达的影响 与正常对照组相比,TGF-β1组足细胞中podocin、CD2AP、synaptopodin mRNA的表达下调,差异有统计学意义(P<0.05),与TGF-β1组相比,TGF-β1+miR-155mimics组中podocin、CD2AP、synaptopodin mRNA的表达明显下调,差异有统计学意义(P<0.01),而TGF-β1+miR-155 inhibitor组中podocin、CD2AP、syn⁃aptopodin mRNA的表达升高,差异有统计学意义(P<0.05),TGF-β1+miR-mimics NC、TGF-β1+miR-155inhibitor NC组与TGF-β1处理组相比无统计学意义(表3)。结果表明,miR-155 mimics可促进TGF-β1诱导的足细胞podocin、CD2AP、synaptopodin表达下降,miR-155 inhibitor可逆转TGF-β1对足细胞蛋白的损伤作用。
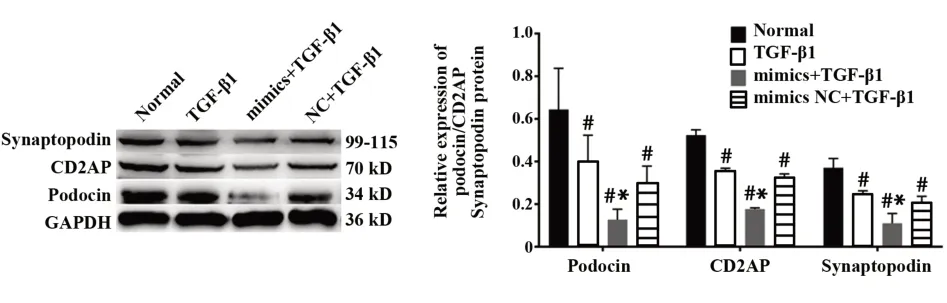
图4 miR-155高表达对podocin、CD2AP、synaptopodin蛋白表达的影响Fig.4 Effects of miR-155 overexpression on expressions of podocin,CD2APand synaptopodin protein
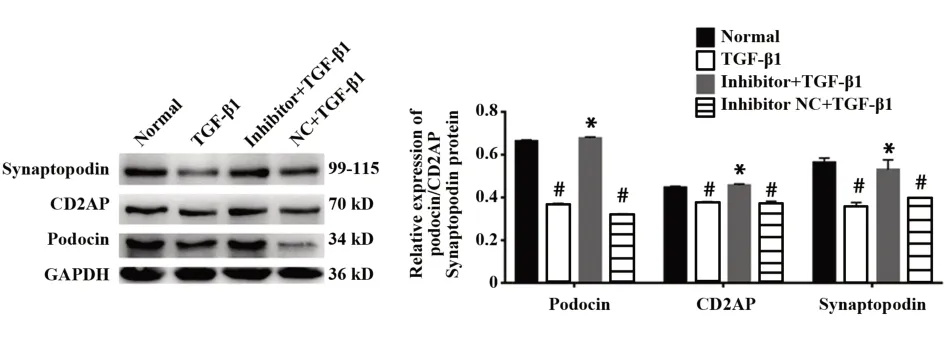
图5 miR-155低表达对podocin、CD2AP、synaptopodin蛋白表达的影响Fig.5 Effects of miR-155 low expression on expressions of podocin,CD2APand synaptopodin proteins
2.6 miR-155转染后对TGF-β1损伤足细胞podo⁃cin、CD2AP、synaptopodin蛋白表达的影响 West⁃ern blot结果显示,miR-155 mimics或miR-155 inhibi⁃tor转染足细胞后,各组细胞之间podocin、CD2AP、synaptopodin蛋白水平的差异具有统计学意义(P<0.05),miR-155 mimics高表达可促进podocin、syn⁃aptopodin、CD2AP蛋白表达下降,差异有统计学意义(P<0.05,图4),而miR-155 inhibitor则下调足细胞miR-155水平,进而抑制3种蛋白的水平降低(P<0.05,图5),TGF-β1+miR-155 mimics NC、TGF-β1+miR-155inhibitor NC组与TGF-β1组相比无统计学差异。结果进一步表明,miR-155的表达变化可影响TGF-β1诱导 的 足 细 胞podocin、synaptopodin、CD2AP蛋白损伤。
2.7 miR-155转染后免疫荧光染色观察蛋白CD2AP表达与分布 CD2AP蛋白的表达与Western blot、RT-PCR结果一致。分化成熟的正常足细胞,CD2AP蛋白主要分布胞浆、周边、次级突起(例如白色实心箭头);TGF-β1处理的细胞,CD2AP蛋白荧光减弱,部分向核周分布(例如空心粗箭头);miR-155 mimics转染足细胞后CD2AP蛋白荧光比TGF-β1组较弱,且主要向核周分布(例如空心粗箭头);miR-155 inhibitor抑制TGF-β1引起的CD2AP蛋白改变。见图6。
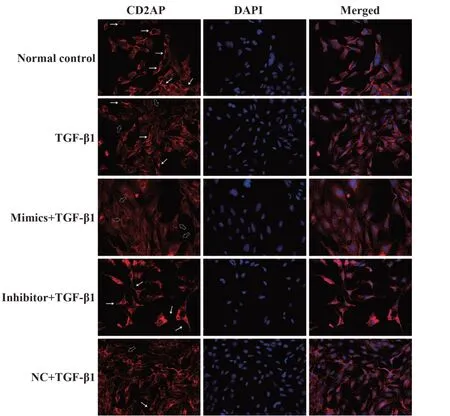
图6 各组细胞CD2AP蛋白的分布与表达(×400)Fig.6 Expression of CD2AP protein in each group(×400)
3 讨论
随着蛋白质组学、生物信息学、分子生物学技术的发展,越来越多的足细胞超微结构、基因和功能被鉴定,足细胞与足细胞之间相互交叉作用,又通过足突附着于肾小球基底膜(glomerular base⁃ment membrane,GBM)[6]。由足细胞顶膜、裂孔隔膜(slit diaphragm,SD)、FPs、GBM组成了具有滤过功能的沙漏结构,其中的基因蛋白发生变化可引起足细胞结构功能改变,最终导致肾小球滤过功能下降和肾脏疾病,因此被认为是足细胞损伤的标志蛋白[7-8]。SD蛋白CD2AP缺乏的小鼠中活性氧增多,进而促使足细胞凋亡,抑制SHIP2使活性氧下降也不能阻止CD2AP缺乏引起的足细胞凋亡,而CD2AP过表达可减少足细胞凋亡[2]。其他的SD蛋白nephrin、podocin,突触蛋白synaptopodin的突变和缺少都会引起足细胞的损伤,这与课题组实验结果相一致,在TGF-β1干预的足细胞中,CD2AP与podocin、synaptopodin表达均降低[9]。研究还发现,与免疫炎症密切相关的miR-155对足细胞蛋白CD2AP、podocin、synaptopodin具有靶向作用,miR-155高表达可负性调节podocin、synapto⁃podin、CD2AP的表达,miR-155低表达可使podo⁃cin、synaptopodin、CD2AP表达上调。
越来越多证据表明,miRNA在肾脏发育和肾脏生理稳态中起着重要的作用,很多肾脏疾病存在miRNA的失调[4]。近年来,miR-155在肾脏疾病中的作用不断被发现,糖尿病肾病患者血液、尿液中miR-155的表达发生改变,miR-155还可能参与调节肥胖相关肾病肾脏组织和内皮细胞、狼疮肾炎系膜细胞的损伤[10-13]。但是,目前miR-155对足细胞损伤的调控尚不清楚。有文献表明肾上皮细胞、内皮细胞、基底膜、外基质和系膜细胞之间存在串扰,miRNA旁分泌和自分泌介导肾小球细胞,例如miR-143可能是足细胞和肾小球内皮细胞损伤串扰的介质,miR-378a-3p可抑制基底膜中细胞外基质蛋白nephronectin(NPNT)的表达水平,引起足细胞podocin表达下降[14-16]。因此,miR-155是否参与调节足细胞的损伤,且串扰其他肾细胞的损伤,对肾脏疾病而言具有一定研究价值。
miRNA是基因表达的中心协调器,可同时调节多个功能相关的靶基因,有的研究认为miRNA主要是在翻译水平调节靶蛋白,对mRNA的影响可能不大。成功转染miR-155 mimics或miR-155 inhibitor后,在不同时间点观察了TGF-β1损伤足细胞模型中miR-155表达水平的变化及相应足细胞蛋白的表达,miR-155的表达在48、72 h后明显上调或下调,随后,在转染48 h~72 h提取细胞,分别用RT-PCR和Western blot检测CD2AP、podocin、synaptopodin的mRNA和蛋白表达变化,结果发现,miR-155 mimics可使TGF-β1诱导的足细胞miR-155表达增加,同时促进足细胞CD2AP、podo⁃cin、synaptopodin mRNA的下调,3种蛋白的蛋白表达量也一致下降,而miR-155 inhibitor可以与TGFβ1诱导足细胞增加的miR-155竞争结合,下调TGF-β1引起的miR-155表达,从而抑制miR-155对足细胞的作用,CD2AP、podocin、synaptopodin的mRNA和蛋白表达均上调,这说明miR-155可能同时靶向了足细胞的3种蛋白,从而参与调节TGF-β1诱导的足细胞损伤。有研究表明,CD2AP、podocin和nephrin可通过磷酸肌醇3-OH激酶连接,被认为是SD复合物[17]。CD2AP作为衔接蛋白通过其羧基端与骨架蛋白结合,将nephrin、podocin、syn⁃aptopodin与细胞骨架肌动蛋白连接起来,从而在功能上相互作用,影响CD2AP在足细胞中的定位和表达则破坏SD的稳定性和细胞骨架[18-19]。用免疫荧光观察CD2AP蛋白的表达与Western blot和PCR结果一致,其分布也发生了相应改变,再次证明了miR-155对足细胞蛋白的作用。
综上所述,miR-155的表达变化影响TGF-β1诱导的足细胞损伤,在蛋白和mRNA层面都是有作用的,转染inhibitor可抑制miR-155对CD2AP、podocin和synaptopodin的靶向作用,改善足细胞的损伤。因此,miR-155有很大的潜力成为足细胞损伤新的药物靶标,本课题组也提出假设,miR-155可以靶向足细胞、系膜细胞、内皮细胞、基底膜等肾细胞之间的串扰,缓解肾脏疾病,但具体的信号通路机制需要进一步深入研究。
