川陈皮素经AKT/GSK 3β/NF-κB通路抑制Kupffer细胞活化减轻大鼠原位肝移植后缺血再灌注损伤①
2021-05-25王敬元李生伟吴涯昆重庆医科大学附属第二医院肝胆外科重庆400010
王敬元 李生伟 吴涯昆(重庆医科大学附属第二医院肝胆外科,重庆400010)
肝移植可作为各种晚期肝病的治疗方法,但肝移植诱导的肝脏缺血再灌注损伤(ischemia-reperfu⁃sion injury,IRI)可影响移植肝的功能,并加重免疫排斥反应[1]。既往研究表明,IRI由活性氧释放、巨噬细胞活化、黏附分子以及细胞凋亡等多种因素共同参与[2-4]。库普弗细胞(kuppffer cells,KCs)是肝脏中的常驻巨噬细胞,参与肝脏多种免疫反应,可通过改变自身活化状态,从而调节肝脏炎症水平,其中M1型KCs可诱导促炎因子的分泌,促进肝脏的炎症水平,加重IRI程度,因此,通过抑制KCs的M1型极化和后续的炎症级联反应可以有效减轻IRI程度[5-7]。
川陈皮素是一种主要存在于柑桔果皮中的聚甲氧基黄酮,具有抗肿瘤、抗炎、抗氧化及抗糖尿病等调节免疫功能的生物学特性[8-10]。川陈皮素还可通过抑制活性氧的产生来减轻脑和心肌IRI,但其在肝脏IRI中的作用研究还尚有欠缺[11-12]。因此,我们使用川陈皮素预处理大鼠,以研究该药在大鼠肝移植后肝脏IRI模型中的作用及其机制,为肝移植后肝脏IRI的药物治疗奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性Sprague-Dawley(SD)大鼠(6~8周龄,200~250 g)购自重庆医科大学实验动物中心,SPF级喂养,自由饮食,光照/黑暗每12 h进行交替。所有实验操作均遵守重庆医科大学伦理委员会发布的伦理及管理指南。
1.1.2 试剂及仪器 川陈皮素购自西安小草植物科技有限公司;COX2、AKT、p-AKT均购自美国Cell Signaling Technology公司;MCP-1、iNOS、GSK3β、p-GSK3β、NF-κB P65、p-P65、Cleaved-caspase3、Cas⁃pase3、Bcl-2、Bax均购自美国Abcam公司;ELISA试剂盒购自北京四正柏生物科技有限公司;PCR试剂盒购自TaKaRa;TUNEL试剂盒购自博士德公司;HE染色试剂盒购自碧云天公司;氯膦酸二钠脂质体(clodronate liposomes,CL)购自美国Encapsula Nano⁃Sciences;Cell Counting Kit-8(CCK-8)试剂盒购自MCE公司;全自动生化仪购自美国Beckman公司。
1.2 方法
1.2.1 肝移植模型构建 肝移植供体及受体均为SD大鼠,根据Kamada肝移植操作方法[13]稍做改动,麻醉方法采用戊巴比妥钠进行腹腔注射(60 mg/kg)。川陈皮素处理组中,采用DMSO充分溶解川陈皮素后,使用生理盐水稀释至6 mg/ml,供体大鼠每天经尾静脉注射川陈皮素(50 mg/kg)一次,持续1周[14]。LT+CL+川陈皮素组中,术前48 h对供受体尾静脉注射CL(4µl/g)阻断KCs功能,其余处理同前[15]。移植肝冷缺血时间为60 min,再灌注3 h、6 h、12 h、24 h后获取血清及组织标本进行ELISA、自动生化仪检测、Western blot、HE等实验分析。
1.2.2 提取KCs 根据LI等[16]所提到的方法,经门静脉灌注含0.05%Ⅳ型胶原酶的PBS至肝脏变黄变软。使用差速离心法将非实质细胞和实质细胞分开,采用Percoll溶液将KCs从非实质细胞中分离出来,将提取的KCs置于37℃,5%CO2,湿度为95%的培养箱中,10%胎牛血清和1%双抗的DMEM中培养。采用CD68进行细胞免疫荧光染色,其中CD68阳性者为KCs。细胞实验中,川陈皮素组使用不同浓度(0、5、10、20、40µmol/L)川陈皮素处理24 h,再使用LPS(Sigma;100 ng/ml)处理3 h,收集各组细胞及上清液进行实验分析。
1.2.3 Western blot 根据蛋白提取试剂盒说明将PMSF与RIPA按1:100的比例配制,使PMSF终浓度为1 mmol/L,将其加入各组细胞或肝组织中进行裂解并提取总蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度,根据蛋白分子量不同,将蛋白加入10%或12%的聚丙烯酰胺凝胶中进行电泳,并转印于PVDF膜(Millipore)上,采用5%脱脂奶粉封闭1 h,将PVDF膜与一抗4℃孵育过夜,将膜洗涤后与辣根过氧化物酶结合的IgG抗体于37℃孵育1 h,滴加ECL发光液,采用凝胶成像系统(Bio-Rad)进行检测,采用ImageJ软件对结果进行分析。
1.2.4 ELISA 使用ELISA试剂盒检测KCs上清液以及血清中的炎症细胞因子IL-1β、TNF-α、IL-6、IL-10,并按提供的公式计算各因子浓度。将对应一抗按100µl/孔加入白板置于37℃下孵育4 h,弃去板中液体,加入封闭液于37℃封闭1 h,弃去封闭液,洗涤液洗涤5 min×3遍,拍干孔中残余液体,按100µl/孔加入血清或细胞上清液,37℃下孵育1 h,洗涤5 min×3遍,加入酶标抗体于37℃下孵育1 h,洗涤5 min×3遍,加入底物,37℃下避光反应5 min,加入终止液终止反应,酶标仪进行检测。
1.2.5 TUNEL细胞凋亡染色 TUNEL染色依据说明书(博士德)进行操作,取出石蜡切片脱蜡并按无水乙醇,95%乙醇,85%乙醇,75%乙醇,水的顺序进行水化,配制Proteinase K,滴于样片室温消化15 min,TBS洗涤2 min×3次,加标记缓冲液保持样片湿润,用1µl TdT+1µl DIG-d-UTP+18µl标记缓冲液室温标记2 h,再次洗涤后用山羊血清室温封闭30 min,与生物素化抗地高辛抗体室温孵育30 min,洗涤后与SABC-FITC孵育30 min,使用DAPI进行细胞核染色10 min,滴加封片剂后采用荧光显微镜(Olympus)观察采图。
1.2.6 HE染色 将肝组织浸入10%多聚甲醛中固定,制成石蜡包块后切片,根据碧云天HE染色试剂盒说明进行操作,进行苏木精和伊红染色,于光学显微镜下观察采图,使用SUZUKI法[17]对各组进行评分。
1.2.7 肝功测定 血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)采用全自动生化仪(Beckman CX7)进行检测。
1.3 统计学分析 实验结果以±s表示,组间比较采用单因素方差分析,所有数据采用GraphPad Prism 7软件进行统计,当P<0.05时差异有统计学意义。
2 结果
2.1 川陈皮素抑制LPS活化的KCs中炎症因子的表达 根据LI等[16]的方法提取正常SD大鼠KCs,培养至细胞状态稳定后,使用CCK-8法检测不同浓度(5、10、20、40µmol/L)川陈皮素对KCs活力的影响,结果显示40µmol/L组有明显降低(P<0.05),而其余3组无明显差异(图1A),表明40µmol/L浓度的川陈皮素抑制KCs的活力,因此选择5、10、20µmol/L进行后续实验。研究表明,KCs的活化及炎症因子的释放在肝脏IRI中起着重要作用,因此,检测了LPS活化的KCs中炎症因子IL-1β、TNF-α和IL-6的蛋白水平,结果显示,LPS(100 ng/ml)处理后,与未用LPS处理组相比,其IL-1β、TNF-α和IL-6的蛋白表达水平都明显升高,而川陈皮素处理能够抑制其炎症因子的表达,并具有一定的剂量依赖性(P<0.05,图1B、C)。ELISA检测了各组细胞上清中炎症因子的水平,结果表明川陈皮素能够抑制促炎因子IL-1β、TNF-α和IL-6的水平,促进抑炎因子IL-10的分泌(P<0.05,图1D)。以上结果表明川陈皮素能够抑制KCs中炎症因子的分泌。
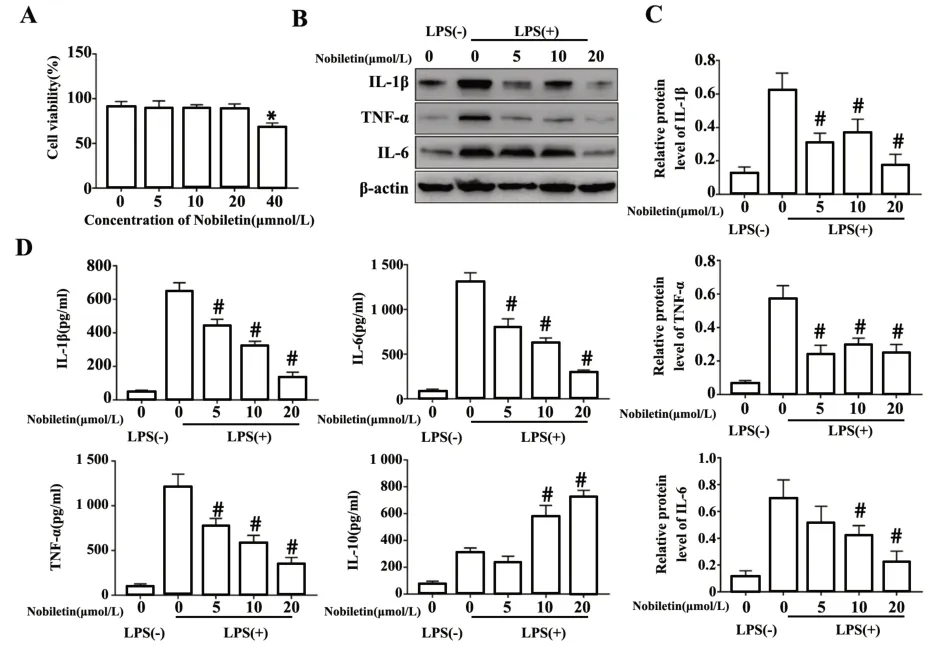
图1 川陈皮素对KCs炎症因子的影响Fig.1 Effectsof nobiletin on inflammatory cytokinesin KCs
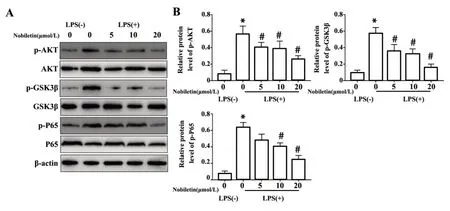
图2各浓度川陈皮素对KCs中AKT/GSK 3β/NF-κB信号通路的影响Fig.2 Effects of nobiletin at different concentrations on AKT/GSK3β/NF-κB pathway in KCs
2.2 川陈皮素通过AKT/GSK3β/NF-κB信号通路抑制KCs活化 AKT/GSK3β/NF-κB信号通路参与巨噬细胞的活化以及多种炎症性疾病的发生发展[18]。NF-κB的过度激活及其下游炎症级联反应在肝脏IR损伤过程中发挥重要作用[19]。为验证川陈皮素影响KCs的活化及功能的机制,采用Western blot检测了AKT、p-AKT、GSK3β、p-GSK3β、NF-κBP65和p-P65的水平,结果显示,AKT/GSK3β/NF-κB通路的磷酸化水平在LPS处理组明显高于对照组,而川陈皮素能够有效降低p-GSK3β和p-P65的表达水平,这与p-AKT的表达一致(P<0.05,图2A、B)。以上结果表明川陈皮素可能通过抑制AKT/GSK3β/NF-κB通路来抑制KCs的活化及功能。
2.3 川陈皮素预处理减轻肝移植后IRI 我们通过检测血清转氨酶水平及观察HE染色结果评估川陈皮素预处理对大鼠肝移植后肝脏IRI程度的影响。结果显示术后各时间点血清ALT、AST水平均高于假手术组,提示肝移植术后肝脏明显受损,然而,各时间点LT+川陈皮素组血清ALT、AST的水平较LT组都明显降低,这提示川陈皮素可有效减轻肝移植术后肝脏IRI(P<0.05,图3A)。肝组织(再灌注24 h)HE染色结果进一步证实川陈皮素对IRI肝脏的保护作用,HE染色结果显示假手术组的肝小叶形态基本正常,无明显炎症细胞浸润,LT组可见肝小叶周边细胞肿胀明显,胞浆空泡化,并有大量淋巴细胞或中性粒细胞浸润,与之相比,LT+川陈皮素组肿胀细胞明显减少,且胞质空泡化和炎症细胞浸润程度也明显减轻(P<0.05,图3B)。
2.4 川陈皮素预处理减轻IRI肝脏的凋亡水平肝移植后,IRI可诱导肝实质细胞凋亡,我们使用TUNEL实验来检测川陈皮素对肝移植肝脏IRI诱导的细胞凋亡的影响,结果表明LT组的肝组织显示TUNEL阳性细胞数量高于假手术组,此外,LT+川陈皮素组TUNEL阳性细胞数明显低于LT组(P<0.05),在使用CL阻断肝脏KCs后,移植肝中TU⁃NEL阳性细胞数较川陈皮素处理组明显增加(P<0.05),而与LT组无显著差别(图4A)。以上结果提示川陈皮素可有效抑制肝移植后肝脏中的凋亡水平,并且在一定程度上依赖KCs发挥作用。我们从蛋白水平也证实川陈皮素能够有效降低缺血再灌注肝脏的凋亡蛋白Cleaved-caspase3和Bax的水平,并抑制抗凋亡蛋白BCL-2的表达(P<0.05,图4B)。以上结果表明,川陈皮素能够通过抑制肝脏细胞凋亡有效减轻肝移植后肝脏IRI引起的肝损伤。

图3 体内实验中川陈皮素对缺血再灌注肝脏的影响Fig.3 Effects of nobiletin on ischemia-reperfusion liver in vivo
2.5 川陈皮素抑制KCs的M1型极化并减轻肝移植后肝脏IRI引起的肝脏炎症反应 KCs是肝脏中的常驻巨噬细胞,在调节机体免疫平衡中起重要作用。其中M1型KCs在促进肝脏炎症发生中起重要作用,我们用流式细胞术检测了M1型极化(CD68和CD86双阳性)KCs的比例,结果显示,川陈皮素明显抑制CD68+CD86+KCs的比例(P<0.05,图5A)。表明川陈皮素能够明显抑制肝移植后肝脏中KCs的M1型极化。采用ELISA法进一步检测血清中TNF-α、IL-1β和IL-6的水平,结果显示与LT组相比,LT+川陈皮素组中炎症因子显著降低(P<0.05),这表明川陈皮素可抑制肝移植后肝脏IRI引起的炎症反应(图5B)。为了进一步验证其机制,我们还检测了各组KCs中AKT/GSK3β/NF-κB信号通路的活性,结果提示与LT组相比,LT+川陈皮素组p-AKT、p-GSK3β、p-P65的蛋白水平明显降低(P<0.05,图5C)。以上结果进一步证实AKT/GSK3β/NF-κB信号通路可能参与川陈皮素对肝移植后肝脏IRI的调节作用。
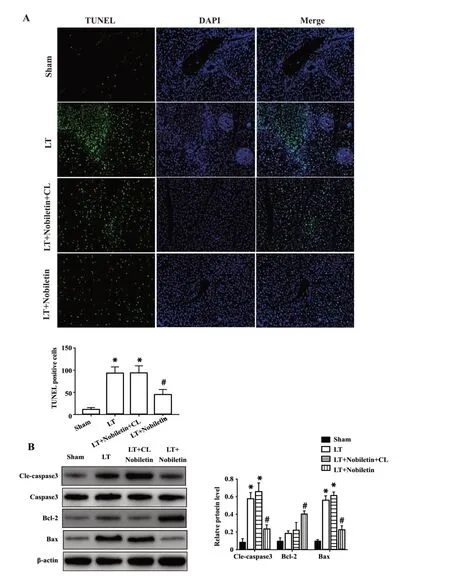
图4 川陈皮素对缺血再灌注肝脏凋亡水平的影响Fig.4 Effects of nobiletin on the cell apoptosis in liver af⁃ter ischemia-reperfusion

图5 川陈皮素对缺血再灌注肝脏KCs活化及炎症水平的影响Fig.5 Effects of nobiletin on KCs activation and inflam⁃mation in ischemia-reperfusion liver
3 结论
肝脏肿瘤切除、低血容量性休克和肝移植过程都可引起肝脏IRI,尤其是在肝移植手术中,IR可引起肝功受损,进而加重肝移植后急慢性排斥反应的发生[20]。由于IRI缺少有效的治疗方法,因此对相关药物的研究很有必要。以往研究表明,肝脏IRI由多种因素引起,包括巨噬细胞和树突状细胞的激活、氧化应激以及先天性和适应性免疫反应中产生的促炎因子[21-22],其中巨噬细胞的活化及其下游炎症反应在IRI过程中起着至关重要的作用[23],因此,调节巨噬细胞活化程度及其下游炎症通路有助于减轻肝脏IRI。
川陈皮素作为柑橘类水果的主要成分,在抗糖尿病、抗癌、抗氧化应激及炎症疾病中都有研究[8-10]。川陈皮素能够有效减轻脑及肾脏IRI,但在肝脏IRI中的作用研究尚有欠缺[11-12]。KCs是肝脏巨噬细胞的主要部分,具有吞噬、抗原呈递及释放炎症因子等免疫调节功能,在肝脏IRI中发挥重要作用[24-25]。肝移植后可引起KCs活化,进而启动黏附分子的表达并促进T淋巴细胞的激活,此外,KCs还可释放活性氧及炎症介质进一步加重肝损伤[26-27]。考虑到川陈皮素对其他缺血器官的保护作用,结合川陈皮素的抗炎特性,对川陈皮素在调节肝脏KCs活化、炎症水平以及对大鼠肝移植诱导的冷缺血再灌注损伤方面进行了研究。
本研究在体外使用LPS处理活化KCs,Western blot检测到炎症相关因子如IL-1β、TNF-α、IL-6的蛋白表达增加,ELISA检测到细胞上清液中促炎因子IL-1β、TNF-α、IL-6的水平升高。然而,在川陈皮素处理组中,促炎因子的水平明显降低,这表明川陈皮素抑制了KCs的活化和分泌促炎因子的功能。同时我们检测到AKT/GSK3β/NF-κB信号通路参与巨噬细胞的活化以及IRI过程,川陈皮素可抑制AKT/GSK3β/NF-κB信号通路中p-AKT、p-GSK3β、p-P65的表达,表明川陈皮素可能经该通路发挥对缺血再灌注肝脏的保护作用,但川陈皮素还可能通过其他途径如JAK/STAT通路发挥作用,这有待进一步研究来证实。本研究在体内实验检测血清转氨酶ALT、AST的水平,表明川陈皮素预处理可以缓解IR诱导的肝功能损伤程度,且HE染色结果证明其能够有效减轻IRI,同时川陈皮素能够降低血清IL-1β、TNF-α、IL-6的水平,证明其具有明显的抗炎作用。TUNEL实验进一步证实川陈皮素能够降低缺血再灌注肝脏内细胞的凋亡水平。
以上数据共同表明川陈皮素能够有效抑制KCs活化及其炎症因子的分泌,减轻肝移植后肝脏IRI,且AKT/GSK3β/NF-κB信号通路参与了该保护作用,但尚有其他可能机制参与其中,需要进一步研究。
