microRNA-29a通过PI3K/AKT/mTOR信号途径抑制子宫内膜癌的发生①
2021-05-25王彩霞乔世聪重庆市中医院妇科重庆400021
王彩霞 夏 敏 王 洁 乔世聪 万 丹 姚 瑶(重庆市中医院妇科,重庆400021)
子宫内膜癌(endometrial carcinoma,EC)是一种常见的妇科恶性肿瘤,约占女性生殖系统恶性肿瘤的1/3[1]。近年来,随着人们生活方式及饮食结构的改变,EC的发病率在世界范围内呈上升趋势,且发病年龄日趋年轻化,有研究报道5%至10%的EC患者年龄在45岁或以下[2]。而临床治疗方面,早期诊断的EC患者可进行单独手术治疗和(或)辅助化疗或放疗的联合治疗[3];而中晚期EC患者的治疗方法包括根治性子宫切除术、双侧输卵管卵巢切除术、腹腔淋巴结消扫术,并根据疾病的分级及分期再进行化疗或放疗[4]。故EC严重威胁女性的生殖及生命健康。但迄今为止EC的发病原因尚未完全阐明,因此积极深入地从基因、分子层面探索其病因及发病机制对寻找及研发有效治疗EC的靶向药物具有重要意义。microRNA(miRNA)是一类由19~25个核苷酸组成的短链非编码小RNA分子,可通过与目的基因的3′非翻译区(3′UTR)进行配对结合,并对后者的mRNA进行降解或抑制其翻译,从而参与调控细胞的增殖、凋亡和侵袭等生物学行为,并在肿瘤的发生发展中起着重要的调节作用[5-6]。近年来,有研究表明microRNA与EC的发生、发展、侵袭及转移等过程密切相关[7-8]。miR-29a位于染色体7q32.3上,是mi-29家族最新发现的成员之一。有学者报道在黑色素瘤中,miR-29a能通过NF-κB及Wnt/β-catenin信号通路调控BMI1基因的表达从而抑制黑色瘤细胞的生长、迁移及侵袭功能,从而发挥抑癌基因的作用[9]。在前列腺癌中,阎成全等[10]应用基因芯片检测发现miR-29a在肿瘤组织中的表达显著降低,进一步研究发现miR-29a可能通过抑制前列腺癌细胞中赖氨酸特异性去甲基化酶4B(KDM4B)的表达,进而抑制肿瘤细胞的生长并诱导其发生凋亡。但miR-29a在EC中的报道还十分罕见,有待进一步探究。本研究分别从基因芯片,生物信息学及细胞生物学技术方面探索miR-29a在EC发生发展中的生物学功能及相关机制,从而为寻求新的子宫内膜癌的靶向治疗药物提供实验室基础及理论依据。
1 材料与方法
1.1 材料
1.1.1 临床标本 选取2018年4月至2019年4月于重庆市中医院住院接受手术治疗,且术后病理确诊为EC的15例患者(EC组),其平均年龄(53.3±2.7)岁。对照组为同期在我院住院因子宫肌瘤切除子宫,经病理证实为正常子宫内膜的15例患者(normal组),其平均年龄(54.1±6.9)岁。两组患者的年龄比较差异无统计学意义(P>0.05)。用于提取RNA的子宫内膜组织在离体后迅速置于液氮中保存。所有受试对象术前均未接受任何放疗、化疗及激素治疗且无内分泌、免疫、代谢性等疾病。本研究经医院伦理委员会审批,患者及家属知情同意并签署相关知情同意书。
1.1.2 细胞系及试剂 子宫内膜癌细胞系HEC-1A细胞购于中国科学院上海细胞库;胎牛血清(FBS)、DMEM/F12、Opti-MEM购自Gibco公司;Trizol、Lipofectamine2000、RIPA裂解液、BCA蛋白定量试剂盒购自Invitrogen公司;逆转录与实时定量PCR试剂盒购自TaKaRa公司;Annexin V-FITC凋亡试剂盒、基质胶购自BD公司;MTT试剂盒、青链霉素混合液(均为100 U/ml)购自Sigma公司;miR-29a mimic、miR-29a inhibitor及对应的阴性对照随机序列(mimic-scramble及inhibitor-scramble)、PI3K野生型(WT)及突变型(MUT)荧光素酶报告基因质粒购自上海吉玛;荧光酶检测试剂盒购自Promega公司;Transwell小室(孔径8µm)购自Millipore公司;PI3K、p-AKT、mTOR抗体、GAPDH购自Abcam公司;实时荧光定量PCR引物购自上海生工。
1.2 方法
1.2.1 基因芯片技术筛选差异表达miRNA 参考相关文献[11]选取3对EC组与对照组内膜组织中的RNA,委托北京博奥生物公司进行检测以筛选差异表达miRNA,简述如下:按照miRNeasy Mini Kit试剂盒使用说明从3对受试者的内膜组织中提取等量的总RNA进行纯化。分光光度计检测RNA纯度与浓度后,每个样本取1µg的RNA并按照Hy3/Hy5 Power Labeling Kit说明对RNA样本进行标记。将上述标记后的RNA与miRCURYTMLNA Array进行杂交,再采用GenePix 4000B芯片扫描仪读取芯片的原始信号强度。然后通过芯数据的标准化校正后,统计学显著性检验与聚类分析筛选获得在EC内膜组织样品与正常对照组样品中具有显著差异表达的miRNA谱,并以热图的形式展出。其中筛选标准为表达上调或下调倍数变化值≥2.0的miRNA分子。
1.2.2 细胞培养、转染及分组 HEC-1A细胞常规复苏后用含有10%FBS与1%青链霉素的DMEM/F12培养液培养,置于37℃、5%CO2恒温培养箱中,待细胞生长融合至70%~80%时用0.25%的胰酶进行消化,室温下800 r/min离心5 min,弃上清,DMEM/F12培养基重悬后进行传代。转染前一天,将处于对数生长期的HEC-1A细胞常规消化后接种于24孔细胞培养板中,调整细胞密度至2×105个/孔,置于37℃、5%CO2恒温培养箱中培养过夜。参考文献[12]进行脂质体瞬时转染,简述如下:将DMEM/F12培养基更换为Opti-MEM培养液,并根据脂质体Lipofectamine 2000说明书分别将miR-29a mimic、in⁃hibitor、mimic-scramble和inhibitor-scramble,按终浓度50 nmol/L转染入HEC-1A细胞内。并将细胞分为:miR-29a过表达组,即转染miR-29a mimic组;mimic-scramble组,即转染miR-29a mimic阴性对照随机序列;miR-29a抑制组,即miR-29a inhibitor组;inhibitor-scramble组,即转染miR-29a inhibitor阴性对照随机序列;正常对照组即为无任何处理的HEC-1A细胞。于37℃、5%CO2恒温培养箱中培养6 h后更换为含10%FBS的DMEM/F12常规培养液。收集转染48 h后的细胞用于后续实验研究。
1.2.3 MTT细胞增殖实验 参考文献[13]进行MTT细胞增殖实验,简述如下:取处于对数生长期的细胞,细胞常规消化后接种于96孔板中,调整细胞密度至1×104个/孔,并向每孔加入200µl含10%FBS和1%青链霉素的DMEM/F12培养液。置于37℃、5%CO2恒温培养箱中进行培养,分别于12、24、48、72 h向每孔加入5 mg/ml的MTT试剂20µl后,于培养箱中继续培养4 h,弃除原培养液后,每孔加入150µl的二甲基亚砜(DMSO)溶液,室温下振荡10 min使形成的紫色甲瓒结晶充分溶解。酶标仪490 nm检测每孔吸光度值(A490)。根据公式:(正常对照组A490-实验组A490)/正常对照组A490,计算并分析各组细胞的增殖率。每组设定5个复孔,实验单独重复3次。
1.2.4 Transwell细胞侵袭实验 参考文献[12]进行Transwell细胞侵袭实验,简述如下:基质胶4℃溶解后,用不含FBS的DMEM/F12培养基以1:5进行稀释,并取40µl稀释后的基质胶包被Transwell上室,于37℃下静置4 h,使基质胶凝固后备用。收集处于对数生长期的HEC-1A细胞,用含1%FBS与1%双抗的DMEM/F12培养液进行饥饿培养24 h后,用0.25%胰酶进行常规消化,用不含FBS的DMEM/F12培养基重悬细胞,调整密度至4×105个/ml。向Transwell小室中加入无血清细胞悬液200µl,下室加入500µl含10%FBS的常规DMEM/F12培养液。每组设定3个复孔,于37℃、5%CO2恒温培养箱培养48 h。取出上室,PBS冲洗2次,并用湿棉签轻轻擦拭小室上层未穿出细胞,无水酒精固定15 min,室温下晾干。0.1%结晶紫于室温下染色30 min,PBS冲洗2次后于倒置显微镜下观察穿出细胞数,每组随机选取5个视野进行计数。实验单独重复3次。
1.2.5 细胞划痕实验 参考文献[13]进行细胞划痕实验,简述如下:预先在6孔板每个孔底部使用marker笔划2条间隔为5 mm的横线,再将细胞接种于6孔板中,每孔加入2 ml含10%FBS与1%双抗的DMEM/F12培养液,并使每孔细胞达2×105个,于37℃、5%CO2恒温细胞培养箱进行培养,待细胞密度达到80%左右时使用200µl移液器枪头在细胞培养面垂直于marker笔划线,PBS冲洗细胞3次以去除刮除掉的细胞。再向每孔加入含2%FBS的DMEM/F12培养液,于细胞培养箱中继续培养24 h,倒置显微镜下拍摄,使用Image J软件测量细胞间距离并进行分析。实验单独重复3次。
1.2.6 Annexin V-FITC细胞凋亡实验 参考相关文献[10]进行Annexin V-FITC细胞凋亡实验,简述如下:收集处于对数生长期的细胞,每孔加入1 ml的0.25%胰酶进行常规消化,收集细胞悬液至5 ml离心管中,1 200 r/min离心5 min,弃上清,取细胞沉淀并加入195µl Annexin V-FITC结合液重悬细胞,调整细胞浓度至7×105个/ml,并依次加入5µl An⁃nexin V-FITC及10µl的碘化丙啶(PI)染色液,轻轻摇晃离心管以充分混匀后,室温下避光孵育半小时。最后流式细胞仪检测。实验单独重复3次。
1.2.7 RT-qPCR实验 参考文献[10]进行RT-qP⁃CR实验,简述如下:收集处于对数生长期的细胞,按照Trizol法提取组织或细胞中总RNA,经纯度检测与定量后,根据逆转录试剂说明书逆转录为cDNA,再按照RT-PCR试剂说明书及预实验确定的反应时间与温度进行实时定量,RT-PCR反应条件为:95℃(10 min)预变性后,变性95℃(7 s)→退火60℃(20 s)→72℃(38 s),40个循环周期。RT-PCR引物为:miR-29a上游引物5'-CGACTCTAGAAACACAAGAGCA-3',下 游 引 物5'-AAGGTTAGCTTACTGTCACAC⁃GCTT-3';PI3K上 游 引物5'-ATACCGCGGACTGT⁃GTTTCCAGTACACCT-3',下 游 引 物5'-ACTGT⁃GTTTCCAGTACACCTACTGACCGTGACATCCTC-3';GAPDH上游引物5'-AGAAGGCTGGGGCTCATTTG-3',下 游 引 物5'-AGGGGCCATCCACAGTCTTC-3'。以GAPDH为内参,采用2-∆∆Ct方法分析相关基因的表达量。
1.2.8 双荧光素酶基因报告实验 参考文献[11]进行双荧光素酶基因报告实验,简述如下:采用miR⁃NA靶基因在线数据库TargetScan预测miR-29a靶基因并筛选PI3K进行验证。取处于对数生长期的HEC-1A细胞,调整细胞密度为2×104个/孔,接种于96孔板中,于37℃、5%CO2恒温培养箱中培养过夜,待细胞完全贴壁后,利用Lipofectamine2000将PI3K野生型(WT)及突变型(MUT)荧光素酶报告基因质粒分别转入HEC-1A细胞中,再将miR-29a mimic及mimic-scramble分别转入PI3K野生型及突变型细胞中,每组设5个复孔,转染48 h后,按照双荧光素酶检测试剂盒说明书检测PI3K启动子的荧光强度。
1.2.9 Western blot实验 参考文献[14]进行West⁃ern blot实验,简述如下:收集处于对数生长期的细胞,4℃预冷的PBS洗涤细胞3次后,加入RIPA细胞裂解液及蛋白酶抑制剂提取细胞总蛋白。BCA法进行蛋白定量,按照1:4向上清液中加入5×蛋白上样缓冲液,并于沸水中加热变性10 min。取35µg的蛋白进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,采用湿转法将分离的蛋白转至PVDF膜上,5%脱脂牛奶于室温下封闭2 h,分别加入PI3K(1:800),p-AKT(1:500)、mTOR(1:500)、GAPDH(1:1 000)一抗,4℃摇床孵育过夜。TBST溶液清洗3次,5 min/次,以辣根酶标记的二抗(1:5 000)室温孵育1 h,用TBST溶液清洗3次,5 min/次。最后均匀滴加ECL发光液后于凝胶成像仪进行曝光拍照。Image J软件测定条带灰度值,以目标蛋白与内参GAPDH的比值作为其相对含量。上述实验重复3次。
1.3 统计学分析 采用SPSS18.0和GraphPad Prism5.0对数据进行统计学分析,数据结果以±s表示,采用单因素方差分析(one-way ANOVA)进行多组间分析,两组间比较采用独立样本t检验。显著性检验水准α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 miR-29a在EC组织与正常子宫内膜组织中的差异表达 采用miRNA芯片筛选出在EC组与正常对照组的子宫内膜组织中差异表达的miRNA,发现有36种miRNAs存在不同程度的差异性表达,将差异倍数(fold change,FC)≥2作为筛选标准,同时选取在3例EC患者中表达一致下调的,且下调趋势最为显著(大于3倍)的miR-29a进行研究。随后通过RT-PCR实验对所有15例内膜癌组织与正常对照组织进行检测,结果表明与正常对照组相比,miR-29a在EC患者的内膜组织表达显著降低(P=0.021)。见图1。
2.2 转染miR-29a mimic/inhibitor后EC细胞中miR-29a的表达 HEC-1A细胞在转染miR-29a mimic、inhibitor后,RT-PCR实验结果显示,与正常对照组HEC-1A细胞相比,miR-29a mimic组细胞中miR-29a的表达显著升高(P=0.019),而miR-29a in⁃hibitor组HEC-1A细胞中miR-29a的表达明显降低(P=0.021),mimic-scramble及inhibitor-scramble组细胞中miR-29a的表达无明显变化(P=0.887、P=0.925)。见图2。
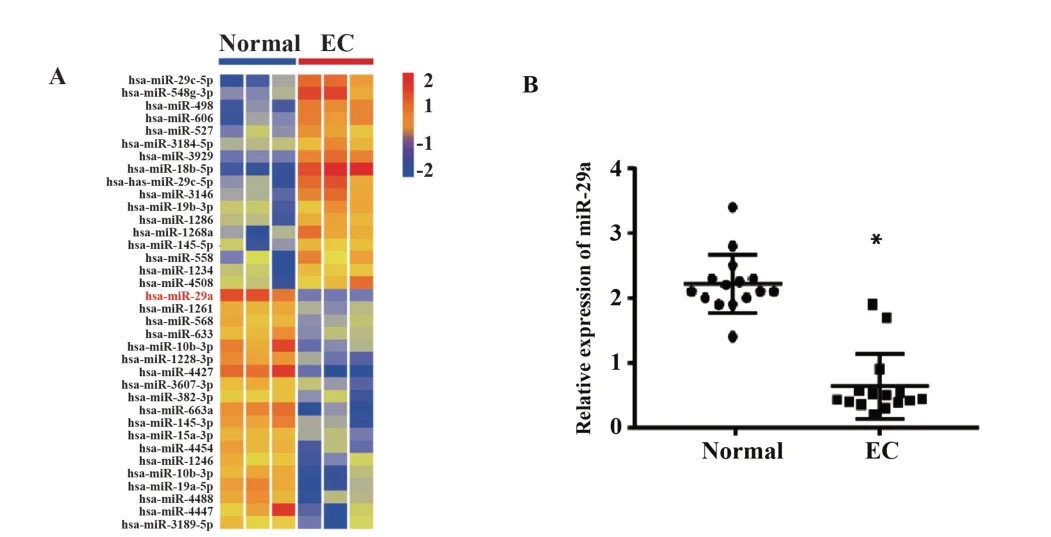
图1 miR-29a在EC中异常低表达Fig.1 miR-29a was significantly under-expressed in EC tissue

图2 转染miR-29a mimic/inhibitor后EC细胞中miR-29a的表达Fig.2 Expression level of miR-29a in EC cells after trans⁃fection with miR-29a mimic/inhibitor
2.3 miR-29a对EC细胞增殖的影响 MTT实验结果显示与正常对照组HEC-1A细胞相比,miR-29a mimic组细胞增殖能力明显减弱(P=0.011),而miR-29a inhibitor组细胞增殖能力显著增强(P=0.038),mimic-scramble及inhibitor-scramble组细胞的增殖能力无明显变化(P=0.753、P=0.696)。见图3。
2.4 miR-29a对EC细胞侵袭能力的影响 Tran⁃swell实验结果显示与正常对照组HEC-1A细胞相比,miR-29a mimic组细胞的侵袭能力显著下降(P=0.004),miR-29a inhibitor组细胞的侵袭能力明显增强(P=0.008),mimic-scramble及inhibitor-scramble组细胞的侵袭能力无明显变化(P=0.871、P=0.834)。见图4。
2.5 miR-29a对EC细胞迁移能力的影响 迁移实验结果显示与正常对照组HEC-1A细胞相比,miR-29a mimic组细胞迁移能力显著下降(P=0.004),miR-29a inhibitor组细胞迁移能力明显增强(P=0.027),mimic-scramble及inhibitor-scramble组细胞的迁移能力无明显变化(P=0.468、P=0.620)。见图5。
2.6 miR-29a对EC细胞凋亡的影响 Annexin VFITC凋亡实验结果显示与正常对照组HEC-1A细胞相比,miR-29amimic组细胞凋亡发生率显著升高(P=0.007),miR-29a inhibitor组细胞凋亡发生率明显降低(P=0.029),mimic-scramble及inhibitor-scramble组细胞的凋亡发生率无明显变化(P=0.943、P=0.886)。见图6。
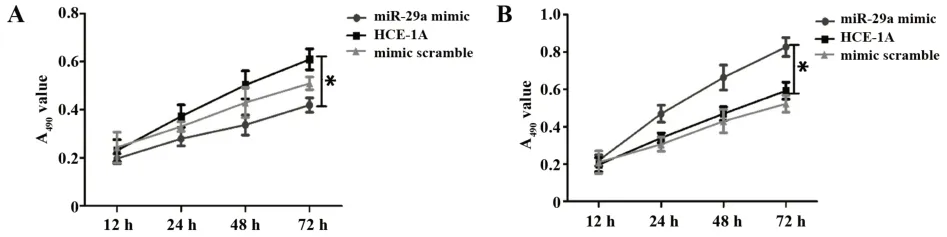
图3 miR-29a对EC细胞增殖能力的影响Fig.3 Effect of miR-29a on proliferation of EC cells
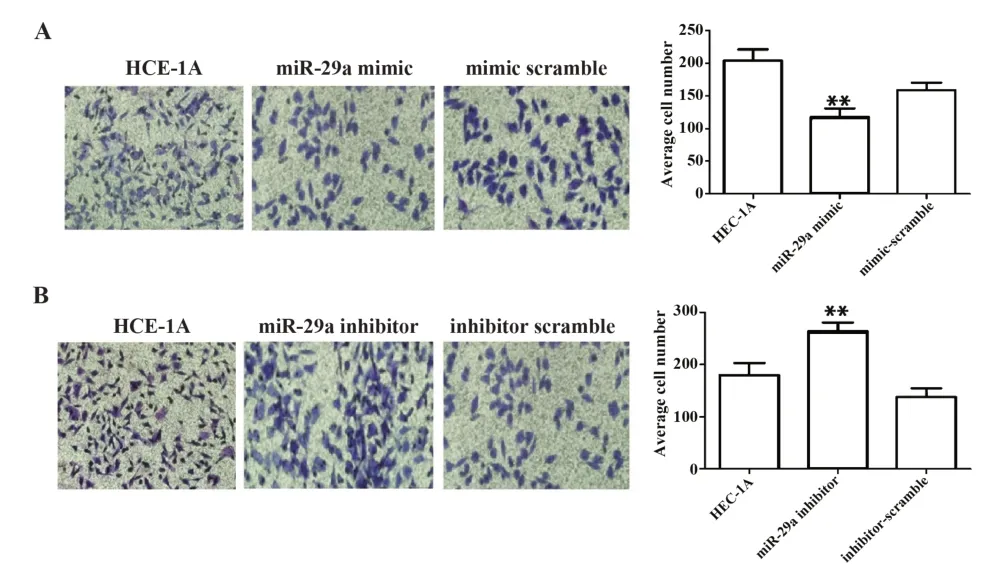
图4 miR-29a对EC细胞侵袭能力的影响Fig.4 Effect of miR-29a on invasion of EC cells
2.7 miR-29a在EC细胞中与PI3K的靶向关系 miRNA靶基因在线数据库TargetScan结果显示PI3K基因的3′-UTR区存在能与miR-29a的结合序列,这提示PI3K基因可能为miR-29a的潜在靶基因。利用双荧光素酶基因报告实验进行验证,如图7B所示,与mimic-scramble相比,miR-29a mimic能使PI3K-WT组的荧光酶活性显著降低(P=0.021),而PI3K-MUT组的荧光酶活无明显变化(P=0.447)。见图7。
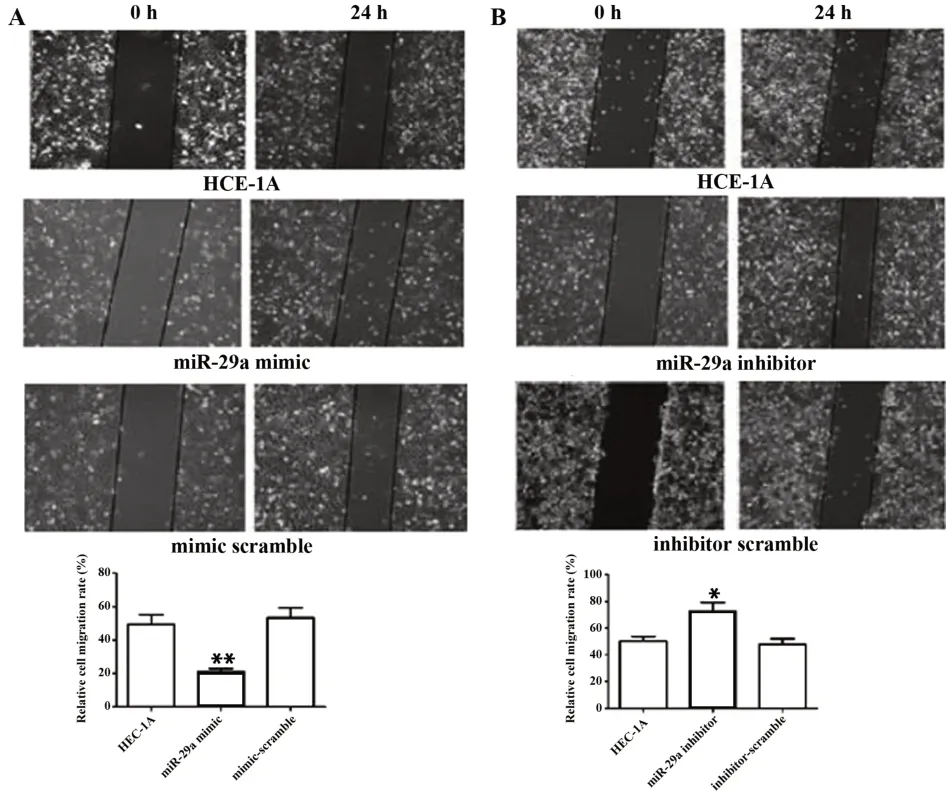
图5 miR-29a对EC细胞迁移能力的影响Fig.5 Effect of miR-29a on migration of EC cells

图6 miR-29a促进EC细胞发生凋亡Fig.6 Effect of miR-29a on EC cell apoptosis
2.8 miR-29a对EC细胞中PI3K/AKT/mTOR信号通路的影响 Western blot实验结果显示与正常对照组HEC-1A细胞相比,miR-29a mimic组细胞中PI3K、p-AKT、mTOR蛋白表达均明显降低(P=0.023、P=0.037、P=0.019),而miR-29a inhibitor组细胞中PI3K、p-AKT、mTOR蛋白表达均显著增加(P=0.044、P=0.039、P=0.028),mimic-scramble及inhibitor-scramble组细胞中上述蛋白均无明显变化(P=0.573、P=0.639、P=0.954与P=0.125、P=0.944、P=0.778)。见图8。
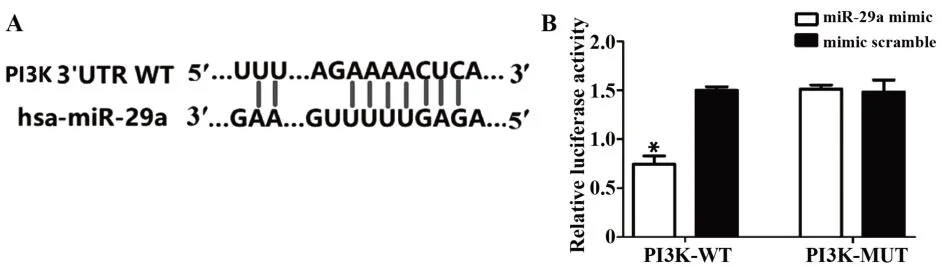
图7 miR-29a在EC细胞中靶向调控PI3K的表达Fig.7 miR-29a targets expression of PI3K in EC cells
3 讨论
EC是发生于子宫内膜的一种上皮恶性肿瘤,好发于围绝经期及绝经后妇女,常表现为阴道不规则出血或流液[12]。据报道,每年有接近20万的新发病例,且发病年龄日趋年轻化,严重危害女性身体及生殖健康[2]。miRNA是近年来癌症研究的热点,因其具有多靶点及组织特异性等特点,使其调控网络复杂庞大,且研究证实多种肿瘤具有其特征性的miRNA表达谱,如在乳腺癌、胃癌、肺癌等肿瘤中均发现特异性表达差异的miRNAs[6,15-17]。miRNA在肿瘤细胞中通过调控其下游靶基因,参与调节细胞的分化、增殖、侵袭、凋亡等多种生物学行为,从而发挥促癌或抑癌基因的作用[13]。GONG等[18]发现在宫颈癌组织中miR-29a表达显著下调,进一步研究证实miR-29a通过下调DNA甲基化转移酶1(DNM1)的表达,下调细胞因子信号传导抑制因子1(SOCS1)的启动区甲基化水平,从而调控宫颈癌细胞的增殖、侵袭及凋亡等生物学行为,最终发挥抑癌基因的作用。在胶质瘤组织中,miR-29a表达水平同样存在显著降低现象,其可能通过负向调控参与肿瘤免疫逃逸的重要负性因子B7-H3(CD276)的表达,进而下调趋化因子CXCR4,最终抑制胶质瘤细胞恶性侵袭能力[14]。在肝癌中,miR-29a通过靶向抑制细胞间连接蛋白CLDN1的表达,从而抑制肿瘤细胞的生长及迁移[19]。本研究通过基因芯片筛选EC患者与健康对照组子宫内膜中差异性表达的miRNAs,发现miR29a显著低表达于EC患者的子宫内膜组织中,同时PR-PCR实验结果同样证实,在EC细胞系HEC-1A中miR29a的表达亦显著降低。为进一步明确miR-29a是否影响EC的发生发展,我们又通过脂质体瞬时转染技术对HEC-1A细胞中miR-29a进行过表达或抑制处理,并利用MTT、Transwell、划痕实验及Annexin V-FITC凋亡实验分别检测miR-29a对EC细胞的增殖、侵袭、迁移及凋亡的影响,结果显示过表达EC细胞中的miR-29a,可明显抑制细胞的增殖、侵袭、迁移能力,并促进细胞发生凋亡,而抑制其表达,EC细胞的增殖、侵袭、迁移能力显著提高,且细胞的凋亡率明显下降。生物信息学结果显示PI3K可能是miR-29a的潜在靶基因,双荧光素酶基因报告实验及Western blot验证了两者的靶向关系。这提示在EC中,miR-29a可能通过下调PI3K的表达,抑制肿瘤细胞的增殖、侵袭、迁移能力,促进其发生凋亡。
近年来,研究发现PI3K/AKT/mTOR信号通路在乳腺癌、肺癌、前列腺癌等多种肿瘤的发生发展中具有重要地位,且该通路与细胞生存、增殖及凋亡等生物学行为密切相关[20]。磷脂酰肌醇-3(phos⁃phatidyl inositol 3-kinase,PI3K)是一种异质二聚体,其通过与细胞表面各种受体如生长因子、G蛋白偶联受体等相互作用,引起自身构象的改变而被激活[21]。激活的PI3K通过磷酸化细胞内的第二信使4,5-二磷酸酯酰肌醇,并使其活化下游的主要效应蛋白——蛋白激酶B(protein kinase B,AKT)从细胞膜转移至细胞质,并促使构象改变,发生磷酸化(p-AKT)而被激活。而激活后的p-AKT通过启动下游靶基因mTOR,从而参与调节促进细胞增殖、转移、凋亡等生物学行为[22]。最新的研究表明,促进PI3K/AKT/mTOR信号通路同样能够增强针对肿瘤的固有免疫反应,进而加强机体对肿瘤的免疫监视来延缓病情的进展[23],如在黑色瘤的小鼠模型中,应用PI3K抑制剂GSK2636771能够显著促进肿瘤组织中CD8+T细胞的浸润,延缓小鼠的生存期[24]。本研究通过Western blot实验在过表达与抑制miR-29a表达的EC细胞中检测PI3K/AKT/mTOR信号通路PI3K、p-AKT、mTOR蛋白的表达,结果显示上调EC细胞中miR-29a的表达,可明显抑制PI3K、p-AKT、mTOR的表达,而抑制细胞中miR-29a的表达,PI3K、p-AKT、mTOR的表达却显著增强。这提示在EC中,miR-29a可能通过PI3K/AKT/mTOR信号通路影响肿瘤细胞增殖、侵袭、迁移及凋亡能力。
综上所述,我们发现在子宫内膜癌中低表达miR-29a可能通过抑制PI3K的表达,从而下调PI3K/AKT/mTOR信号通路,抑制内膜癌细胞的增殖、侵袭及迁移能力,并促进细胞发生凋亡,从而发挥着抑癌基因的作用。本研究证实miR-29a是子宫内膜癌中重要的抑癌miRNA,纠正EC中miR-29a的异常低表达可能成为子宫内膜癌基因治疗的有效手段。众所周知,肿瘤微环境是肿瘤发生发展的土壤,其主要由免疫细胞、成纤维细胞及细胞外基质等成分共同构成[25],而鉴于miR-29a及靶基因PI3K在肿瘤相关免疫中的重要地位,下一步我们课题组将从miR-29a是否能够通过PI3K/AKT/mTOR信号通路影响肿瘤微环境中的相关免疫细胞功能方面继续深入探究miR-29a在EC中的其他作用,以期为针对miR-29a在子宫内膜癌中的靶向治疗提供新的证据。
