PARP抑制剂卵巢癌治疗研究进展
2021-05-25余敏华金明珠
余敏华,金明珠,狄 文*
(1.上海交通大学医学院附属仁济医院妇产科上海市妇科肿瘤重点实验室癌基因及相关基因国家重点实验室,上海 200127;2.上海交通大学医学院,上海 200025)
1 背 景
卵巢癌早期无特异临床症状,就诊时70%的患者已处于晚期[1],经初始治疗后患者3年累积复发率仍高达70%,5年总生存率不足50%[2]。晚期卵巢癌目前标准的初始治疗方案为最大程度的肿瘤减瘤术,随后进行6个疗程的含铂方案化疗。然而,绝大部分卵巢癌患者随后出现疾病复发,经多线治疗后进展为铂耐药,往往预后不良[3]。晚期卵巢癌在手术和(或)化疗达到完全缓解或部分缓解后继续采用化学药物或靶向药物进行维持治疗,目的是延缓复发,延长无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。过去使用贝伐珠单抗作为维持治疗药物,患者获益有限,近年来聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂的出现极大改善了这一局面。一系列临床循证医学证据表明,PARP抑制剂无论是在一线维持还是铂敏感复发维持阶段,都显著延长卵巢癌患者的PFS,维持治疗已成为卵巢癌治疗的新模式。美国食品药品监督管理局(U.S.Food&Drug Administration,FDA)和国家药品监督管理局(National Medical Products Administration,NMPA)均批准了PARP抑制剂用于维持治疗的适应证。此外,对于复发性卵巢癌,PARP抑制剂单药或联合其他药物治疗替代化疗的方案也在不断探索中,多个临床试验在全球进行,并取得了一定疗效。本文现就PARP抑制剂在卵巢癌领域的研究进展进行文献回顾。
2 PARP抑制剂的作用机制
DNA损伤修复在维护正常细胞的增殖和凋亡中起着重要作用。修复酶PARP于1963年首次被发现,PARP作为DNA单链损伤的感受器,在DNA单链损伤后被激活,催化尼克酰胺腺嘌呤二核苷酸(nicotinamideadenine dinucleotide,NAD)合成聚ADP-核糖(polyADP-ribose,PAR)链,将其连接于组蛋白,松弛染色质并募集修复蛋白,从而参与肿瘤细胞的DNA单链损伤修复。在DNA复制过程中,未被修复的DNA单链损伤转变成双链损伤,通过同源重组,又可进行修复。PARP酶和同源重组修复通路的存在,使得很多DNA损伤都可顺利修复,从而保持细胞正常的存活。乳腺癌易感基因1/2(breast cancer susceptibility gene 1/2,BRCA1/2)是抑癌基因,该基因突变可抑制DNA损伤后正常修复能力,引起同源重组缺陷(homologous recombination deficiency,HRD),即BRCA功能缺失或其他同源重组相关基因发生突变或功能缺失,使双链断裂的DNA修复不能通过同源重组修复,最终致癌。在HRD肿瘤细胞中,DNA双链无法修复,PARP抑制剂又阻断单链修复,从而形成“合成致死”效应[4]。
PARP抑制剂发挥作用主要通过抑制催化活性与“捕获”能力两方面:一方面,PARP抑制剂通过与NAD+竞争结合PARP,使PAR链无法形成,而PAR链在修复中起着重要作用,进而使DNA单链损伤无法修复;另一方面,PARP抑制剂能结合到PARP的NAD+结合位点,形成稳定的构象,造成DNA-PARP的不可逆解离,这个过程被称为DNA-PARP复合物的“捕获”,这导致PARP始终与DNA结合,造成双链损伤,使其无法修复,从而持续产生致命性DNA损伤,发生染色体的融合和易位,最终导致细胞凋亡[5]。目前越来越多的临床试验表明,PARP抑制剂不仅可使BRCA突变或HRD阳性的卵巢癌患者受益,也可使铂敏感的卵巢癌患者受益,其机制可能与PARP抑制剂的捕获作用有关。
3 已上市的PARP抑制剂国内外适应证的获批情况
3.1 维持治疗 复发卵巢癌维持治疗方面,美国FDA批准了尼拉帕利、奥拉帕利和卢卡帕利均可用于铂敏感复发性上皮性卵巢癌患者在含铂化疗达到完全缓解或部分缓解后的维持治疗,中国NMPA批准了尼拉帕利和奥拉帕利同样的适应证。在初治卵巢癌维持治疗方面,美国FDA和中国NMPA均获批了奥拉帕利用于新诊断BRCA突变上皮性卵巢癌患者,在一线含铂化疗方案达到完全缓解(complete remission,CR)或部分缓解(partial remission,PR)后的维持治疗。尼拉帕利用于所有新诊断晚期卵巢癌,在一线含铂化疗方案达到完全缓解或部分缓解后的维持治疗(表1)。
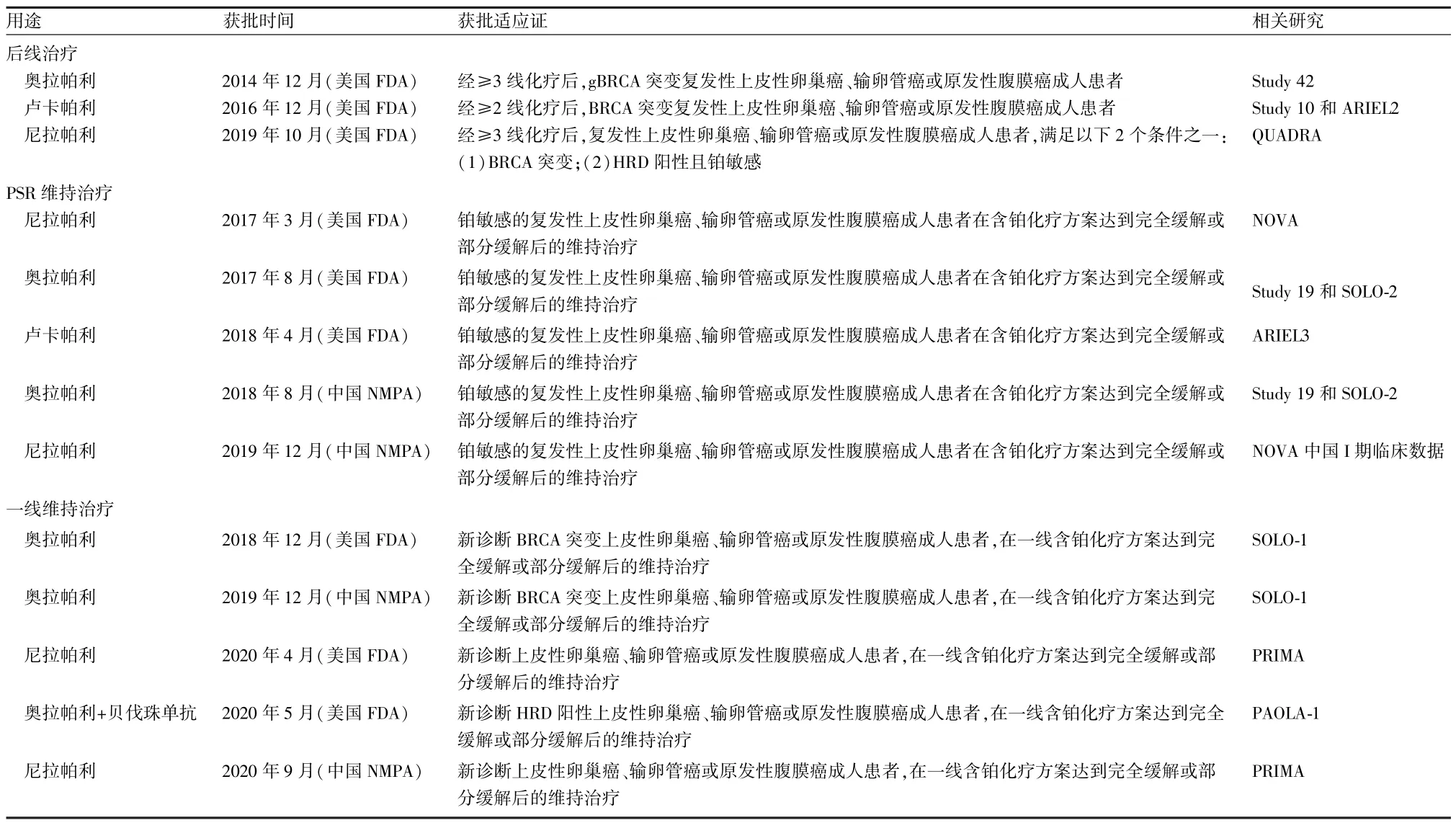
表1 PARP抑制剂的获批适应证
3.2 后线治疗 目前美国FDA批准了奥拉帕利和卢卡帕利用于BRCA突变的复发性上皮卵巢癌的后线治疗,尼拉帕利用于BRCA突变或HRD阳性且铂敏感的复发性上皮卵巢癌的后线治疗,中国NMPA尚未批准PARP抑制剂用于卵巢癌后线治疗。
4 PARP抑制剂在卵巢癌中的临床研究
4.1 PARP抑制剂在卵巢癌中作为维持治疗的疗效
4.1.1 单药治疗
(1)初治卵巢癌一线维持治疗:卵巢癌初始治疗达到CR或PR后,需给予后续治疗延迟复发,改善生存预后。PARP抑制剂作为一线维持治疗药物完成了多项Ⅲ期临床随机对照试验,疗效显著。
尼拉帕利:尼拉帕利主要针对PARP1酶和PARP2酶,有较强的PARP捕获能力,是全球第一个获批用于所有铂敏感复发性卵巢癌患者维持治疗的PARP抑制剂。PRIMA研究[6]是一项双盲、安慰剂对照的3期试验,用于评价尼拉帕利对新诊断的、晚期、高级别浆液性或子宫内膜样卵巢癌、原发性腹膜或输卵管癌患者一线含铂化疗后完全或部分缓解的维持治疗的疗效。无论是否存在BRCA突变均纳入研究,研究结果显示,与安慰剂相比,尼拉帕利可显著延长中位PFS约5.7个月,亚组分析显示在HRD阳性/BRCA野生型患者中,尼拉帕利组较安慰剂组中位PFS时间延长11.4个月(19.6月vs 8.2月),复发或死亡风险降低50%(HR=0.50,95%CI为0.31~0.83,P=0.006);BRCA野生型/HRD阴性的患者中,尼拉帕利组较安慰剂组患者的中位PFS时间延长2.7个月(8.1个月vs 5.4个月),复发或死亡风险降低32%(HR=0.68,95%CI为0.49~0.94,P=0.020),充分表明尼拉帕利用于一线维持治疗可使晚期上皮性卵巢癌患者全人群有不同程度的获益。中国正在进行的PRIME研究,是一项III期随机对照试验,用于初治晚期卵巢癌含铂化疗达到CR/PR后的维持治疗,目前已完成381例患者的入组。
奥拉帕利:SOLO1研究[7]显示奥拉帕利用于BRCA1/2突变的初治晚期卵巢癌维持治疗,中位随访41个月,疾病进展或死亡风险降低70%,奥拉帕利组和安慰剂对照组的3年PFS率分别为60%和27%(HR=0.30,95%CI为0.23~0.41,P<0.001)。2020年ESMO公布SOLO1研究5年随访结果,奥拉帕利组和安慰剂对照组的5年PFS率分别为48%和21%,中位PFS分别为56个月和13.8个月(HR=0.33,95%CI为0.25~0.43)。其中中国队列64例,队列疗效数据和全球一致。
(2)复发卵巢癌的维持治疗:复发卵巢癌分为铂敏感复发和铂耐药复发,复发患者化疗缓解后也需维持治疗,PARP抑制剂用于铂敏感复发维持治疗的研究取得较大突破,FDA和NMPA均已批准尼拉帕利和奥拉帕利用于铂敏感复发卵巢癌的维持治疗。
尼拉帕利:NOVA研究[8]是针对于铂敏感复发卵巢癌维持治疗患者。研究发现gBRCA突变、BRCA野生型/HRD阳性以及BRCA野生型/HRD阴性患者均可通过尼拉帕利的维持治疗获得不同程度的生存获益,其中gBRCA突变患者mPFS比安慰剂组延长15.5个月,复发或死亡风险降低73%(mPFS:21.0月 vs 5.5月,HR=0.27,P<0.001)获益最大。NORA研究是第一项全中国人群PARP抑制剂Ⅲ期随机对照研究,针对铂敏感复发卵巢癌的维持治疗,该研究吸收NOVA研究的经验,采用尼拉帕利个体化起始剂量(基线体重<77kg或血小板计数<150000/μL的患者使用200mg/d起始剂量,其余使用300mg/d)。2020年ESMO会议公布了NORA主要研究结果,共纳入265例患者,尼拉帕利用于中国铂敏感复发卵巢癌患者维持治疗,尼拉帕利较安慰剂组明显延长PFS 12.9个月,降低整体人群68%的疾病进展或死亡风险(mPFS:18.3月vs 5.4月,HR=0.32,P<0.0001),gBRCA突变组和非gBRCA突变组分别降低疾病进展或死亡风险78%和60%。该研究是首个在全中国人群中进行的PARP抑制剂Ⅲ期注册临床试验,也是首次前瞻性验证了尼拉帕利个体化起始剂量较固定起始剂量有更好的耐受性且不影响疗效。
奥拉帕利:奥拉帕利的Ⅱ期研究Study19研究[9]显示,针对铂敏感复发患者,奥拉帕利较安慰剂明显延长患者PFS(mPFS:8.4月vs 4.8月,HR=0.35,P<0.001),复发或死亡风险降低65%,其中gBRCA突变患者从奥拉帕利维持治疗中获益更显著(mPFS:11.2月 vs 4.3月,HR=0.18,P<0.0001)。为进一步验证Study19的结果,Ⅲ期SOLO2研究[10](其中中国队列32例)将入组患者限定为携带gBRCA突变的铂敏感复发卵巢癌患者,奥拉帕利组的mPFS显著优于安慰剂组(mPFS:19.1月 vs 5.5月,HR=0.30,P<0.0001)。2020年ASCO公布了总生存期的随访结果,mOS较安慰剂组延长12.9个月,但未达到统计学差异,研究组对确认进展的患者进行了事后分析,考虑可能与第一次疾病进展后接受的治疗有关。针对安慰剂组后续接受PARP抑制剂治疗的患者进行了调整后,mOS较安慰剂组延长16.3个月(HR=0.56,95%CI为0.35~0.97),有统计学差异。
卢卡帕利:卢卡帕利针对铂敏感复发患者的维持治疗的ARIEL3研究显示[11],总体人群的卢卡帕利维持治疗组较安慰剂对照组中位PFS延长5.4个月,复发或死亡风险降低64%(mPFS:10.8月 vs 5.4月,HR为0.30~0.45,P<0.0001),且BRCA突变、BRCA野生型/HRD阳性和BRCA野生型/HRD阴性均有PFS获益。
4.1.2 联合用药 一线维持治疗方面,目前有关PARP抑制剂联合其他药物治疗的大型临床试验较少。PAOLA-1研究[12]为一项Ⅲ期临床随机对照试验,针对一线含铂类药物联合贝伐珠单抗有效的晚期上皮卵巢癌患者,表明奥拉帕利联合贝伐珠单抗治疗较贝伐珠单抗作为维持治疗,降低整体人群疾病进展或死亡风险41%,其中gBRCA突变患者和BRCA野生型/HRD阳性人群均有PFS获益,而HRD阴性或未知人群相较贝伐珠单抗单药无获益。化疗联合维利帕利序贯维利帕利的VELIA研究[13]显示,与单用化疗组相比,化疗联合维利帕利序贯维利帕利延长BRCA突变、HRD阳性和所有人群的PFS,但亚组分析显示HRD阳性和所有人群的PFS获益均来自BRCA突变患者。
4.2 PARP抑制剂治疗复发卵巢癌的研究 对于晚期卵巢癌患者,随着患者复发线数增多,对铂类药物的耐药性也逐渐增加,最终进展为铂耐药或铂抵抗复发,成为卵巢癌难治性的主要原因[14]。铂耐药复发卵巢癌对含铂化疗方案不再响应,目前临床推荐的非铂化疗反应率不高,多在20%左右。近年来,以奥拉帕利、尼拉帕利为代表的PARP抑制剂作为卵巢癌的靶向药物不仅在卵巢癌维持治疗领域开展了多项研究,在复发卵巢癌治疗领域也开展了多项临床试验。
4.2.1 单药治疗 尼拉帕利:尼拉帕利治疗≥3线复发卵巢癌的QUADRA研究[15]中,铂敏感复发,携带BRCA突变和HRD阳性患者的ORR分别为39%和26%;铂耐药复发,携带BRCA突变和HRD阳性患者的ORR分别为27%和10%。整体而言,无论铂敏感还是铂耐药复发患者,只要有BRCA突变或同源重组缺陷的患者,均有较好的效果[15]。中国正在进行尼拉帕利用于后线治疗QUADRA研究的桥接试验,计划入组15例患者。
奥拉帕利:奥拉帕利是第一个在复发性卵巢癌治疗中表现出临床疗效的PARP抑制剂。2016年发表的Study42[16]研究表明,对于治疗≥3线含铂化疗方案的BRCA突变铂耐药复发卵巢癌患者,奥拉帕利单药治疗ORR为31.1%。国际多中心III期临床研究SOLO-3[17]提示,针对既往接受了二线及以上化疗的BRCA突变铂敏感复发卵巢癌患者,奥拉帕利单药相较于传统不含铂化疗方式,可显著提高患者的客观缓解率(ORR:奥拉帕利组 vs医生决定组,71% vs 52%,P=0.002),延长了中位PFS,表明了奥拉帕利单药治疗在gBRCA突变晚期卵巢癌患者中的疗效。但在2019年发表的CLIO研究[18]中,与标准治疗(卡铂联合多柔比星脂质体/吉西他滨)相比,奥拉帕利单药用于治疗BRCA野生型铂敏感或铂耐药复发的上皮性卵巢癌患者的ORR、中位PFS均无统计学意义。
卢卡帕利:Study10研究[19]和ARIEL2研究[20]汇总分析显示,卢卡帕利治疗≥2线BRCA突变复发性卵巢癌,整体人群ORR为53.8%,铂敏感复发患者的ORR为65.8%,铂耐药复发患者为25%。
4.2.2 联合用药(包括抗血管生存药物、免疫抑制剂、化疗药) 在铂敏感复发的卵巢癌中,目前有PARP抑制剂联合抗血管生成药物、免疫治疗均有较好的治疗效果。奥拉帕利联合抗血管生成药cediranib对比奥拉帕利单药治疗的Ⅱ期随机对照临床研究纳入90例铂敏感复发卵巢癌患者,结果显示联合用药组较单药组可显著延长BRCA野生型卵巢癌患者的PFS和OS,而对BRCA突变型患者联合治疗较单药治疗无额外的生存获益[21-22]。另一项Ⅱ期开放性、随机对照AVANOVA研究纳入了97例铂敏感复发卵巢癌患者,相比于尼拉帕利单药,尼拉帕利联合贝伐珠单抗治疗铂敏感复发卵巢癌患者,可显著延长PFS,无论患者的HRD状态和无化疗间期如何[23]。PARP抑制剂联合免疫疗法治疗铂敏感复发卵巢癌方面也有相关报道,在2018年SGO大会上报告了一项奥拉帕利联合程序性死亡配体1(PD-L1)单克隆抗体Durvalumab治疗gBRCA突变的铂敏感复发卵巢癌患者的II期单臂临床研究,铂敏感复发卵巢癌患者ORR达到72%[14]。
在铂耐药复发的卵巢癌中,PARP抑制剂联合抗血管生成药物cediranib的临床研究为BAROCCO研究[24],该研究对比紫杉醇周疗对照组、持续奥拉帕利+cediranib联合治疗组和间断性联合治疗组的疗效(奥拉帕利每日给药,cediranib每周用药5天),结果提示持续用药组的mPFS(5.7m)较对照组(3.1m)相比,虽未取得统计学差异,但有延长的趋势(P=0.28)。尼拉帕利和PD-1单抗pembrolizumab联合治疗铂耐药复发卵巢癌患者的I/II期单臂临床的TOPACIO研究[25]提示,联合治疗铂耐药复发/难治性卵巢癌患者的ORR为18%,治疗效果不受BRCA状态的影响。
5 PARP抑制剂安全性
PARP抑制剂常见的不良反应包括血液学毒性和非血液学毒性。大部分不良反应于服药前3个月出现,通过减量、暂停以及对症治疗等可缓解,但仍有10% ~15%的患者因不良反应而终止治疗[8,10-11]。
血液学毒性是PARP抑制剂最常见的不良反应之一,主要包括贫血、血小板减少和中性粒细胞减少。贫血发生率为37% ~50%,3~4级不良反应发生率为19% ~25%。血小板减少发生率为14%~61%,3~4级血小板减少发生率为1%~34%。中性粒细胞减少发生率低于贫血和血小板减少,约为18% ~30%,其中4% ~20%为3~4级不良反应。3种PARP抑制剂均有1%~3%的患者发生治疗相关性肿瘤骨髓增生异常综合征和急性白血病,但除卢卡帕利对照组外,其他两组的对照组均有2%~4%的治疗相关性肿瘤骨髓增生异常综合征和急性白血病[8,10-11]。对于血液学毒性,可行血常规监测,通常第1年内,用药第1个月每周复查1次血常规,此后每月复查1次,1年后,可2~3月复查1次。当出现血常规异常,根据各PARP抑制剂用药说明书,进行剂量中断和调整,以及相应的对症处理,如血红蛋白<7g/dL考虑输血,血小板<50000/μL或有出血倾向考虑输注血小板和使用促血小板生长因子,中性粒细胞<1000/μL考虑使用重组人粒细胞集落刺激因子。如出现持续性血细胞减少,应尽早就诊于血液科。
常见的非血液学毒性包括胃肠道反应、疲劳、头痛、失眠等。胃肠道不良反应包括恶心、便秘、呕吐和腹泻,其中恶心是最常见的胃肠道不良反应,发生率为70% ~76%,多数为1~2级[20],仅3% ~4%的患者发生3~4级不良反应。疲劳也是常见的不良反应之一,发生率59% ~69%,大部分为1~2级症状,3级以上症状发生率小于3%。其他不良反应,如头痛和失眠发生率也相对较高,3种PARP抑制剂均有报道,分别为18% ~25%和6% ~24%,但通常症状较轻微;心血管的不良反应曾报道于NOVA研究[8]中使用尼拉帕利的患者,包括高血压、心动过速和心悸;肾功能损伤曾见于卢卡帕利和奥拉帕利的临床研究。其他报道的不良反应包括呼吸困难、鼻咽炎、咳嗽、关节痛、背痛,皮肤光敏反应、瘙痒症、皮疹和外周水肿等。上述大多数症状通过对症处理可缓解,必要时进行剂量调整。
目前大部分PARP抑制剂均有因不良反应发生终止治疗的事件,其中接受奥拉帕利的患者中有25%因不良反应药物减量,11%的患者最终因不良反应终止治疗[10];尼拉帕利标准剂量组有14.7%患者因不良反应终止治疗。值得一提的是,NORA研究表明,尼拉帕利的个体化起始剂量明显降低了不良反应事件,尤其是血液学毒性,其中血小板降低事件概率由标准剂量时的33.8%(NOVA研究)降低为11.3%(NORA研究),因不良反应终止治疗的概率降为4%[8];接受卢卡帕利治疗的患者中有55%因药物不良反应减量,13%终止治疗[20]。
6 展望与思考
晚期卵巢癌的标准方式仍是肿瘤减瘤术联合化疗,但几乎所有化疗都会带来各种各样的副反应,如消化道不良反应、心肝肾毒性、疼痛等,这些都会严重影响患者生活质量。如何减少乃至免除化疗带来的痛苦,把一种恶性肿瘤变成慢性病,使每位患者有尊严的生活,是各个肿瘤研究领域的理想。最著名的例子为血液界靶向药物酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),TKI的问世彻底改变了慢性髓性白血病的治疗局面,将一种中位生存期仅数年的恶性肿瘤变成了一种仅靠口服药物就能使80%以上的患者的生存期接近正常人。PARP抑制剂维持治疗已成为卵巢癌的标准治疗,且在后线治疗方面也取得一定疗效,但是PARP抑制剂能否替代化疗,免除患者的化疗严重副反应,成为“手术+PARP抑制剂”模式呢?目前关于尼拉帕利的QUADRA研究[20]、关于奥拉帕利的Study42[16]研究和SOLO-3[17]以及关于卢卡帕利的Study10研究[19]和ARIEL2研究[20]都是各种PARP抑制剂作为后线治疗复发卵巢癌的临床研究,体现出了PARP抑制剂在后线治疗中具有一定疗效,但能否跨线成为一线治疗尚缺乏临床研究。其次,从PARP的作用机制看,PARP抑制剂不仅可使BRCA突变或HRD阳性的卵巢癌患者受益,同时其“捕获作用”也可能是铂敏感的卵巢癌患者受益的原因。这提示研究者选择合适的生物标记物筛选出获益最大的人群使用PARP抑制剂是卵巢癌精准治疗的方向,这也是未来临床应用的趋势。
7 小 结
综上所述,卵巢癌是病死率最高的妇科恶性肿瘤之一,具有诊断时间晚、复发率高和死亡率高的特点。PARP抑制剂在卵巢癌初治一线维持和铂敏感复发维持阶段的应用,均能显著延长卵巢癌患者PFS,目前PARP抑制剂维持治疗已成为卵巢癌的标准治疗。近年来PARP抑制剂在后线治疗方面也取得一定疗效,尤其携带BRCA基因突变或HRD的患者获益更大。现多项临床试验表明,以PARP抑制剂为基础的联合用药(包括抗血管生存药物、免疫抑制剂、化疗药)有替代传统化疗的可能性。目前尚有许多问题仍是未知或存在争议,如PARP抑制剂如何选择,PAPP抑制剂可否跨线使用、HRD检测的临床意义以及HRD阴性患者治疗的优选、维持治疗的经济效益比等,这需更多的临床研究来回答。
