GPR37在肺腺癌中的表达及其临床意义
2021-05-25尤剑彬曹鹏驹陈发林
郭 静 尤剑彬 曹鹏驹 陈发林▲
1.福建医科大学省立临床医学院,福建福州 350001;2.福建省龙岩市第三医院检验科,福建龙岩 364000;3.福建省立医院检验科,福建福州 350001
从世界卫生组织对全球肺癌的最新统计数据来看,2018年全年新发肺癌病例约占癌症的11.6%,因肺癌死亡人数约占因癌症死亡人数的18.4%,肺癌已经成为当今世界上发病率和死亡率最高的肿瘤[1]。大部分患者发现时已属于中晚期,故寻找有效的早期诊断和指导预后的指标对于肺癌的治疗尤为重要。
G 蛋白偶联受体(G protein-coupled receptor,GPCR)包含7 个跨膜结构域,是迄今为止发现的最大的细胞膜受体,通过与各种不同的配体结合来传递来自细胞外环境的反应,是药物研发的一个重要领域[2]。研究表明,GPCR 在癌症的发生和转移中同样起关键作用[3-4]。G 蛋白偶联受体37(G protein-coupled receptor 37,GPR37)也称为帕金森相关内皮素受体样受体(parkin-associated endothelin receptor-like receptor,Peal-R),于1997年首次从人脑中克隆出来,定位于染色体7q31-33[5]。是一种罕见的GPCR,主要表达在小脑、胼胝体、壳核、尾状核、黑质和海马体等神经系统区域[6]。
本研究通过分析癌症基因组图谱公共数据集(the cancer genome stlas,TCGA),探讨GPR37 在肺腺癌中的表达及其临床病理特征的相关性。
1 材料与方法
1.1 TCGA 数据下载
在TCGA(https://cancergenome.nih.gov/)搜索并下载数据库中肺腺癌相关RNAseq 数据,在排除缺失生存资料和临床参数的病例后,共纳入510 例肺腺癌组织(肿瘤组)及对应的肺腺癌患者临床数据,其中癌和配对的癌旁组织56 例。
1.2 对GPR37 表达与临床预后的关系进行分析
利用已有数据,分析在总体510 例肺腺癌和56例癌旁组织中GPR37 的表达差异,进一步利用癌和癌旁配对数据对GPR37 的临床表达进行分析,采用COX逻辑回归分析评估肺癌患者预后的独立危险因数,采用Log Rank 检验对不同GPR37 表达水平肺腺癌患者进行分析,以P<0.05 为差异有统计学意义。
1.3 统计学方法
采用SPSS 23.0 统计学软件对数据进行统计分析,使用Graph-Pad Prism v6 进行图片绘制。两组间均数比较采用t检验,方差不齐采用非参数检验,多组间均数比较采用方差分析,单因素及多因素分析采用COX逻辑回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者GPR37 表达水平的比较
510 例肺腺癌样本中,肿瘤组中GPR37 的表达水平高于癌旁对照组,差异有统计学意义(P<0.05)(图1A,见封三)。56 例癌旁正常组织和肿瘤组织配对检测数据显示在肿瘤组中GPR37 的表达量多于癌旁对照组,差异有统计学意义(P<0.05)(图1B,见封三)。图1均摘自TCGA 数据库。
2.2 GPR37 表达水平与肺腺癌患者预后关系的分析
采用TCGA 对GPR37 表达与肺腺癌患者预后关系进行生存预后分析,结果显示,GPR37 表达水平与肺腺癌患者预后有显著相关性,差异有统计学意义(P<0.05)(图2,见封三)。
2.2.1 GPR37 的表达水平的单因素分析 单因素COX逻辑回归分析显示,GPR37 的表达水平与性别、年龄以及M 分期无关,差异无统计学意义(P>0.05),与Stage 分期中T 分期、N 分期有关,差异有统计学意义(P<0.05)(表1)。
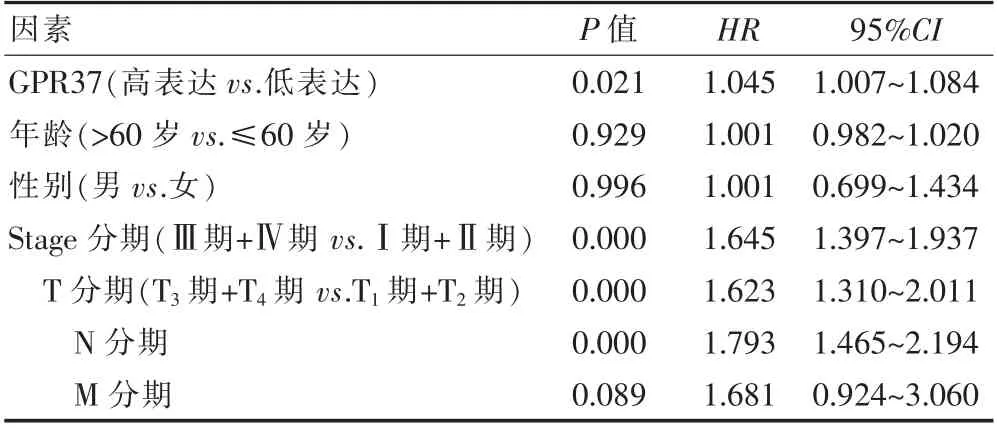
表1 单因素COX 逻辑回归分析
2.2.2 GPR37 的表达水平的多因素分析 多因素COX风险比例模型结果显示,高GPR37 表达水平、Stage分期是肺癌患者预后差的独立危险因素(P<0.05)(表2)。
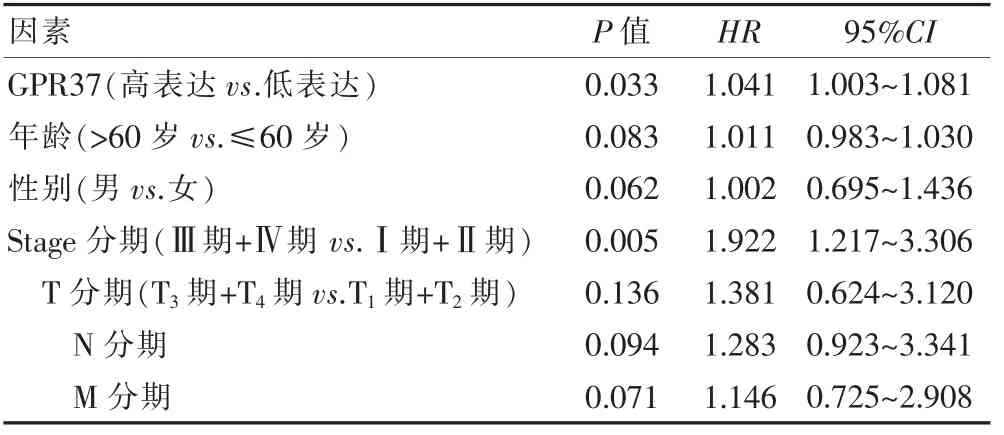
表2 多因素COX 逻辑回归分析
3 讨论
肺癌按照癌细胞组织来源可分为大细胞肺癌、小细胞肺癌(small cell lung cancer,SCLC)、腺癌(lung adenocarcinoma,LUAD)、鳞癌(lung squamous cell carcinoma,LSCC)等类型,肺腺癌目前已成为最常见的肺癌病理类型[7-8]。并且肺癌已经成为当今世界上发病率和死亡率最高的肿瘤。大部分患者发现时已属于中晚期,五年预后率相对较低,对社会和家庭造成了极大的损失。所以寻找有效的早期诊断和指导预后的指标对于肺癌的治疗尤为重要。肿瘤微环境时刻影响着肿瘤细胞的发生发展,而GPCR 是细胞与外部的信息交换不可或缺的组成部分。研究证实GPR37 是Parkin的底物,在常染色体隐性青少年帕金森病中异常积累,导致内质网应激和多巴胺能神经元死亡。GPR37还参与构成路易小体的核心结构,表现为更广泛地参与帕金森病病理。此外,GPR37 还参与调节多巴胺转运体和多巴胺D2 受体的功能,刺激多巴胺神经传递[9]。研究表明GPR37 可在发育过程中对少突胶质细胞分化和髓鞘形成发挥作用,推测GPR37 是治疗多发性硬化等脱髓鞘疾病的潜在药物靶标[10]。Fève 等[11]发现GPR37 在脑胶质瘤患者胶质瘤组织分离出的胶质瘤干细胞中高表达,从而推测GPR37 可能与胶质瘤的发生发展相关。以上结果表明GPR37 在中枢神经系统疾病中发挥着重要作用,但研究表明GPR37 还参与了其他肿瘤的发生发展,Wang 等[12]发现GPR37 可参与促进胃癌细胞的转移,而下调GPR37 表达会促进肝癌细胞的增殖并提高细胞周期中S 期的比例[13]。同时资料显示GPR37 的其他同源物质也与肿瘤密切相关,Yan 等[14]证实GPR87 可促进肝癌细胞中CD133+干细胞的生长和转移。GPR56 作为一种黏附受体,在急性淋巴白血病、胶质瘤、黑素瘤、等多种肿瘤细胞中呈高表达[15-17]。本研究结果显示,GPR37 在肺腺癌中的表达高于癌旁正常对照组,差异有统计学意义(P<0.05)。单因素COX逻辑回归分析显示,GPR37的表达水平与性别、年龄以及M分期无关,差异无统计学意义(P>0.05),与T 分期及N 分期有关,差异有统计学意义 (P<0.05)。生存预后分析结果显示,GPR37 表达水平与肺腺癌患者预后有显著相关性,差异有统计学意义(P<0.05),表达越高,预后越差。多因素COX风险比例模型结果显示,高GPR37 表达水平、Stage 分期是肺腺癌患者预后差的独立危险因素。
综上所述,本研究通过TCGA 数据库可知GPR37在肺腺癌中高表达,且与临床特征密切相关,推测GPR37 可能通过多种途径参与到肺腺癌的发生发展过程,从而影响肺腺癌患者的预后。因此,GPR37 可作为肺腺癌潜在治疗靶点或诊断标志物。
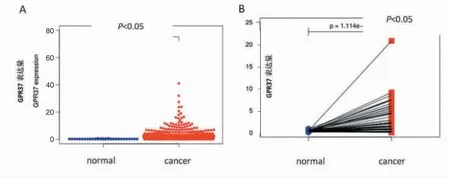
图1 两组患者的GPR37 表达水平(下转第113页)
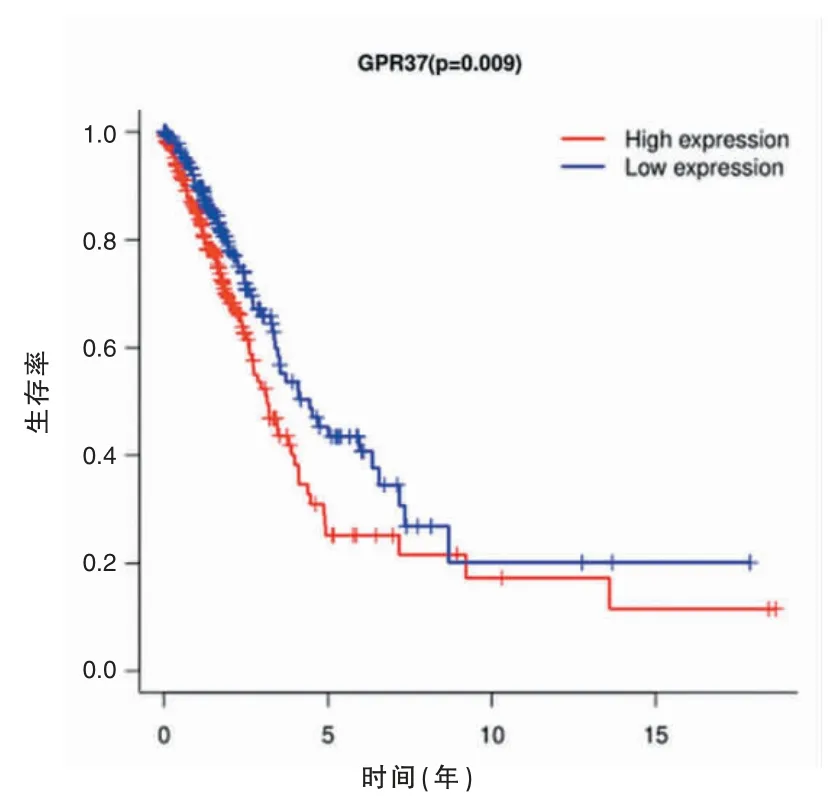
图2 GPR37 表达水平与肺腺癌患者预后的关系(下转第113页)
