丝瓜络固定生物氧化锰吸附重金属离子
2021-05-25孟佑婷
孟佑婷
(1.北京市科学技术研究院北京市辐射中心,北京100875;2.北京师范大学核科学与技术学院射线束技术教育部重点实验室,北京100875)
重金属是威胁生态环境安全和人类健康的重要污染物,其污染修复有多种方法,包括物理、化学和生物方法。生物吸附是一种环境友好型的修复技术,尤其是通过固定化微生物和纳米材料吸附溶液中的重金属离子受到越来越多的重视[1]。丝瓜络(Loo⁃fah sponge),又名丝瓜网、瓜络、丝瓜瓤,是葫芦科植物丝瓜干燥成熟果实的维管束,主要由纤维素、半纤维素和木质素组成,具有独特的多级孔隙结构和优良的机械强度[2]。丝瓜络作为固定化基质具有价格低廉、生物相容性好和环境友好等特点,目前多用于固定细菌、真菌和藻类制备复合吸附剂,吸附重金属和有机物[3-8]。
氧化锰是环境中重要的吸附剂、催化剂和氧化剂[9]。多种细菌[9-11]和真菌[12]均可以通过直接或间接作用形成生物氧化锰(Biogenic manganese oxides,BMOs)。锰生物氧化速率比化学氧化速率高几个数量级[13],因此推测环境中氧化锰的形成主要是微生物驱动的[14]。微生物主要通过多铜氧化酶[10,15]、漆酶[16]和动物血红素过氧化物酶[17]等催化锰的氧化,形成无定型态的BMOs 纳米微粒。BMOs 普遍比化学氧化锰的比表面积大[9],对重金属和放射性核素有良好的吸附[18-22]和氧化作用[23]。在实际应用中,游离氧化锰颗粒吸附重金属离子时存在回收和重复利用困难等问题。有文献报道了将化学氧化锰固定于生物炭[21,24]和沸石[25]来吸附重金属离子,但将BMOs 固定于丝瓜络并用于重金属离子吸附鲜有报道。丝瓜络固定BMOs 制备的复合吸附剂(Loofah sponge-immobilized biogenic manganese oxides,LIBMOs)可以提高吸附剂和金属离子的回收利用效率,并有利于改善吸附稳定性。本文制备植物-微生物复合吸附剂LIBMOs,研究该吸附剂的表面性质,并考察其对重金属离子的吸附特点。本研究将为水环境中重金属离子的去除提供理论依据和数据支撑。
1 材料与方法
1.1 BMOs合成
本文所用锰氧化细菌是一株蜡样芽孢杆菌Bacil⁃lus cereus CP133(CP133),筛选自昌平锰矿旧址[26]。该菌株合成的BMOs为无定形态的纳米微粒[26]。实验所用培养基为不添加pH 缓冲液的L2 培养基[18],具体成分为:胰蛋白胨2 g·L-1、酵母萃取物0.5 g·L-1、NaCl 0.15 mol·L-1、KCl 0.005 mol·L-1、MgSO40.025 mol·L-1、CaCl20.005 mol·L-1、CuSO4•5H2O 10 mg·L-1、ZnSO4•7H2O 44 mg·L-1、CoCl2•6H2O 20 mg·L-1、Na2MoO4•2H2O 13 mg·L-1。配制好的培养基高压蒸汽灭菌(121 ℃、30 min)后加入过滤灭菌(0.22 μm 滤膜)的MnCl2溶 液,终 浓 度 为10 mmol•L-1。BMOs 含 量 用Leucoberbelin Blue(LBB)方法测定[27],所用仪器为MD公司的SpectraMax M3。
1.2 LIBMOs制备
本文所用丝瓜络产自北京郊区。将丝瓜络剪成小块,用20%的NaOH 和一定量乙醇的混合溶液在室温25 ℃下浸泡48 h;然后在80 ℃恒温水浴中回流3 h;用去离子水洗涤NaOH 预处理的丝瓜络若干次,直至洗涤液呈中性,抽滤后70 ℃烘干备用。将2.0 g•L-1的天然丝瓜络(Loofah sponge,LS)或NaOH 预处理的丝瓜络(NaOH-treated loofah sponge,NaOH-LS)加入L2液体培养基中高压蒸汽灭菌后接种CP133,并添加MnCl2至10 mmol·L-1,振荡培养(25 ℃、150 r·min-1)14 d。分别在2、4、6、8、10、12、14 d取样检测LS和NaOHLS 体系中被丝瓜络固定的BMOs(Immobilized BMOs)和分散在培养基中的游离BMOs(Free BMOs)含量。14 d 后将LIBMOs 离心并用磷酸盐缓冲液清洗3 次后冷冻干燥,用于表面性质分析和重金属离子吸附实验。
1.3 LIBMOs表面性质分析
用扫描电镜(SEM,FEI Quanta 200)观察CP133、BMOs、丝瓜络和LIBMOs 的表面形貌,样品用导电胶固定在铜基板上,并做表面喷金处理。采用傅里叶红外光谱仪(Thermo,Nicolet iS 50)对丝瓜络和LIBMOs的表面官能团进行表征,采用KBr 压片法制样,扫描范围为4 000~400 cm-1,扫描次数为32次。
1.4 LIBMOs吸附重金属实验
LIBMOs 分别吸附重金属离子Pb2+、Cd2+、Cu2+和Zn2+,实验在50 mL 离心管中进行,反应体系10 mL,pH 6.0,LIBMOs 投加量为2.0 g•L-1。实验在25 ℃下进行,往复摇床转速100 r·min-1,设置3个平行。吸附动力学实验中4 种重金属离子的初始浓度均为0.1 mmol•L-1,振荡时间4 h。等温吸附实验中4 种重金属离子初始浓度均为0~0.8 mmol•L-1,振荡时间2 h。吸附实验结束后,分离LIBMOs 并检测残留在溶液中的重金属离子浓度。
LIBMOs 从溶液中吸附重金属离子的量q(mmol•g-1)按公式(1)计算[18]:
式中:[ Me ]0和[ Me ]t分别为重金属离子起始浓度和t时刻浓度,mmol•L-1;M 为吸附体系中 的LIBMOs 含量,g•L-1。重金属离子浓度用电感耦合等离子发射光谱法(ICP-AES)(Prodigy,Leeman Labs)测定。
用Langmuir 模型(公式2)和Freundlich 模型(公式3)拟合LIBMOs 吸附重金属离子的等温吸附实验数据[6]:

LIBMOs吸附重金属离子的动力学实验数据采用准一级动力学模型(公式4)和准二级动力学模型(公式5)进行拟合[2]。
式中:qt为t 时间重金属离子的吸附量,mmol•g-1;k1为准一级动力学吸附的速率常数,min-1;k2为准二级动力学吸附的速率常数,mmol•g-1•min-1。
采用软件Origin 2018进行数据分析和绘图。
2 结果与讨论
2.1 LIBMOs制备效果评估
添 加LS 和NaOH-LS 培 养14 d 后,CP133 合 成BMOs的总量差别不大,如图1所示。推测BMOs固定化的过程为:CP133 首先附着在丝瓜络表面并逐渐形成芽孢,芽孢氧化生成的BMOs 被固定在丝瓜络表面和分散到溶液中,最终两种状态的BMOs 达到平衡。NaOH-LS 体系固定BMOs 的比例[(固定化BMOs) ∕(固定化BMOs+游离BMOs)]和数量均高于LS 体系,培养14 d 后分别为79.66%(2.43 mmol•g-1)和49.39%(1.46 mmol•g-1)。这可能是因为NaOH 预处理在不破坏丝瓜络结构完整性的基础上,有效地去除了表面憎水性组分(胶质和蜡质等),增加了丝瓜络的亲水性,易于CP133芽孢的附着和BMOs的固定[28]。
2.2 LIBMOs表面性质分析
锰氧化细菌CP133未添加MnCl2的芽孢形态如图2A 所示,形成的BMOs 大量附着在芽孢表面(图2B)。天然丝瓜络中有大量螺旋状纤维管束结构分布,且纤维表面被丰富的木质素层覆盖,结构粗糙。经过NaOH 预处理,部分木质素和半纤维素被去除,横截面密集分布的微小孔洞暴露出来(图2C),可能使丝瓜络的比表面积增大。经过与CP133 共培养,NaOH预处理的丝瓜络表面可见密布的CP133芽孢和BMOs(图2D),表明该丝瓜络样品对CP133和BMOs的固定化效果良好。
丝瓜络固定BMOs 前后的FTIR 图谱如图3 所示。参考相关文献[2,29-30],确定了丝瓜络的红外光谱特征峰及峰的归属,详见表1。丝瓜络在3 289 cm-1的宽大吸收峰表征羟基(—OH)的伸缩振动,在2 919 cm-1有对应的亚甲基(—CH2)反对称伸缩振动。NaOH 预处理后,分子内氢键使—OH 吸收峰伸缩振动向低波数方向移动。两种类型丝瓜络接种CP133 后,—CH2的吸收峰基本消失,表明纤维素内部部分氢键断裂,其内聚力减小。1 735 cm-1吸收峰表征半纤维素中乙酰基或羧基的C==O 伸缩振动,间接表示半纤维素的分布。该峰的强弱一般可以表征木质素与半纤维素连接的强弱。1 629 cm-1和1 509 cm-1的吸收峰表征苯环骨架的伸缩振动和变形振动,表征纤维素的分布。NaOH 预处理或接种CP133 后,1 735、1 629、1 509 cm-1和1 023 cm-1吸收峰消失或减弱,表明木质素结构受到破坏。推测表面裸露的羟基、胺基、羰基等基团更有利于固定CP133和BMOs颗粒。
2.3 LIBMOs吸附重金属的性能
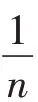
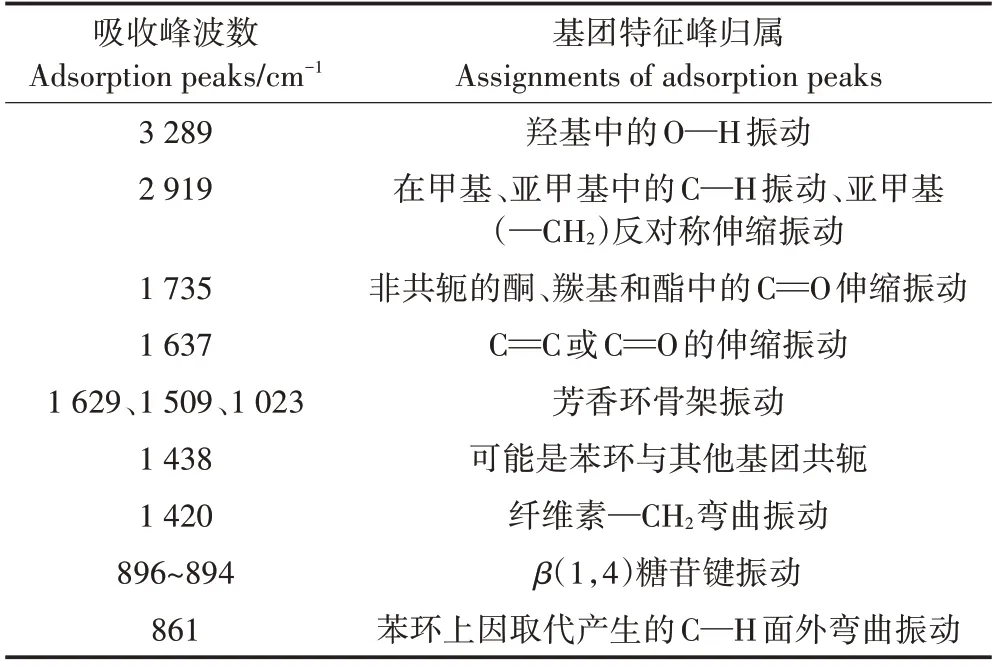
表1 丝瓜络红外光谱的吸收峰及主要归属Table 1 FTIR absorption peaks of loofah sponge and main assignments
表3 总结了文献报道的丝瓜络相关吸附剂对不同重金属离子的吸附量,包括天然丝瓜络、改性丝瓜络和丝瓜络固定微生物吸附剂。与文献报道的吸附量相比,本文所用的LIBMOs 对几种重金属的吸附量有一定优势,这主要归因于BMOs 对重金属离子的高吸附量。文献报道的丝瓜络相关吸附剂对重金属离子的吸附多符合Langmuir 模型。在本文中Langmuir和Freundlich 模型对LIBMOs 吸附Pb2+和Cd2+的数据拟合相关性系数均较高(R2>0.95),表明LIBMOs 对Pb2+和Cd2+有更大的吸附潜力,可能同时存在外表面吸附、内表面吸附和同晶置换[31-32]。
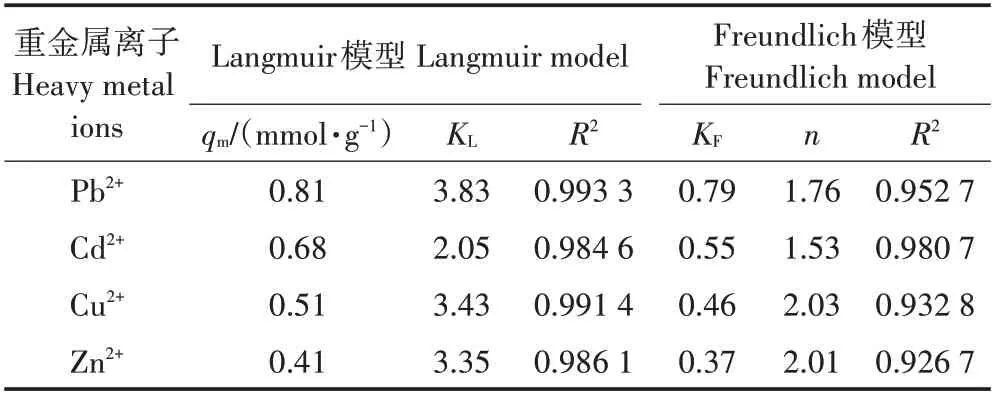
表2 LIBMOs对重金属离子的吸附等温线拟合参数Table 2 Adsorption isotherm parameters of heavy metals on LIBMOs
当吸附时间达到60 min 时,LIBMOs 对几种重金属离子的吸附速率均趋于平缓,吸附90 min时均达到吸附平衡(图5)。这是由于在吸附初始阶段重金属吸附于LIBMOs 表面的过程较快且效果明显。随着吸附时间延长,传质动力减小,金属离子开始渗透到LIBMOs 的内部孔隙结构中,吸附位点与重金属离子的接触时间延长,吸附过程趋于缓慢。
用准一级动力学模型和准二级动力学模型拟合的吸附动力学参数见表4。结果表明,准一级动力学模型均较好地拟合4 种重金属离子的吸附过程(R2>0.95)。同时,Pb2+、Cd2+和Zn2+的吸附过程也符合准二级动力学模型(R2>0.95),表明LIBMOs 吸附3 种重金属离子的过程(包括液膜扩散、表面吸附和颗粒内扩散)存在相似性;Cu2+吸附于LIBMOs 的过程更符合准一级动力学模型,表明其仅在初始阶段的快速吸附过程与另外3 种重金属离子相似,而在进入LIBMOs 内部结构的吸附过程可能有其自身特点。另外,Cu2+作为重要的辅因子参与丝瓜络表面CP133 芽孢氧化锰的过程[9-11],这也会增加Cu2+吸附过程的复杂性。
3 结论
(1)利用锰氧化细菌将生物氧化锰成功固定于NaOH 预处理的丝瓜络表面,制成植物-微生物复合吸附剂LIBMOs。
(2)将LIBMOs 用于吸附溶液中重金属离子Pb2+、Cd2+、Zn2+和Cu2+,其理论饱和吸附量与其他丝瓜络吸附剂相比有一定优势。其中LIBMOs 对Pb2+和Cd2+的吸附行为同时符合Langmuir 和Freundlich 等温吸附模型,表明LIBMOs 对这2 种重金属离子有较强的吸附潜力。
(3)LIBMOs环境友好且成本低廉,在水环境重金属离子去除应用中有较好的前景。

表3 丝瓜络相关生物吸附剂对重金属离子的吸附量Table 3 Comparison of adsorption capacities of heavy metal ions by loofah sponge-related sorbents

表4 LIBMOs吸附重金属离子的动力学模型拟合参数Table 4 Kinetic parameters for the adsorption of heavy metal ions onto LIBMOs
